化学清洗及干燥方法对盖玻片亲水性的影响
杨珊,王鹏,崔颖鲁,邹建锋,邹智勇
(1.陕西师范大学 材料科学与工程学院,陕西 西安 710062;2.渭南师范学院 化学与生命科学学院,
陕西 渭南 714099;3.渭南师范学院 附属医院,陕西 渭南 714099)
对玻璃材料进行表面修饰以改善其表面性质的研究由来已久,其技术方法广泛用于日用品、工程建筑、军事国防、生物医学环境等领域[1-5]。尤其在生物医学领域中,玻璃作为载体片基,广泛应用于生物医用材料、基因芯片、蛋白质芯片、酶传感器、细胞培养基、组织工程生物材料等方面[3-4]。玻璃片基在使用前都需要进行预处理,目的是除去表面的无机和有机污物,同时对片基进行表面活化处理,使其表面产生大量羟基、氨基、巯基等反应性基团[4],以便接枝或涂覆有机分子、聚合物、生物分子等,制成所需的功能化器件。一般来说,表面羟基化是玻璃片基预处理最常用的方法。由于表面羟基量直接影响后续修饰效果,因而表面羟基化是玻璃表面修饰的关键步骤。
玻璃表面羟基化的方法分为干法和湿法两类。等离子体表面处理为干法技术,对玻璃有表面清洁和刻蚀的作用,有着快速、高效、节水、环保的优势,且反应仅发生在材料浅表面,无损基质,表面处理的均匀性好,尤其适合处理形状复杂的材料[4-8]。利用O2、H2O、O2/O3、O2/H2O2、空气等气体进行等离子体表面处理,可在材料表面产生羟基等含氧官能团,提高材料表面的亲水性[4-7]。田继文等[4]利用该技术对玻璃进行表面羟基化处理,获得了粗糙度小、接触角5 ~7°的亲水性表面。等离子体表面羟基化处理的优势明显,但需要高压、高频和高工作气压的专门装置[4-9]。湿法技术虽有增大玻璃片基表面粗糙度的缺点[4-10],但使用方便、灵活,故而被广泛应用[11-14]。湿法技术,即化学清洗法,是利用浓酸或浓碱等的溶解和腐蚀作用,除去玻璃表面的有机物和金属杂质,使其离解出表面的Na+、K+、Ca2+等阳离子,同时使表面键合断键成为Si—OH 基团[4]。
常用的化学清洗试剂有:①Piranha 溶液,又称食人鱼溶液,为浓H2SO4/H2O2=9 ∶1[15]、4 ∶1[16]、7∶3[14,17]或3 ∶1[18-20](v/v)的溶液;②氨水双氧水溶液,简称RCA 溶液,为H2O2/NH4OH/H2O =1 ∶1 ∶5(v/v/v)的溶液[13,17-19,21];③盐酸双氧水溶液,为浓HCl/H2O2/H2O= 1 ∶1 ∶6 (v/v/v)的溶液[18];④NaOH 溶液[3]等。化学清洗对玻璃进行表面羟基化的报道众多,但鲜见各方法处理效果的比较研究。本文通过测试盖玻片对水的动态接触角(DCA),研究化学清洗的方式、干燥方式和干燥时间对玻璃表面亲水性的影响规律,以期获得玻璃表面羟基化的最佳化学清洗及干燥途径。
1 实验部分
1.1 材料与仪器
洗洁精(白猫牌);95%乙醇、浓H2SO4(98%)、浓HCl、浓氨水(25%)、双氧水(30%)、NaOH 均为分析纯;二次蒸馏水。
DCAT11 型表面张力仪;THX-05 低温恒温循环器;DHG9075A 电热鼓风干燥箱;盖玻片(尺寸
24 mm ×24 mm ×0.17 mm)。
1.2 盖玻片的洗涤和干燥
取盖玻片若干,在洗洁精溶液中浸泡洗涤30 min,用蒸馏水反复冲洗,以除去表面有机污垢,然后按如下步骤分别洗涤:①在食人鱼溶液(浓H2SO4/H2O2,7 ∶3,v/v)中浸泡1 h,用蒸馏水充分清洗;②在RCA 溶液(H2O2/NH4OH/H2O,1∶1∶5,v/v/v)中浸泡30 min,用蒸馏水充分冲洗;③在盐酸双氧水溶液(浓HCl/H2O2/H2O,1 ∶1 ∶6,v/v/v)中浸泡2 h,用蒸馏水充分冲洗;④在95%乙醇中浸泡2 h,用蒸馏水冲洗干净,再在5%NaOH 溶液中浸泡1 h,用蒸馏水充分冲洗。洗涤后的盖玻片,部分晾干处理,部分烘干处理,比较烘干时间和烘干温度对盖玻片亲水性的影响。
1.3 盖玻片的亲水性测试
用表面界面张力仪测试盖玻片对水的DCA。测试条件为:润湿介质为二次蒸馏水,测试温度(20±0.1)℃,片基的浸入深度为10 mm,前进角(θA)和后退角(θR)的测试速率皆为0.05 mm/s,表面测定阈值为8.00 mg,取点频率5 Hz,连续测试两个循环。使用文献[22]报道的方法处理数据,接触角(CA)和浸入深度的曲线见图1(图中1、2 代表测试的循环数),取第1 循环测得的θA和θR进行分析。
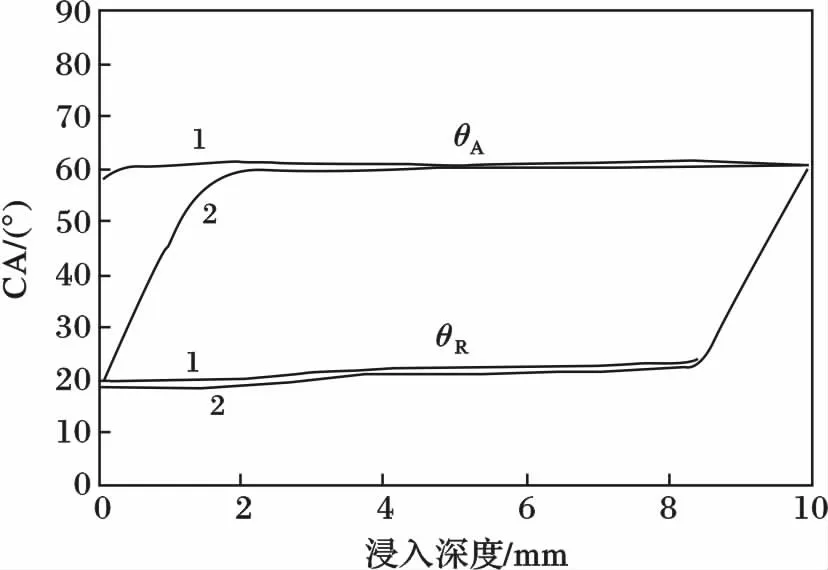
图1 盖玻片的DCA 曲线Fig.1 The DCA curve of cover glass
2 结果与讨论
普通清洗仅能除去盖玻片表面的有机污物,并不能改善其表面亲水性。普通清洗常用的洗涤剂有丙酮、无水乙醇、洗洁精溶液等[3,23]。洁净的盖玻片有一定的亲水性,经洗洁精溶液洗涤后的盖玻片θA为50°、θR为8°;高温烘干会使其θA和θR皆增大,且θA和θR随着烘干时间的延长也略增大,见图2。
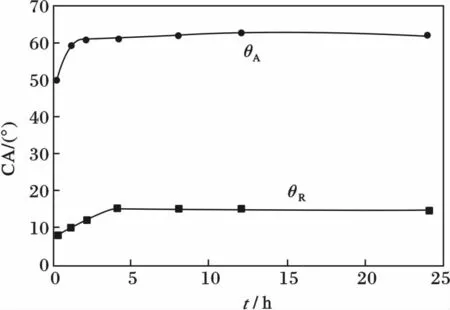
图2 烘干时间对洁净盖玻片DCA 的影响(100 ℃)Fig.2 Effect of drying time on DCA of clean cover glass (at 100 ℃)
2.1 清洗方法对盖玻片亲水性的影响
食人鱼溶液、RCA 溶液、盐酸双氧水溶液以及NaOH 溶液皆为腐蚀性溶液,分别经过这4 种溶液洗涤后,盖玻片晾干及在100 ℃烘干不同时间的接触角曲线,见图3。
由图3 可知,食人鱼洗涤之后θA为11°、θR为5°,RCA 溶液洗涤之后θA为45°、θR为8°,盐酸双氧水溶液洗涤之后θA为21°、θR为6°,NaOH 溶液洗涤之后θA为35°、θR为6°。各方法洗涤之后的盖玻片在烘干或晾干过程中θA和θR都随着时间的延长而增大,而且长时间干燥对亲水性较好的表面接触角的增大更显著(图3a、3c)。在晾干和烘干过程中,部分Si—OH 之间脱水缩合,形成Si—O—Si 基团,故而亲水性降低,接触角增大。洁净、干燥的盖玻片在空气中放置3 d 或更久时间,其θA和θR会有明显的增大,这可由“时温等效原理”解释:低温长时间作用的效果相当于高温短时间作用的效果。与晾干相比,烘干对盖玻片表面的亲水性更为不利。然而,快速烘干(1 ~2 h)在实际实验中是非常必要的,其对盖玻片的亲水性的不利影响也相对较小。
比较图2 和图3 可知,上述4 种清洗方法均对盖玻片有一定的表面羟基化处理能力,其中食人鱼溶液的表面羟基化能力最强,盐酸双氧水溶液次之,RCA 溶液和NaOH 溶液都较差。据报道[2],依次用食人鱼溶液、RCA 溶液和盐酸双氧水溶液这3 种溶液洗涤所得盖玻片的亲水性非常好,可达θA为8°、θR为5°。
综上所述,为增加盖玻片表面亲水性,可通过食人鱼溶液清洗或依次用食人鱼溶液、RCA 溶液和盐酸双氧水溶液进行清洗的方法达到。为保证亲水性效果最佳,表面羟基化处理后的盖玻片最好在水中封存,在使用前晾干或烘干1 ~2 h 即可。
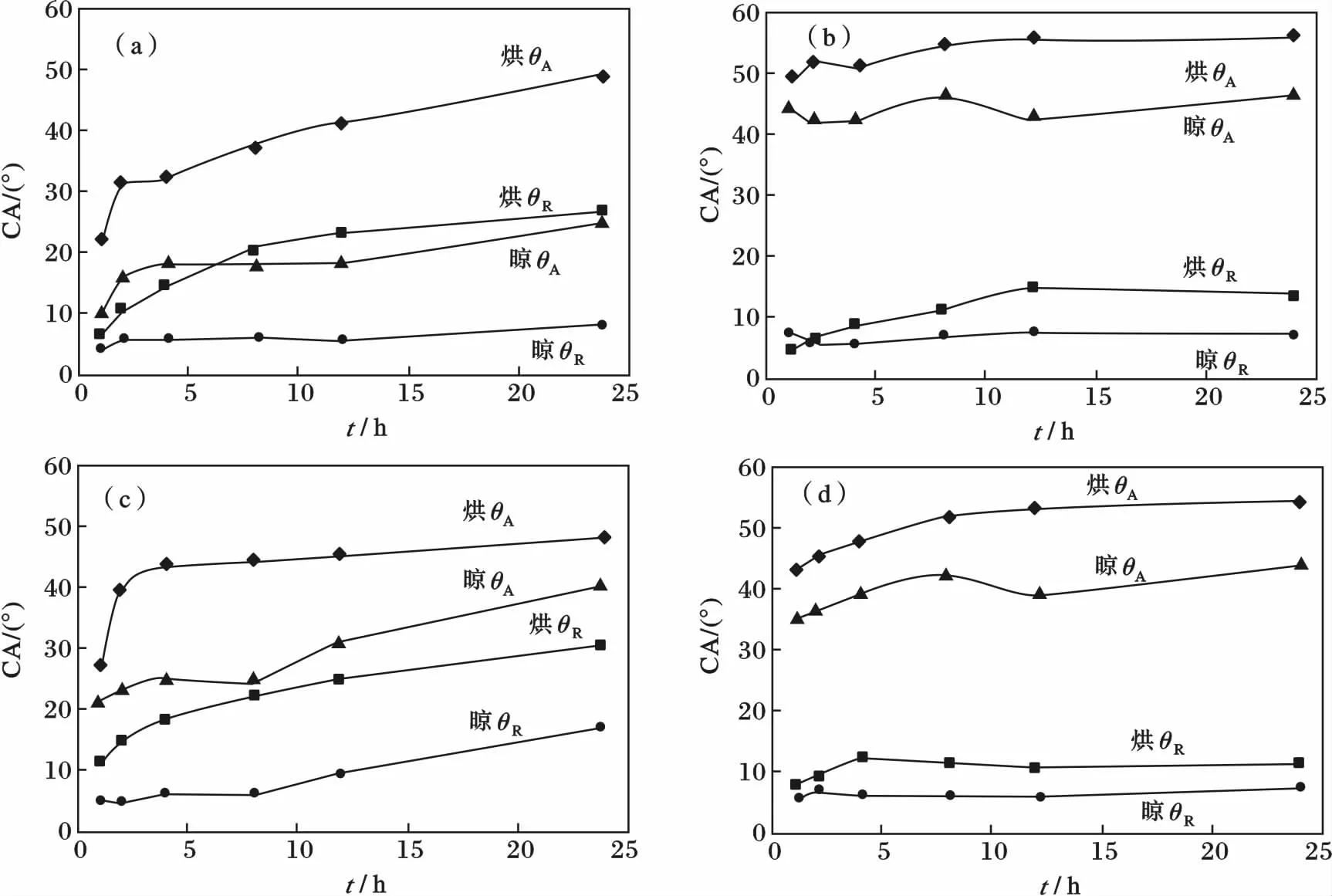
图3 4 种洗涤方法下晾干和烘干(100 ℃)时间对盖玻片DCA 的影响Fig.3 Effect of drying time in air or at 100 ℃on DCA of cover glass cleaned by 4 kinds of different methods
2.2 干燥温度对盖玻片亲水性的影响
食人鱼溶液清洗后的盖玻片在90,100 ℃和110 ℃下烘干的θA和θR随时间的变化曲线见图4。
由图4 可知,不同温度下烘干时,盖玻片的θA和θR皆随时间的延长而增大,亲水性变差。这皆为热处理会导致玻璃表面部分Si—OH 之间脱水缩合的结果。90 ℃烘干对亲水性的不利影响最大,100 ℃和110 ℃的烘干的影响反而较小,其中100 ℃烘干的效果较好。
由于前进角反映表面疏水基团与水的相互作用,后退角则反映表面亲水基团与水的相互作用,故而盖玻片对水的θA和θR分别由其表面疏水的Si—O—Si 和Si—OH 基团的相对数量决定。据此推测,造成图4(a)中θA曲线变化的原因可能如下:100 ℃热处理能使盖玻片表面亲水的Si—OH 快速达到缩合平衡,形成疏水的Si—O—Si 键并遮蔽大部分剩余的Si—OH,故再继续热处理θA的变化不太大;而90 ℃热处理时,Si—OH 间的缩合相对较慢,故而盖玻片的表面结构固定慢,未缩合的Si—OH 能够从Si—O—Si 键的遮蔽下调整到表面而缩合,导致θA大幅增加;然而,110 ℃热处理则因温度过高,导致Si—OH 间的缩合过快,故而在相同烘干时间下,其θA较100 ℃时要略大,同样由于Si—O—Si 键的遮蔽作用而导致θA略小于90 ℃时。而图4(b)中100 ℃和110 ℃的烘干的θR明显小于90 ℃的,这可能也是由于高温热处理能够使盖玻片表面的Si—OH 被快速遮蔽,故而亲水性比90 ℃烘干的要好。由此可见,对于玻璃表面,100 ℃热处理相对有利于亲水表面的固定。
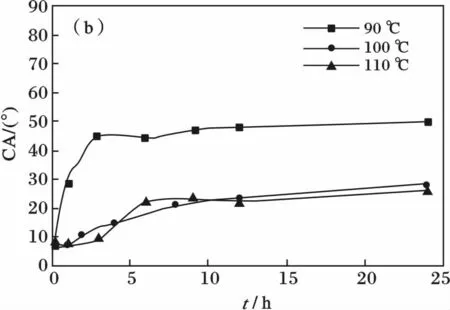
图4 烘干温度对盖玻片DCA 的影响Fig.4 Effect of drying temperature on DCA of cover glass
3 结论
使用食人鱼溶液、氨水双氧水溶液、盐酸双氧水溶液和NaOH 溶液等4 种洗涤液对盖玻片进行羟基化处理,并研究烘干及晾干方式及时间对盖玻片亲水性的影响。结果表明,用食人鱼溶液或依次用食人鱼溶液、RCA 溶液和盐酸双氧水溶液清洗的盖玻片的亲水性较好。晾干或100 ℃烘干1 ~2 h 对盖玻片的亲水性影响较小,长时间晾干或烘干皆会导致亲水性降低,尤其90 ℃烘干的不利作用最为明显。本研究为选择适当的化学清洗及干燥方法以获得表面亲水性较好的玻璃基质提供了帮助和支持。
[1] 李璐,李琛.不同清洁液对盖玻片质量的影响[J]. 解剖学研究,2013,35(5):399-400.
[2] 杨珊,杨占娴,宫永宽.玻璃表面仿细胞膜磷酰胆碱基团改性的新途径[J]. 功能材料与器件学报,2012,18(5):371-376.
[3] 杨珊.仿细胞膜结构聚合物的合成及其应用研究[D].西安:西北大学,2009.
[4] 田继文.低温等离子体技术在玻璃片基表面活化修饰中的应用[D].大连:大连轻工业学院,2005.
[5] Allen P B,Chiu D T.Calcium-assisted glass-to-glass bonding for fabrication of glass microfluidic devices[J]. Anal Chem,2008,80(18):7153-7157.
[6] 刘之景,李鑫辉. 等离子体技术在医用生物材料的应用[J].生物医学工程学杂志,2000,17(1):91-94.
[7] 张波.低温等离子体对材料的表面改性[J].现代物理知识,2006,18(6):37-40.
[8] 李俊岭,余慧.低温等离子体清洗设备[J].清洗世界,2005,21(5):31-34.
[9] 燕杰.低温等离子体处理技术及装置[D].青岛:中国石油大学,2011.
[10]Vo-Dinh T.Development of a DNA biochip:principle and applications[J]. Sensor Actuat B Chem,1998,51(1/2/3):52-59.
[11]李新昌,陈俊英,徐莉,等. 氧化钛薄膜表面羟基活化能力及对生物相容性的影响[J]. 功能材料,2008,39(8):1359-1362.
[12]李新昌,陈俊英,黄楠.两种不同结构TiO2薄膜生物活化能力比较[J].功能材料,2007,38(S):1813-1815.
[13]王洁颖,张首国,温晓雪,等. 玻璃珠表面修饰氨基的新型固相合成载体的制备[J]. 合成化学,2013,21(1):66-69.
[14]白涛,程先华.3-巯丙基三甲氧基硅烷自组装膜的制备及其摩擦学性能[J]. 上海交通大学学报,2007,41(2):293-296.
[15]Lenigk R,Carles M,Ip N Y,et al.Surface characterization of a silicon-chip-based DNA microarray[J]. Langmuir,2001,17(8):2497-2501.
[16]于英俊.有机分子链修饰碳纳米管及其在环氧树脂中应用研究[D].桂林:桂林电子科技大学,2010.
[17] Sfez R,Liu D Z,Turyan I,et al. Polyaniline monolayer self-assembled on hydroxyl-terminated surfaces[J].Langmuir,2001,17(9):2556-2559.
[18]刘虹,高志贤,王源升,等. 基于蛋白A 定向固定的Love 波免疫传感技术研究[J]. 分析化学,2006,34(S):73-77.
[19]Chaikin Y,Kedem O,Raz J,et al. Stabilization of metal nanoparticle films on glass surfaces using ultrathin silica coating[J].Anal Chem,2013,85(21):10022-10027.
[20]Tesler A B,Maoz B M,Feldman Y,et al.Solid-state thermal dewetting of just-percolated gold films evaporated on glass:development of the morphology and optical properties[J].J Phys Chem C,2013,117(21):11337-11346.
[21]Lin Y,Su Z,Balizan E,et al.Controlled assembly of protein in glass capillary[J]. Langmuir,2010,26 (15):12803-12809.
[22]杨珊,宫永宽.影响吊片法测试动态接触角的因素分析及数据处理程序的设计[EB/OL].中国科技论文在线,http://www. paper. edu. cn/releasepaper/content/201008-407,2010-08-26.
[23]周超,张慧婷,陈俊英,等. 用MicroBCA 方法定量检测硅烷化表面固定的纤维连接蛋白[J].功能材料,2011,42(11):2038-2041.

