浮游植物降解过程中的水体光学吸收特性变化研究
易梅森,段洪涛,张玉超,马荣华 (.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏南京 20008;2.西北大学城市与环境学院,陕西 西安 7027)
浮游植物降解过程中的水体光学吸收特性变化研究
易梅森1,2,段洪涛1*,张玉超1,马荣华1(1.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏南京 210008;2.西北大学城市与环境学院,陕西 西安 710127)
通过配制 3组不同浓度浮游植物,在室内进行长时间(37d)降解实验,分析水体光学吸收特性变化规律.结果表明:降解速度前 3d最快,25d后逐渐趋于稳定;浮游植物色素吸收系数( aph)随时间变化不断减小趋势明显,在分解过程中不同波段aph(440)、aph(624)、aph(675)与叶绿素浓度(Cchl)显著相关(R2>0.5984,P<0.05),悬浮颗粒物吸收系数ap(440)、ap(675)和总悬浮颗粒物浓度仅呈弱相关性(R2<0.4613); 有色可溶性有机物CDOM构成比较复杂且相对不稳定,非藻类颗粒物吸收系数ad(440)和光谱斜率Sd随时间变化均呈现不规律性.另外,与太湖同期野外采样点相比,室内降解实验的总颗粒物和浮游藻类色素吸收光谱更相似,Sd和Sg更大.通过研究浮游植物死亡分解过程中水体吸收特性的变化规律,有助于构建高精度的黑水团遥感监测模型,及时掌握黑水团信息.
浮游植物;黑水团;降解;吸收特性
随着社会经济的快速发展,水体富营养化引起的浮游植物水华频繁发生,已成为世界性环境问题[1].藻类水华死亡分解过程中不仅分泌毒素,更大量消耗溶解氧[2],对水体产生严重危害[3].
我国大型富营养化浅水湖泊的藻类水华治理还需要相当长的一段时间[4],在这种前提下,浮游藻类的遥感监测和预警具有十分重要的现实意义,便于及时采取防治措施,减轻危害.固有光学特性作为遥感反演模型的先验知识,是水色遥感研究的基础[5].黑水团是藻类死亡分解过程中厌氧条件下形成的,要监测黑水团,必须了解藻类消亡过程中的水体固有光学特性,特别是藻类分解过程中的吸收特性.吸收特性不随入射光场分布和强度的变化而变化,很多国内外学者都研究过各种水体的吸收特性或建立适合各自水体的遥感反演模型.藻类分解影响有色可溶性有机物(CDOM)分布,并可能影响沿海水域的热力分布,能潜在刺激哈德逊湾沿海水域的的生物量增长
[6].很宽浓度范围的湖泊 CDOM(ag(420)在0.68~11.13m-1)能够通过高级陆地成像仪的算法来映射[7].藻类降解是其污染环境的主要表现阶段,具有重要的研究价值.蓝藻厌氧分解会释放大量有机污染物和营养盐,且污染强度随蓝藻密度增高而变大[8].另外,细菌是湖泊中活性磷增加的驱动因素,藻类降解是其重要来源[9].然而,对浮游植物降解过程中的水体吸收特性变化的研究还比较少,尤其是不同浓度条件下降解的对比研究.
本研究通过采集太湖中的浮游藻类进行室内降解实验,分析整个过程中不同浓度藻液的各种吸收系数和物质变化的规律,并与同期太湖水体的吸收特性进行比较,探讨浮游藻类降解对水体的影响,从而为遥感监测藻类水华乃至黑水团现象奠定基础,具有重要的科学意义和实际应用价值[5].
1 材料与方法
1.1 实验布设
室内实验:2013年4月 3日于太湖梅梁湾,使用25号浮游植物生物网采集足够多的浮游植物样品,用去离子水冲洗3遍,以消除藻样中营养盐等的影响,尽量保证实验中没有生长而只有降解.再将藻液用去离子水配成1倍浓度、3倍浓度和4倍浓度的藻类水样,放入3个10L的棕色玻璃瓶,分别命名为样品Ⅰ、Ⅱ、Ⅲ.将3个玻璃瓶置于室内,并用铝箔纸将其包严(不封瓶口),使藻样在室温、黑暗的环境下培养.4月3日为初始样,分别于4月6日、4月9日、4月12日、4月15日、4月21日、4月27日、5月3日和5月9日进行采样;初期每3d一次,后期每6d一次,共计9次,合计37d.
野外实验:2013年3月25日~3月31日在太湖进行野外实验,共采集水样 30个,用于与室内实验结果进行对比.
1.2 水质参数的测定与计算
1.2.1 吸收系数的测定 颗粒物吸收采用定量滤膜方法进行测定.总悬浮颗粒物吸收系数(ap)的测定,通过直径47mm 的GF/F膜(孔径0.7um)对水样进行过滤,在岛津UV-2600紫外可见分光光度计测量滤膜上颗粒物的吸光度,然后使用Cleveland等[10]提出的公式进行放大因子校正,并计算得出 ap(λ).非色素颗粒物吸收系数(ad)的测定,采用Tassan等[11]提出的次氯酸钠法将滤膜漂白15min左右,去除藻样中的色素,然后按照测定ap的的方法,计算得出ad(λ).浮游藻类色素的吸收系数(aph),只需将总悬浮颗粒物吸收系数与非色素颗粒物吸收系数线性相减,即 aph(λ)=ap(λ)-ad(λ).有色可溶性有机物(CDOM)吸收系数(ag)的测定,通过孔径22µm的minipore膜对水样进行过滤,在 UV-2600上测量滤液的吸光度,然后根据Bricaud等[12]提出的方法对散射效应进行校正,并计算得到 ag(λ).另外,非色素颗粒物和 CDOM光谱斜率Sd、Sg的测定,采用最小二乘法对400~700nm波段在 Matlab中进行非线性拟合, 计算得到.
1.2.2 物质浓度的测定 叶绿素a浓度的测定,依据国家标准,通过GF/C膜(孔径1.2um)对水样过滤,然后使用反复冻融法进行细胞破碎,用90%丙酮溶液提取叶绿素,依次测定 750,664,647,630nm 波长处的吸光度,最后计算得出叶绿素 a的浓度.总悬浮颗粒物、有机和无机颗粒物浓度的测定,采用烘干称重法.溶解性有机碳(DOC)的测定,用烧过的GF/F膜对水样进行过滤,在1020型TOC仪对滤清液进行测量.
2 结果与讨论
2.1 浮游植物色素吸收系数(aph)
2.1.1 aph变化特征 样品Ⅰ、Ⅱ、Ⅲ所有9次采样的浮游藻类色素吸收光谱曲线,显示样品Ⅰ<Ⅱ<Ⅲ(图 1);但曲线的整体走势基本一致,在440,675nm处由于叶绿素a的吸收而有一个明显的峰值,在624nm处由于藻蓝素的吸收而有一个小峰值,在480nm处附近由于胡萝卜素的吸收而呈现肩状,在550nm处由于各种色素的弱吸收而出现一个谷底值.这与在野外水体环境下监测到的浮游植物色素曲线基本一致[13].440,675,624nm分别是浮游藻类叶绿素和藻蓝素的特征波长,各样点不同特征波长的 aph范围和平均值如表1所示.

图1 浮游藻类色素吸收光谱曲线Fig.1 Absorption spectral curve of phytoplankton(a)样品Ⅰ;(b)样品Ⅱ;(c)样品Ⅲ

表1 aph(440)、aph(624)、aph(675)的范围和平均值Table 1 The scope and mean of aph(440)、aph(624)、aph(675)
样品Ⅰ和Ⅱ的 aph随时间变化而不断减小的趋势十分明显(图 2),这是由于藻类色素的不断降解造成的.样品Ⅲ的 aph随时间变化的整体趋势减小,但是在第 4,13d有一个异常增高,可能是因为藻类依靠分解的养分而有部分的生长[9].样品Ⅰ、Ⅱ、Ⅲ的 aph均在 25d后逐渐平缓,主要是由于浮游植物降解过程基本结束.野外样点的aph平均值与样品Ⅰ的第1d值很接近(表 1),因此样品Ⅰ也可以看做是同等浓度野外浮游植物在室内条件下的降解实验.浮游藻类色素比吸收系数均值为样品Ⅱ<Ⅲ<Ⅰ,范围则是Ⅱ<Ⅰ<Ⅲ,可见比吸收系数并不完全受藻液浓度影响.野外样点的 a*ph(440)和 a*ph(675)范围为 0.033~0.249,0.015~0.108,这与 Le 等[14]、Bricaud 等[15]的研究结果一致,野外样点的比吸收系数均值则都比室内实验小.
2.1.2 aph与物质变化的关系 浮游藻类色素吸收系数很大程度上依赖于叶绿素 a浓度(Cchl)[25-26].图 3中,都呈现比较好的相关关系.样品Ⅰ、Ⅱ的aph与Cchl的拟合度非常好,样品Ⅲ的aph(440)、aph(624)、aph(675)均与 Cchl拟合度稍差.与同期太湖野外观测数据规律类似,aph(675)均值与 Cchl也存在显著相关(R2=0.77).另外,室内aph(624)与 Cchl的显著相关也体现了蓝藻在浮游植物群落中的相对稳定性和优势地位.

图2 各样品的aph(440)、aph(624)、aph(675)Fig.2 The variations among aph(440)、aph(624)and aph(675)
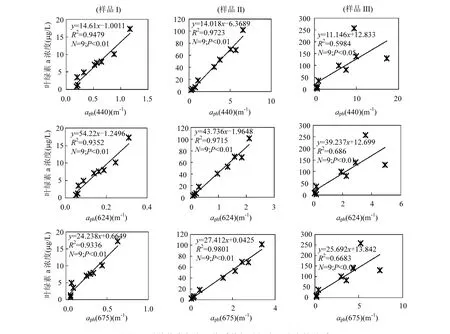
图3 浮游藻类色素吸收系数与叶绿素a浓度的关系Fig.3 Correlations between aph and concentration of chla
样品Ⅰ、Ⅱ、Ⅲ以及野外样点的aph与有机 悬浮颗粒物浓度均不存在显著相关性(R2<0.4691),说明降解过程中不仅生成浮游藻类色素颗粒物,还有非色素有机颗粒物,从而对其产生影响.
2.2 非色素颗粒物吸收系数(ad)
2.2.1 ad变化特征 图4分别为样品Ⅰ、Ⅱ、Ⅲ所有9次采样的非色素颗粒物吸收光谱曲线,很明显,样品Ⅰ<Ⅱ<Ⅲ.这是由于原始藻类浓度越高,非色素颗粒物的来源也越多.ad曲线在 400~700nm不断减小,于 700nm 后逐渐趋近于零,呈指数衰减形式;且波长越短,吸收系数变化趋势越大.
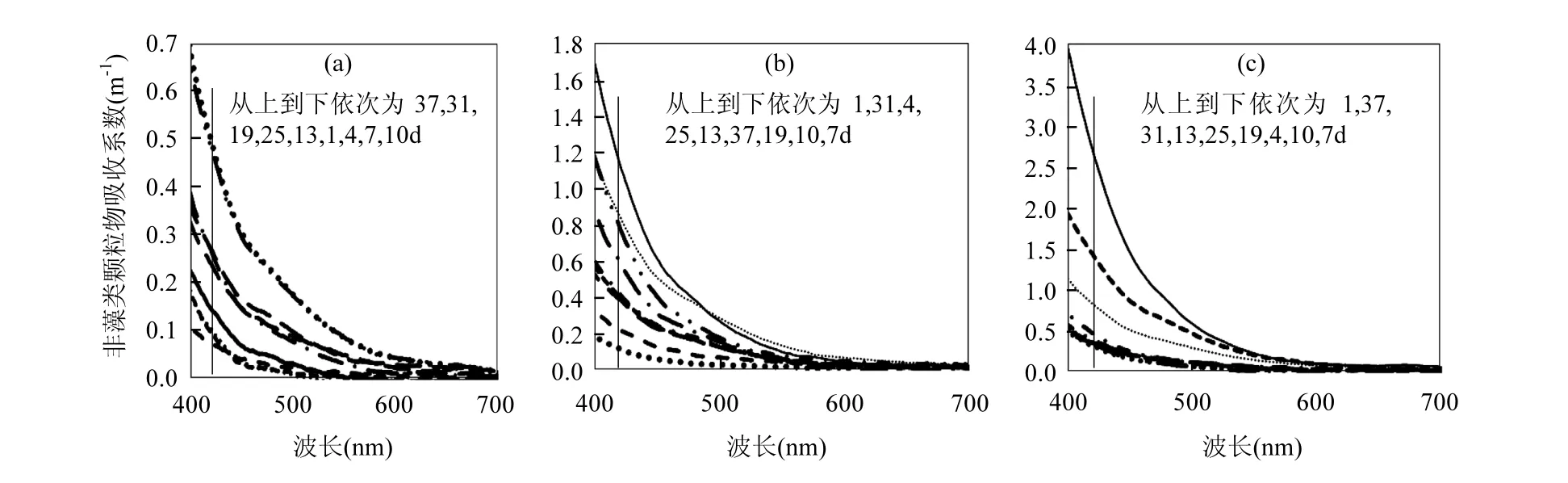
图4 非色素颗粒物吸收光谱曲线Fig.4 Absorption spectral curve of non-algal particles(a)样品Ⅰ;(b)样品Ⅱ;(c)样品Ⅲ
样品Ⅰ、Ⅱ、Ⅲ的ad(440)范围分别为0.04~0.35,0.06~0.74,0.19~1.75m-1,均值分别为(0.16±0.11),(0.36±0.20),(0.52±0.50)m-1.样品Ⅱ、Ⅲ的ad(440)最大值都在第 1d,样品Ⅰ则出现在第37d(图5).3组样品的ad(440)均在前7d快速下降,于第7d达到最小值.第7~37d,ad(440)的变化呈现不规律性,主要是由于水华蓝藻死亡分解过程中,不断生成胶体与颗粒物,水样中无机颗粒物存在降解释放和聚集沉淀的动态平衡,当释放速度>沉淀速度,则 ad(440)增加,当平衡向另一方向移动,则 ad(440)减少[16].另外,太湖野外样点 ad(440)范围为 0.49~6.34m-1,均值为(2.69±1.64)m-1,远高于样品Ⅲ.太湖水体外源较多,以无机颗粒物占主导[17];而室内模拟水体由于藻液配置时反复洗涤,无机颗粒物主要靠藻类分解产生,因此远低于太湖野外水体.
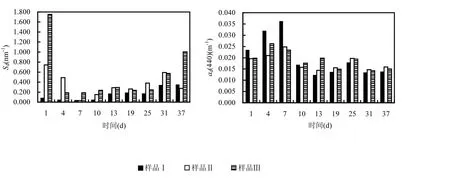
图5 各样品的ad(440)、SdFig.5 The ad(440) and Sd among samples
Sd体现了 ad随波长衰减的程度,其随时间变化的不规律性也表明无机颗粒物动态平衡的复杂性.样品Ⅰ、Ⅱ、Ⅲ的Sd均值分别为(0.020±0.008),(0.018±0.003),(0.019±0.004)nm-1,表明非色素颗粒物的降解速度并不受藻液浓度影响,太湖野外样点的情况也证实了这一点(R2=0.0151).样品Ⅰ、Ⅱ的 Sd在第 7d达到最高值,样品Ⅲ则在第4d达到最高值.30个野外采样点的 Sd均值为(0.014±0.001)nm-1,比室内降解实验的Sd值均低.
2.2.2 ad与物质变化的关系 非色素颗粒物包括无机颗粒物和非色素有机颗粒物,将ad(440)与无机悬浮颗粒物浓度(CSPIM)进行相关性分析(图6).样品Ⅰ的ad(440)与CSPIM呈显著相关,样品Ⅱ、Ⅲ的ad(440)与CSPIM不存在显著相关,而ad(440)对应的是无机颗粒物和非色素有机颗粒物,CSPIM对应的是无机颗粒物,这说明原始低浓度藻液如样品Ⅰ降解时,非色素颗粒物以无机颗粒物为主,原始高浓度藻液如样品Ⅱ、Ⅲ分解时伴有大量非色素有机颗粒物.野外样点的浮游藻类浓度与样品Ⅰ第 1d相近,其 ad(440)与 CSPIM呈显著相关(R2=0.57,P<0.01).

图6 非色素吸收系数与无机悬浮物浓度的关系Fig.6 Correlations between ad and concentration of inorganic suspended matter(a)样品Ⅰ;(b)样品Ⅱ;(c)样品Ⅲ
2.3 总颗粒物吸收系数(ap)
2.3.1 ap特征变化 总颗粒物由浮游植物色素和非色素颗粒物共同组成.图 7为样品Ⅰ、Ⅱ、Ⅲ 9次采样的总颗粒物吸收光谱曲线,相应的吸收系数样品Ⅰ<Ⅱ<Ⅲ,主要是由于高浓度藻液降解产生的颗粒物更多.曲线的变化趋势与浮游藻类色素吸收光谱曲线相似,从间接表明样品Ⅰ、Ⅱ、Ⅲ中的颗粒物构成都比较均一[18-19],来源一致;但是相对于太湖野外采样点(图8),两者ap有较大不同,主要差别在于440nm.太湖野外样点ad(440)占ap(440)的 69%,无机颗粒物主导;而室内样品Ⅰ、Ⅱ、Ⅲ的 ad(440)只占ap(440)的24%、11%、10%,由浮游植物色素主导.而浮游植物色素与非色素颗粒物曲线有较大的不同,最终导致室内 ap曲线与太湖野外水体的差异.

图7 总颗粒物吸收光谱曲线Fig.7 Absorption spectral curve of total suspended particles(a)样品Ⅰ;(b)样品Ⅱ;(c)样品Ⅲ

图8 30个野外样点的总颗粒物吸收光谱曲线Fig.8 Spectral curve of the 30field points’ ap

图9 各样品的ap(440)和ap(675)Fig.9 The ap(440)and ap(675)of each sample
样品Ⅰ和Ⅱ的 ap随时间推移而变小的趋势比较明显(图9).在第 1d最高,25d后逐渐趋于平缓.样品Ⅲ的 ap受高浓度的影响,规律不明显,第4,13d异常增高.野外样点的 ap(440)和 ap(675)范围分别为 1.57~8.38 ,0.27~1.70m-1(表 2),平均值分别为(3.90±1.96),(0.69±0.37) m-1,界于样品Ⅰ和Ⅱ之间.

表2 ap(440)、ap(675)的范围和平均值Table 2 The variations and mean of ap(440)、ap(675)
2.3.2 ap与物质变化的关系 样品Ⅲ的ap(440)、ap(675)与总悬浮颗粒物浓度呈显著相关(图 10),样品Ⅰ、Ⅱ的 ap(440)、ap(675)与总悬浮颗粒物浓度不存在显著相关.30个野外采样点的ap(440)、ap(675)和总悬浮颗粒物浓度也仅呈弱相关性.这主要有两点原因:一是由于测定 ap的GF/F膜孔径比测定悬浮物的GF/C膜孔径小,过滤后二者对应的物质有所不同;二是由于每个滤膜上无机物和有机物比例并不相同,也导致ap和总悬浮颗粒物浓度无法线性相关.

图10 总颗粒物吸收系数与总悬浮物浓度的关系(样品Ⅲ)Fig.10 Correlations between ap and concentration of total suspended particulates(SampleⅢ)
2.4 CDOM吸收系数(ag)
2.4.1 ag变化特征 图 11分别为样品Ⅰ、Ⅱ、Ⅲ 9次采样的 CDOM 吸收光谱曲线,与非色素颗粒物的光谱特征相似.曲线在 400~700nm不断减小,至 700nm处逐渐趋近于零.样品Ⅰ、Ⅱ、Ⅲ的 ag均在第 1d最低,而后随时间变化不规律,也体现了蓝藻降解过程中生成CDOM的复杂性.

图11 CDOM吸收光谱曲线Fig.11 Absorption spectral curve of CDOM(a)样品Ⅰ;(b)样品Ⅱ;(c)样品Ⅲ
通常用 355,375,440nm波长处的吸收系数来表现CDOM的浓度[20-21].蓝藻降解是CDOM的重要来源[22],随着降解进行,样品Ⅰ、Ⅱ、Ⅲ的ag(440)均在前7d不断增大.ag(440)在第7~37d高低交错变化,这是由于CDOM的相对不稳定性造成[23].各样品的ag(440)范围分别为0.06~0.40, 0.06~0.49,0.07~0.73m-1,均值分别为(0.29±0.10),(0.29±0.12),(0.39±0.19)m-1.样品Ⅰ、Ⅱ、Ⅲ的 Sg均值分别为(0.015±0.006),(0.017±0.005),(0.016±0.004)nm-1.可见,CDOM的含量和Sg并不完全由藻液浓度决定.太湖野外样点 ag(440)均值为(0.65±0.18)m-1,比室内样品都高;Sg为(0.013±0.002)nm-1,比室内样品均低.这是由于太湖中 CDOM 的来源复杂,除了水体中浮游植物本身降解外,还有外源径流的补充[24].

图12 各样品的ag(440)、SgFig.12 The ag(440)and Sg of each sample
2.4.2 ag与物质变化的关系 样品Ⅰ、Ⅱ、Ⅲ的 ag(440)与可溶性有机碳浓度(CDOC)以及 Cchl均不存在显著相关性,可能是由于CDOM构成的复杂性所影响[27].Sg与 ag(440)均呈显著相关(图13),也是由于蓝藻降解是本试验 CDOM 的唯一来源,说明水样中中腐植酸与灰黄酸关系稳定[28-29].30个野外采样点的 Sg均值为(0.013±0.002)nm-1,与样品Ⅰ相近.
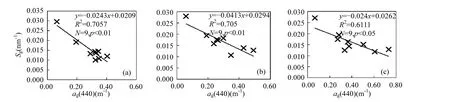
图13 CDOM特征参数ag(440)与Sg的关系Fig.13 Correlations between ag(440) and Sg(a)样品Ⅰ;(b)样品Ⅱ;(c)样品Ⅲ
3 结论
3.1 浮游藻类降解速度前3d最快,25d后逐渐趋于稳定.
3.2 由于藻类色素的不断降解,aph随时间变化而不断减小趋势十分明显;另外在分解阶段 aph与叶绿素 a浓度高度相关,而与有机悬浮物浓度不存在显著相关性,说明藻类分解过程中产生了大量的非色素有机颗粒物.
3.3 样品Ⅰ中非色素颗粒物吸收 ad(440)与CSPIM呈显著相关,而样品Ⅱ、Ⅲ的ad(440)与CSPIM不存在显著相关,说明低浓度藻液降解时,非色素颗粒物以无机颗粒物为主,高浓度藻液分解时伴有大量非色素有机颗粒物.
3.4 ag(440)随时间变化不规律,且与 CDOC、Cchl均不存在显著相关性,体现了CDOM构成的复杂性和不稳定性.
[1] 陆桂华,马 倩.2009年太湖水域“湖泛”监测与分析 [J]. 湖泊科学, 2010,(4):481-487.
[2] 盛 东,徐兆安,高 怡.太湖湖区“黑水团”成因及危害分析 [J].水资源保护, 2010,(3):41-44.
[3] 中国科学院南京地理与湖泊研究所.太湖梅梁湾2007年蓝藻水华形成及取水口污水团成因分析与应急措施建议 [J]. 湖泊科学, 2007,19(4):357-358.
[4] 宋立荣,孔繁翔.蓝藻水华形成过程及其环境特征研究 [M]. 北京:科学出版社, 2011.
[5] 马荣华.湖泊水环境遥感 [M]. 北京:科学出版社, 2010.
[6] Granskog M A, Macdonald R W, Mundy C, et al. Distribution,characteristics and potential impacts of chromophoric dissolved organic matter (CDOM) in Hudson Strait and Hudson Bay,Canada [J]. Continental Shelf Research, 2007,27(15):2032-2050.
[7] Kutser T, Pierson D C, Kallio K Y, et al. Mapping lake CDOM by satellite remote sensing [J]. Remote Sensing of Environment,2005,94(4):535-540.
[8] 尚丽霞,柯 凡,李文朝,等.高密度蓝藻厌氧分解过程与污染物释放实验研究 [J]. 湖泊科学, 2013,25(1):47-54.
[9] 冯 胜,刘 义,余广彬.微生物作用下的微囊藻降解试验研究[J]. 现代农业科技, 2009(1):253-255.
[10] Cleveland J S, Weidemann A D. Quantifying Absorption by Aquatic Particles: A Multiply Scattering Correction for Glass-Fiber Filters [R]. DTIC Document, 1993.
[11] Tassan S, Ferrari G M. An alternative approach to absorption measurements of aquatic particles retained on filters [J].Limnology and Oceanography, 1995,40(8):1358-1368.
[12] Bricaud A, Morel A, Prieur L. Absorption by dissolved organic matter of the sea (yellow substance) in the UV and visible domains [J]. Limnol. Oceanogr, 1981,26(1):43-53.
[13] 张 红,黄家柱,李云梅,等.滇池水体光学物质的吸收特性研究[J]. 环境科学, 2011,32(2):452-463.
[14] Le C, Li Y, Zha Y, et al. Specific absorption coefficient and the phytoplankton package effect in Lake Taihu, China [J].Hydrobiologia, 2009,619(1):27-37.
[15] Bricaud A, Babin M, Morel A, et al. Variability in the chlorophyll-specific absorption coefficients of natural phytoplankton: Analysis and parameterization [J]. Journal of geophysical Research, 1995,100(C7):13313-13321,332.
[16] 孙小静,秦伯强,朱广伟.蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放 [J]. 中国环境科学, 2007,27(3):341-345.
[17] 乐成峰,李云梅,查 勇,等.太湖梅梁湾水体组分吸收特性季节差异分析 [J]. 环境科学, 2008,29(9):2448-2455.
[18] 刘明亮.太湖有色可溶性有机物吸收特性研究 [D]. 南京:南京农业大学, 2009.
[19] Zhang Y, Qin B, Ma R, et al. Chromophoric dissolved organic matter absorption characteristics with relation to fluorescence in typical macrophyte, algae lake zones of Lake Taihu]. [J]. Huan jing ke xue= Huanjing kexue/[bian ji, Zhongguo ke xue yuan huan jing ke xue wei yuan hui" Huan jing ke xue" bian ji wei yuan hui.], 2005,26(2):142.
[20] Stedmon C A, Markager S, Kaas H. Optical properties and signatures of chromophoric dissolved organic matter (CDOM) in Danish coastal waters [J]. Estuarine, Coastal and Shelf Science,2000,51(2):267-278.
[21] Del Castillo C E, Coble P G. Seasonal variability of the colored dissolved organic matter during the 1994–95NE and SW monsoons in the Arabian Sea [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2000,47(7):1563-1579.
[22] Babin M, Stramski D, Ferrari G M, et al. Variations in the light absorption coefficients of phytoplankton, nonalgal particles, and dissolved organic matter in coastal waters around Europe [J].Journal of Geophysical Research, 2003,108(C7):3211.
[23] Reche I, Pace M L, Cole J J. Interactions of photobleaching and inorganic nutrients in determining bacterial growth on colored dissolved organic carbon [J]. Microbial Ecology, 1998,36(3/4):270-280.
[24] Zhang Y, van Dijk M A, Liu M, et al. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes: field and experimental evidence [J]. Water Research, 2009,43(18):4685-4697.
[25] 朱建华,李铜基.黄东海海区浮游植物色素吸收系数与叶绿素 a浓度关系研究 [J]. 海洋技术, 2004,23(4):117-122.
[26] 丘仲锋,席红艳,何宜军,等.东海赤潮高发区半分析算法色素浓度反演 [J]. 环境科学, 2006,27(8):1516-1521.
[27] 段洪涛,马荣华,孔维娟,等.太湖沿岸水体CDOM吸收光谱特性[J]. 湖泊科学, 2009,21(2):242-247.
[28] Carder K L, Steward R G, Harvey G R, et al. Marine humic and fulvic acids: Their effects on remote sensing of ocean chlorophyll.[J]. Limnology and Oceanography, 1989,34(1):68-81.
[29] 张运林,吴生才,秦伯强,等.太湖梅梁湾有色可溶性有机物对光的吸收 [J]. 中国环境科学, 2004,24(4):405-409.
致谢:本实验的部分数据由中国科学院南京地理与湖泊研究所湖泊—流域数据集成与模拟中心提供.
Variability of absorption of inherent optical properties (IOPs) in the presence of phytoplankton degradation.
YI Mei-sen1,2, DUAN Hong-tao1*, ZHANG Yu-chao1, MA Rong-hua1
(1.State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China;2.College of Urban and Environmental Science, Northwest University, Xi’an 710127, China). China Environmental Science, 2014,34(5):1258~1267
We examine the long term (37days) changes in the optical dynamics of phytoplankton concentrations during senescence and degradation. The results show that: 1) The degradation rate is fastest in the first three days and optical properties reach a steady state after 25days; 2) A significant production of inorganic particulates are formed during the degradation process at higher concentrations of algal biomass; 3) The temporal dynamics between optical properties of phytoplankton (aph(440)、aph(624)、aph(675)) and chlorophyll concentrations (Cchl) were significantly correlated(R2>0.5984,P<0.05) while those of particulates (ap(440)、ap(675)) and total suspended particles concentrations were only weakly correlated(R2<0.4613); The structure of CDOM is complex and relatively unstable while ad(440) and Sdchanged not regularly with time. The optical properties of the particulate fraction and phytoplankton measured in the degradation experiment was more similar than those measured in black water masses in Taihu Lake. Optical properties of dissolved components (Sdand Sg) were greater. These optical properties of the particulate and dissolved fractions provide needed information for algorithm development for remote sensing monitoring and modeling of these important phenomena.
phytoplankton;black water masses;degradation;absorption characteristics
X524
A
1000-6923(2014)05-1258-10
2013-08-12
国家自然科学基金项目(41171271,41171273,41101316);国家污染控制与管理重大专项(2012ZX07103-005)
∗ 责任作者, 副研究员, htduan@niglas.ac.cn
易梅森(1985-),男,湖北黄冈人,西北大学硕士研究生,研究方向为水体光学特性研究.

