络合-氧化-还原耦合方法脱除烟气中NOx的研究
黎宝林 ,李明玉 *,刘海豪 ,曹 刚 ,任 刚 ,宋 琳 ,叶向东 (.暨南大学环境工程系,广东 广州50630;.广东省环境科学研究院,广东 广州 50045)
络合-氧化-还原耦合方法脱除烟气中NOx的研究
黎宝林1,李明玉1*,刘海豪1,曹 刚1,任 刚1,宋 琳1,叶向东2(1.暨南大学环境工程系,广东 广州510630;2.广东省环境科学研究院,广东 广州 510045)
NO与Fe2+反应生成络合物[Fe(NO)]2+易被O2氧化解络形成NO和NO离子,进而被尿素溶液还原生成N2.基于上述反应原理,本文提出脱除烟气中NOx的新方法,即以FeSO4为吸收液、O2为氧化剂、尿素为还原剂的络合-氧化-还原耦合法.考察了尿素初始浓度、吸收液pH值、NOx初始浓度、烟气流量等因素对NOx脱除率的影响.结果表明,尿素初始浓度越高、吸收液pH值越低、NOx初始浓度越大、烟气流量越小时,NOx脱除率越高;当尿素初始浓度为1.19mol/L,吸收液pH值为3.2,NOx初始浓度为1493mg/m3以及烟气流量为800mL/min时,反应初期(0~6min)NOx脱除率可达92%以上,且反应1h后脱除率仍可保持在69%左右.
氮氧化物;硫酸亚铁;尿素;络合吸收;烟气
目前烟气脱硝是治理 NOx污染最重要的手段,主要分为干法与湿法 2大类[1-3].干法中选择性催化还原法(SCR)和选择性非催化还原法(SNCR)使用最广泛[4-6].国内外对 SCR的反应机理、反应动力学和催化剂的选取等方面进行了大量的研究,NOx的脱除率能达90%以上,但缺点是投资运行费用较高、催化剂易中毒、氨易泄漏等[7-9].SNCR 不需要催化剂,运行成本低,但其缺点是反应需高温进行、能耗大、NOx脱除率低等[10-12].湿法脱硝中亚铁络合吸收法一直是研究的热点[13-15],其采用亚铁溶液对 NO进行络合吸收:Fe2++NO[Fe(NO)]2+.该络合吸收反应具有反应速度快的特点,但该反应属可逆反应,络合平衡常数小,Keq=(0.470±0.20)m3/mol[16],反应很快达到平衡,所形成的络合物[Fe(NO)]2+稳定性差.这使得Fe2+络合吸收法对NO吸收容量小、脱硝效率低.为此文献[17]采用“Fe2+络合- O2氧化”二段循环法脱除烟气中 NOx,通过用 O2对[Fe(NO)]2+进行氧化,促使络合反应不断向右进行,保持体系对NO持续吸收,使体系的脱硝效果大大提升.但是反应过程中不断积累的 HNO2和HNO3等氧化性物质,能加快Fe2+离子氧化成Fe3+离子,Fe3+离子对 NO没有络合吸收能力,导致体系难以保持长久稳定的NOx脱除率.
本文提出采用络合-氧化-还原耦合技术脱除烟气中 NOx的新方法,通过亚铁络合 NO、氧气氧化解络[Fe(NO)]2+以及尿素还原 HNO2和HNO3,实现对烟气中 NOx进行吸收和脱除.在探讨络合-氧化-还原耦合方法脱除 NOx机理的基础上,重点考察了添加尿素、尿素初始浓度、吸收液pH值、NOx初始浓度和烟气流量等因素对NOx脱除率的影响.
1 实验部分
1.1 实验装置与仪器
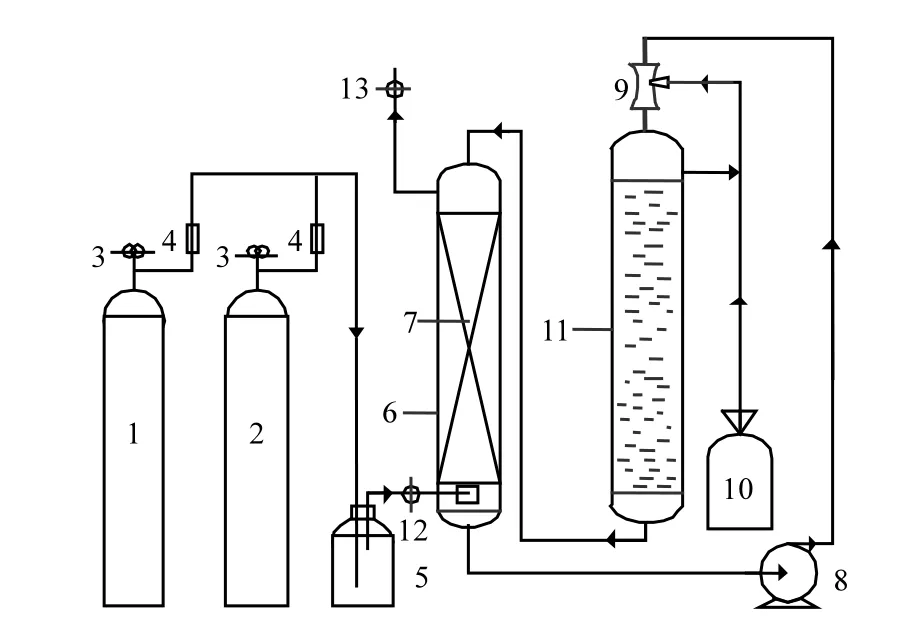
图1 实验流程示意Fig.1 Schematic diagram of the experimental set-up
图 1为脱除烟气中 NOx的实验装置(自制),其中吸收反应塔是内径40mm、高1.2m的有机玻璃柱,内装填料(塑料鲍尔环,直径=15mm);氧化反应塔是内径60mm、高1.5m的有机玻璃柱;烟气测定仪器为KM手持烟气分析仪(英国Kane国际有限公司);LZ-2气体流量计(余姚市伟创流量仪表有限公司);LZB-3气体流量计(余姚市银环流量仪表有限公司);酸度计(上海精密科学仪器有限公司);磁力驱动循环泵(上海磁力泵业制造有限公司).
1.2 实验试剂
FeSO4·7H2O(工业级);尿素(工业级);N2(纯度99%,广州市标气贸易有限公司);O2(纯度 99%,广州市标气贸易有限公司);NO(体积分数 2%,其余为高纯 N2,广州市标气贸易有限公司);其他试剂均为分析纯.
1.3 实验方法
络合-氧化-还原耦合方法脱除烟气中 NOx实验装置及流程如图1所示,N2和NO两种气体分别按一定比例通过减压阀3和流量计4,进入缓冲瓶5,通过微孔布气器进入络合吸收塔6,与硫酸亚铁溶液逆向接触,完成络合吸收反应,生成[Fe(NO)]2+络合物,脱硝后的气体从吸收塔顶经排气管排出.含有[Fe(NO)]2+的络合吸收液通过磁力循环泵 8,经文丘里喷射器9与 O2接触,进入氧化塔11中;在氧化塔中,吸收液与氧气进一步接触氧化,吸收液中的[Fe(NO)]2+被氧化解络.尿素对吸收液中形成的HNO2和HNO3进行还原,生成 N2、CO2和 H2O,从而使 NOx被脱除.接着该吸收液在重力的作用下,自流回吸收塔6,循环使用.
1.4 分析与检测
用KM手持烟气分析仪,对烟气中NOx浓度进行在线连续检测,分别检测吸收塔进气取样口12和出气取样口13的NOx浓度,然后根据公式(1),计算烟气中NOx的脱除率.
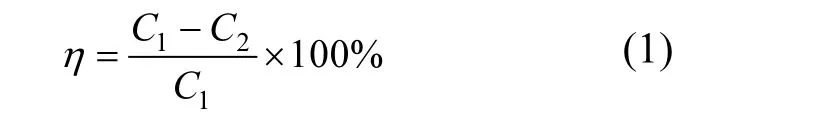
式中,η为 NOx脱除率,C1为吸收塔进气取样口NOx浓度,C2为吸收塔出气取样口 NOx浓度.采用化学分析方法对吸收液的亚铁离子浓度进行分析[18-19].
2 结果与分析
2.1 添加尿素对脱硝效果的影响
在烟气流量为 1440mL/min、NO浓度为1617mg/m3、NO2浓度为 86mg/m3、吸收液体积为 7000mL、吸收液 pH值为 2.9、Fe2+离子浓度为0.17mol/L、尿素浓度为1.19mol/L、体系温度为(23±2)℃以及循环流量为2.5L/min的实验条件下,研究了添加尿素对吸收液脱硝效果的影响.
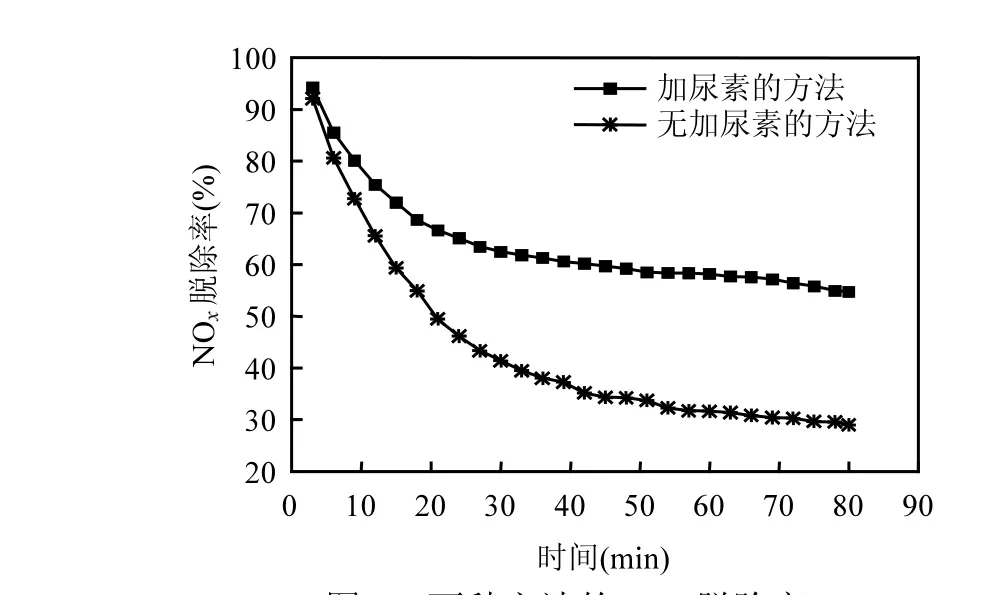
图2 两种方法的NOx脱除率Fig.2 Removal efficiency of NOx in absorbing solutionith or without n with or without urea
由图2可知,在脱硝反应前5min,两者对NOx的脱除效果差别不大,脱除率都能达到80%以上.随着反应的进行,无加尿素的方法对NOx脱除率下降较快,到80min已降到30%;而加尿素的方法下降缓慢并趋于平稳,到80min时仍可保持54%的脱除率.可见,添加尿素方法络合-氧化-还原的脱硝效果,明显优于无添加尿素方法 Fe2+络合-氧气氧化.
模拟烟气经过 FeSO4吸收液时,溶液中 Fe2+离子与烟气中NO发生络合反应:
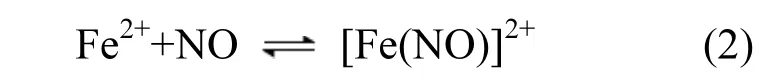
吸收液经循环泵到氧化塔,在氧化塔中吸收液能与氧气发生一系列的反应:
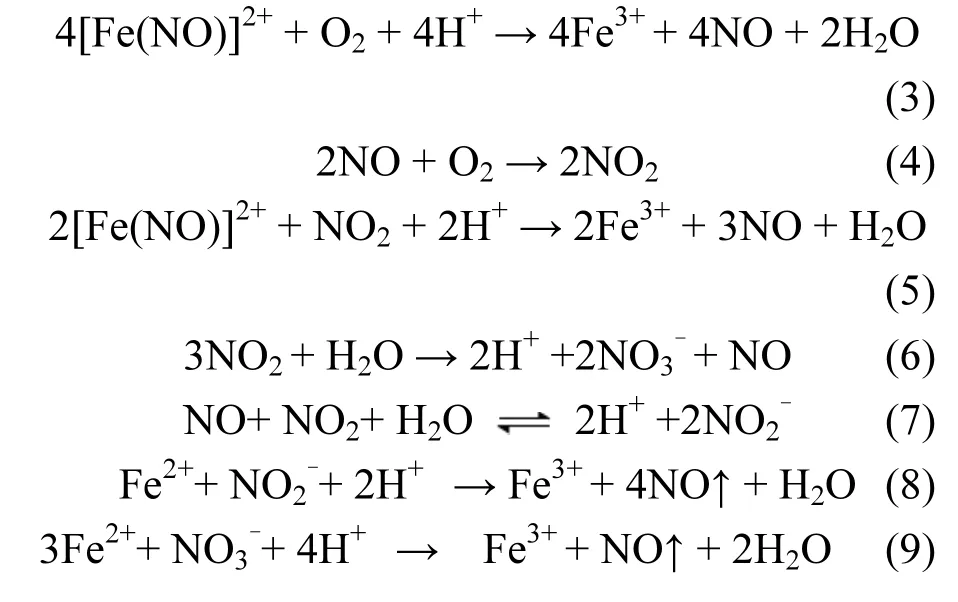
在无加尿素的情况下,反应式(6)和(7)所生成的HNO2和HNO3等氧化性物质在吸收液中不断积累,这些氧化性物质能加快吸收液中 Fe2+离子生成 Fe3+离子,从而减弱了吸收液对 NO的络合吸收效果;另一方面,由于HNO2不稳定,易分解成NO和NO2返回到气相中,导致NOX脱除率下降快.
而在添加尿素的情况下,反应式(6)和(7)所生成的HNO2和HNO3等氧化性物质被尿素还原,生成N2、CO2和H2O,反应式如下:
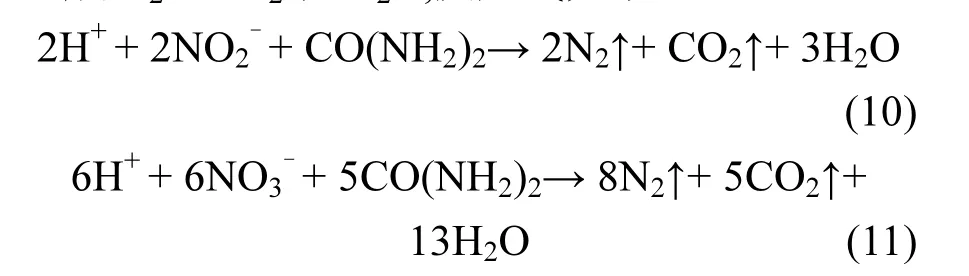
其中尿素的作用:一方面是促使反应体系中式(10)和(11)的进行,减少了吸收液中 HNO2和HNO3等氧化性物质,从而抑制了式(8)和(9)的进行,使Fe2+离子的消耗速率降低,如表1所示.
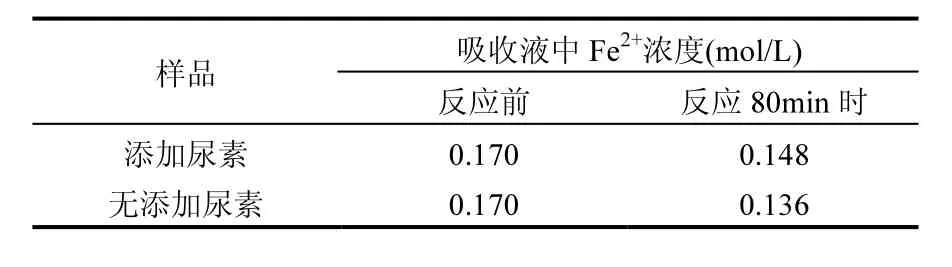
表1 两种方法反应前后吸收液中的Fe2+浓度Table 1 Concentration of ferrous ions in absorbing solution with or without urea
Fe2+离子的消耗速率降低,使吸收液中有更多的Fe2+离子对NO进行络合吸收,即促进式(2)的进行,更利于NOx的脱除.
另一方面,式(10)和(11)的进行,减少了吸收液中的 HNO2和 HNO3,促进了式(6)和(7)向右反应进行,且抑制了HNO2分解成NO和NO2返回到气相中,加快了吸收液对NOx的吸收.最终使添加尿素方法“络合-氧化-还原”能更长时间保持较好稳定的NOx脱除率.
2.2 尿素初始浓度对NOx脱除效果的影响
在烟气流量为 1420mL/min、NO浓度为1407mg/m3、NO2浓度为86mg/m3、吸收液体积为7000mL、吸收液pH值为2.9、Fe2+离子浓度为 0.17mol/L、体系温度为(23±2)℃以及循环流量为2.5L/min的实验条件下,研究了不同尿素初始浓度对耦合法脱硝效率的影响.
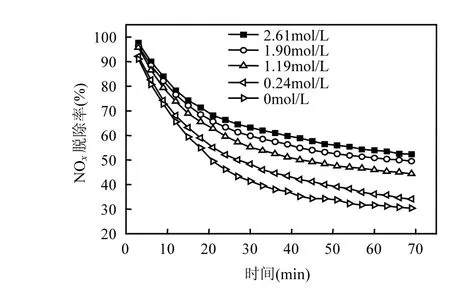
图3 尿素初始浓度对NOx脱除率的影响Fig.3 The effect of urea initial concentration on removal efficiency of NOx
由图3可知,随着尿素初始浓度由0mol/L至2.61mol/L, NOx脱除率不断提高.当脱硝反应进行到 70min时,随着 5种不同尿素浓度的增加,NOx脱除率分别提升5%~10%.
尿素初始浓度越大,越利于吸收液中 HNO2和HNO3还原为N2;同时有效抑制HNO2和HNO3对Fe2+离子的氧化,降低Fe2+离子的消耗速率.而且,尿素初始浓度越大,HNO2被还原的越多,自身分解的越少,从而提高NO和NO2的脱除效果.因此,适当提高吸收液中尿素的初始浓度可增强NOx的脱除率.
2.3 吸收液pH值对NOx脱除效果的影响
图4是在烟气流量为1420mL/min、NO浓度为 1407mg/m3、NO2浓度为 86mg/m3、吸收液体积为7000mL、Fe2+离子浓度为0.17mol/L、尿素浓度为1.19mol/L、体系温度为(23±2)℃以及循环流量为 2.5L/min的实验条件下,改变吸收液的pH值时,脱硝效率与处理时间之间的关系曲线.
由图4可见,随着吸收液的pH值降低,体系对NOx的脱除效果越好.吸收液的pH值越低,H+离子含量就越多,促进了尿素与 HNO2和 HNO3等氧化性物质的反应,抑制了Fe2+离子被氧化,使Fe2+离子的消耗速率降低,如表2所示.
Fe2+离子的消耗速率降低,使体系中有更多的 Fe2+离子与NO发生络合反应,进而提高体系对 NOx的脱除效果.因此,若要提高体系对 NOx的脱除率,可适当降低吸收液的pH值.

图4 吸收液pH值对NOx脱除率的影响Fig.4 The effect of pH value of absorbing solution on removal efficiency of NOx

表2 吸收液不同pH值条件下的Fe2+浓度Table 2 Concentrations of ferrous ions in various pH values of absorbing solution
2.4 NOx初始浓度对NOx脱除效果的影响
在烟气流量为1420mL/min、吸收液体积为7000mL、Fe2+离子浓度为0.17mol/L、尿素浓度为 1.19mol/L、吸收液 pH值为 2.9、体系温度为(23±2)℃以及循环流量为2.5L/min的实验条件下,考查不同 NOx初始浓度对体系脱硝效果的影响.
由图5可知,随着烟气中NOx初始浓度的增加,耦合体系对 NOx的脱除率也增大,且三者NOx的脱除率都在50%以上.这是因为气相主体中 NOx初始浓度的增加,NOx分压增大,增强了传质推动力,一方面使NO更容易与溶液中Fe2+离子与发生络合反应,使吸收液络合更多的NO.另一方面,也更有利于 NO和 NO2与水的反应,即促进反应(6)和(7)向右进行,从而提高了 NOx的脱除率.

图5 NOx初始浓度对NOx脱除率的影响Fig.5 The effect of NOx initial concentration on removal efficiency of NOx
不过,从NOx剩余浓度的角度考虑,由于烟气中NOx初始浓度的增大,排出气体中NOx剩余浓度随之升高,如图6所示.
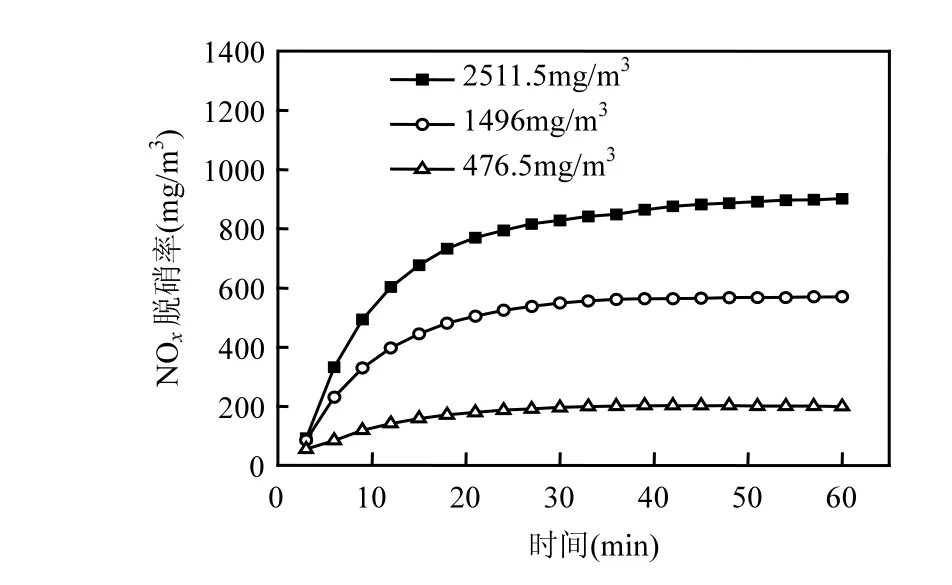
图6 NOx初始浓度对NOx剩余浓度的影响Fig.6 The effect of NOx initial concentration on NOx residual concentration
增大烟气中NOx的初始浓度,单位时间内与吸收液反应的NOx量就越多,使得吸收液中可用于吸收 NO 的 Fe2+浓度下降较快,同时能还原HNO2和HNO3的尿素浓度也降低较快,从而影响对NOx的脱除,最终导致排出气体中NOx剩余浓度增加,体系的脱硝效果下降.
NOx初始浓度由 476.5mol/L 增加到2511mol/L,脱硝率的增长相对量为 10.12%,但NOx剩余浓度的增长相对量为 353.76%.剩余浓度的增长相对量远远大于脱硝率的增长相对量,其中剩余浓度增长相对量越大,体系的脱硝效果越差.综合NOx的脱除率和剩余浓度两方面来看,NOx初始浓度越低,体系对NOx的脱除效果越好.根据大气污染物综合排放标准(GB16297-1996)[20]中新建污染源NOx最高允许排放浓度为240mg/m3,在该实验条件下,体系所适用最佳的NOx初始浓度范围为0~800mg/m3.
2.5 烟气流量对NOx脱除效果的影响
图7是在NO浓度为1407mg/m3、NO2浓度为 86mg/m3、吸收液体积为 7000mL、Fe2+离子浓度为0.17mol/L、尿素浓度为1.19mol/L、吸收液 pH值为 3.2、体系温度为(23±2)℃以及循环流量为2.5L/min的实验条件下,不同烟气流量时脱硝效率与处理时间之间的关系曲线.
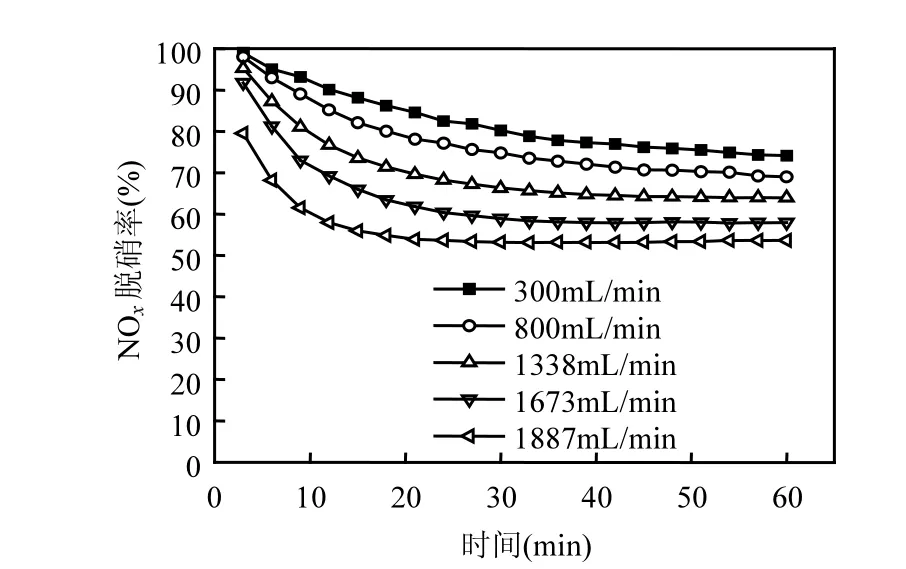
图7 烟气流量对NOx脱除率的影响Fig.7 The effect of flue gas flow on NOx removal efficiency
由图 7可知,随着烟气流量的减少,体系对NOx的脱除率升高;这是因为烟气流量越大,使NOx在吸收液中的停留时间就越短,气液的接触时间减少,不利于FeSO4对NO的络合吸收,导致体系对 NOx脱除率的下降.因此,为得到更高的NOx脱除率,应适当控制烟气的流量.
3 结论
3.1 络合-氧化-还原耦合方法对烟气中NOx脱除效果随吸收液中尿素初始浓度和烟气中 NOx浓度的增加,以及随吸收液中 pH值和烟气流量的降低而提高.
3.2 该方法对 NOx的脱除率较高,反应初期可达92%以上, 1h后脱除率仍可保持在69%左右.
[1] Long X L, Xin Z L, Chen M B, et al. Nitric oxide absorption into cobalt ethylenediamine solution [J]. Separation and Purification Technology, 2007,55:226-231.
[2] Liu Y X, Pan J F, Tang A K, et al. A study on mass transfer–reaction kinetics of NO absorption by using UV/H2O2/NaOH process [J]. Fuel, 2013,108:254-260.
[3] Long X L, Xin Z L, Chen M B, et al. Kinetics for the simultaneous removal of NO and SO2with cobalt ethylenediamine solution [J]. Separation and Purification Technology,2008,58:328–334.
[4] 唐晓龙,郝吉明,易红宏,等.活性炭改性整体催化剂上低温选择性还原NOx[J]. 中国环境科学, 2007,27(6):845-850.
[5] Ayoub M, Irfan M F, Yoo K S. Surfactants as additives for NOxreduction during SNCR process with urea solution as reducing agent [J]. Energy Conversion and Management, 2011,52:3083–3088.
[6] Qi G S, Yang R T. Performance and kinetics study for low-temperature SCR of NO with NH3over MnOx-CeO2catalyst[J]. Journal of Catalysis, 2003,217:434–441.
[7] 刘 炜,童志权,罗 婕.Ce-Mn/TiO_2催化剂选择性催化还原NO的低温活性及抗毒化性能 [J]. 环境科学学报, 2006,27(8):1240-1245.
[8] Ettireddy P R, Ettireddy N, Mamedov S, et al. Surface characterization studies of TiO2supported manganese oxide catalysts for low temperature SCR of NO with NH3[J]. Applied Catalysis B: Environmental, 2007,76:123-134.
[9] Brack W, Heine B, Birkhold F, et al. Kinetic modeling of urea decomposition based on systematic thermogravimetric analyses of urea and its most important by-products [J]. Chemical Engineering Science, 2014,106:1-8.
[10] Nguyen T D B, Kang T H, Lim Y I, et al. Application of urea-based SNCR to a municipal incinerator: On-site test and CFD simulation [J]. Chemical Engineering Journal, 2009,152:36-43.
[11] Javed M T, Irfan N, Gibbs B M. Control of combustiongenerated nitrogen oxides by selective non-catalytic reduction [J].Journal of Environmental Management, 2007,83:251-289.
[12] Bae S W, Roh S A, Kim S D. NO removal by reducing agents and additives in the selective non-catalytic reduction (SNCR) process[J]. Chemosphere, 2006,65:170-175.
[13] 荆国华,李 伟,施 耀,等.Fe3+(EDTA)还原菌的分离及其性能[J]. 中国环境科学, 2004,24(4):447-451.
[14] 李 伟,吴成志,马碧瑶,等.半胱氨酸亚铁溶液吸收一氧化氮的研究 [J]. 中国环境科学, 2005,25(3):306-309.
[15] Wang L, Zhao W R, Wu Z B. Simultaneous absorption of NO and SO2by FeIIEDTA combined with Na2SO3solution [J]. Chemical Engineering Journal, 2007,132:227-232.
[16] 王 莉,赵伟荣,吴忠标.金属络合吸收剂在湿法脱硝中的应用[J]. 环境工程学报, 2007,1(2):88-93.
[17] 李明玉,唐启红,陆哲维,等.一种含氮氧化物废气的处理方法及装置:中国, 200910041869.X [P]. 2010-02-03.
[18] 国家环境保护总局.水和废水监测分析方法 [M]. 4版. 北京:中国环境科学出版社, 2002:365-370.
[19] 谷春秀.化学分析与仪器分析实验 [M]. 北京:化学工业出版社,2012:65-67.
[20] GB16297-1996 大气污染物综合排放标准 [S].
Removal of NOxin flue gas by complexation-oxidation-reduction coupling method.
LI Bao-lin1, LI Ming-yu1*, LIU Hai-hao1, CAO Gang1, REN Gang1, SONG Lin1, YE Xiang-dong2(1.Department of Environmental Engineering, Jinan University, Guangzhou 510630, China;2.Guangdong Provincial Academy of Environmental Science, Guangzhou 510045,China). China Environmental Science, 2014,34(5):1125~1130
[Fe(NO)]2+formed by the complexation between NO and Fe2+was easily oxidized by O2to NOand NO.Furthermore, NOand NOwere reduced to N2by urea in solution. Based on these reactions, we developed a new method for removing NOxin flue gas, i.e., complexation-oxidation-reduction method in which ferrous sulfate solution,oxygen and urea were selected as complex agent, oxidant and reductant respectively. Effects of some factors including initial concentration of urea, pH value of absorbing solution, initial concentration of NOxand flow rate of flue gas on removal rate of NOxin flue gas were investigated. Results showed that the removal rate of NOxwas positive correlation with the initial concentration of urea and the initial concentration of NOx, but negative correlation with the pH value of absorbing solution and the flow rate of flue gas. When initial concentration of urea, pH value of absorbing solution, initial concentration of NOxand flow rate of flue gas were 1.19mol/L, 3.2, 1493mg/m3and 800mL/min respectively, the removal rate of NOxwas more than 92% in the initial stage (0~6min) and this removal rate still maintained about 69% after treatment of NOxfor an hour.
nitrogen oxides;ferrous sulfate;urea;complex absorption;flue gas
X701
A
1000-6923(2014)05-1125-06
2013-09-04
广东省科技计划项目(2011A030600010)
* 责任作者, 教授, limingyu2000@163.com
黎宝林(1989-),男,广东江门人,暨南大学环境工程系硕士研究生,主要研究方向为污染控制理论与技术.

