2种方法从大鼠晶状体中提取总RNA及评测
徐洪卫,张晨光,金 磊
(1.徐州医学院临床学院,江苏徐州221004;2.徐州医学院医学生物化学与分子生物学教学实验中心,江苏徐州221004)
分子生物学技术已经渗透到医学科研的各个领域,在分子生物学技术中,总RNA的提取是一项基础性工作,能否获得高质量的RNA,是决定后续试验成败的关键因素之一[1-2]。TrizoI法提取总RNA是一种传统经典的方法,目前广泛运用于分子生物学试验,其原理是TrizoI中的异硫氰酸胍可使核蛋白体裂解,使RNA与蛋白质分离,释放入液相,而氯仿可提取TrizoI中苯酚,从而使苯酚中总RNA进入水相,经离心、纯化得到总RNA[3],而UNIQ-10柱式总RNA抽提法(以下简称柱式法)主要利用碱基配对原理,采用寡聚T结构作为亲和柱材料,当总RNA流经寡聚T柱时,RNA即被特异结合到柱子上,从而达到分离提取的目的[4]。笔者采用柱式法与Trizol法分别从大鼠晶状体中提取总RNA,使用NanaDrop2000测定其浓度及A260/A280、A260/A230,琼脂糖凝胶电泳技术分析提纯样品,反转录聚合酶链反应(RT-PCR,以下简称RT-PCR)检测是否可用于下游试验[5-6],客观评述此2种方法优缺点,为科研及教学提供合适的总RNA抽提方法。
1 材料与方法
1.1 试验动物 Sprague-Dawley(SD)大鼠,清洁级,由徐州医学院实验动物中心提供。将大鼠断头处死,取出晶状体置于无菌、无核酶1.5 ml离心管中,于-80℃冻存。
1.2 主要仪器 小型高速离心机、电子天平、高压灭菌锅、电子天平、电泳槽、超净工作台、NanaDrop2000、电泳仪、凝胶成像系统、PCR仪等。
1.3 试剂及配制 ①1 kb DNA ladder购买于NEB公司,RT-PCR System、agarose购买于promega公司,UNIQ-10柱式总RNA抽提试剂盒、Trizol总RNA抽提试剂盒、特异性引物购买于生工(上海)生物工程有限公司,无水乙醇、氯仿、异丙醇均为国产试剂。②1%DEPC:DEPC 1 ml,加入1 L灭菌蒸馏水中,剧烈振荡后室温静置数小时。③TBE缓冲液:称取Tris12.1 g,硼酸5.3 g,DETA 0.74 g,溶于蒸馏水中,再定溶至1 000 ml。④试剂分装:无水乙醇、氯仿、异丙醇按照2 ml分装至无菌、无核酶EP管中。
1.4 试验方法
1.4.1 柱式法抽提总RNA。将冻存于-80℃的大鼠晶状体取出(约50 mg),转移至无菌匀浆器中,立即加入450 μl RLT Solution,手动匀浆处理,匀浆时间不超过1 min。其余标准操作步骤参见操作手册。
1.4.2 Trizol法抽提总RNA。将冻存于-80℃的大鼠晶状体取出(约50 mg),转移至无菌匀浆器中,立即加入1 ml TotalRNAExtractor,手动匀浆处理,匀浆时间不超过1 min。其余标准操作步骤参见操作手册。
1.4.3 RNA的琼脂糖凝胶电泳。①电泳RNA所用器械:凝胶槽、梳子、电泳槽等经常规洗净后,用乙醇脱水,再浸泡于3%H2O2溶液中10 min,然后用0.1%DEPC处理水彻底冲洗,室温晾干备用。②1×TBE缓冲液、上样缓冲液用经DEPC处理过的灭菌蒸馏水配制,然后用0.22 μm滤器过滤除菌。③用1×TBE缓冲液配制1%琼脂糖凝胶,GelRed(10000×)加入凝胶中混匀再倒胶至凝胶槽中制胶。④制备好的琼脂糖凝胶板放入电泳槽后再加入1×TBE,液面淹没过胶1~2 mm。⑤电泳电压2.5 V/cm,时间30 min,紫外灯下观察结果并进行拍照。
1.4.4 一步法RT-PCR。反应体系:用50 μl RT-PCR体系,RNA 模版加入 3 μl,特异性引物浓度 1 μmol/L,dATP、dTTP、dGTP、dCTP浓度各为2 μmol/L,反转录酶与DNA聚合酶均为2.5 U。反应条件:反转录48℃ 45 min,预变性94℃ 2 min;变性94℃ 1 min、退火58℃ 1 min、延伸72℃ 1 min,25个循环;最后延伸为72℃ 5 min。
2 结果与分析
2.1 柱式法及Trizol法抽提总RNA结果 使用柱式法及Trizol法提取总RNA结果见图1。由图1可知,28S和18S亚基清晰可见,RNA降解较少,用NanaDrop2000测定RNA浓度,A260/A280、A260/A230结果见表1。由表1可知,柱式法A260/A280、A260/A230均在1.8 ~2.0,说明蛋白质及碳水化合物的污染较少。而使用Trizol法提取总RNA降解较多,其中28S亚基检测不到,A260/A230很低说明在提取过程中受到了污染或者是苯酚及乙醇残留。电泳最前端可见较多降解条带。
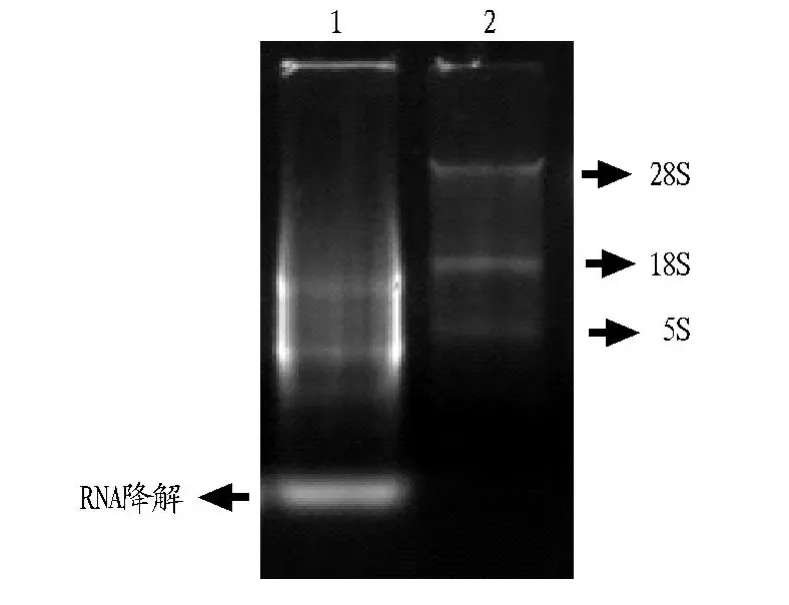
图1 总RNA抽提结果

表1 2种方法提纯RNA结果
2.2 RT-PCR 分别使用柱式法及Trizol法抽提的总RNA为模板,RT-PCR方法构建大鼠晶状体蛋白βB2,RT-PCR系统中除模板不同,其余成分完全一致,琼脂糖凝胶电泳检测结果见图2。由图2可知,使用柱式法抽提的总RNA为模板进行的RT-PCR反应有一清晰可见的亮带,其大小与目的基因大小(711 bp)吻合,证明是目的基因。而使用Trizol抽提的总RNA为模板进行的RT-PCR反应无结果,说明此模板不能进行RTPCR试验。这与之前分析的总RNA质量相吻合。
3 讨论
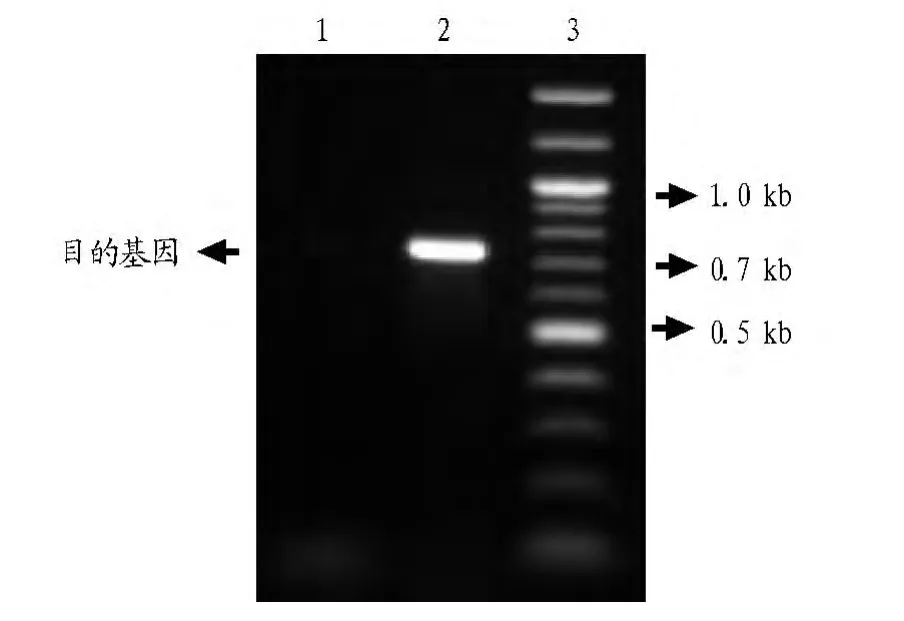
图2 RT-PCR结果
Trizol法提取总RNA耗时稍长,约70 min,需要冷冻离心机,部分操作过程需要在冰浴中切,容易受到苯酚污染及乙醇残留,因此对操作要求较高,但Trizol法提取大量样本时较为方便,适合大量样本的总RNA提取,且可以将总RNA保存在纯化的中间步骤乙醇中,待试验需要时再进一步纯化,对于样品的存储较为有利,存储时间更长。柱式法提取总RNA对于试验条件的要求相对较低,操作简便,耗时短,约40 min,全程可在常温下进行,不需要冷冻离心机,样品纯度较高,不易受到苯酚污染及乙醇残留,但如果需要提取大量样品,则需要使用多只纯化柱分别操作,给操作带来很大不便。
总RNA提取极易受到操作方法不当及外部环境的影响而发生降解[7-9],造成RNA降解的原因来自内因和外因2个方面。内因是细胞破碎瞬间内部RNA酶释放对RNA的降解作用。外因是生物体内和外部环境中存在大量RNA酶,且RNA酶不易失活,高温后仍能正确折叠恢复活性[10]。因此从样品的储存、RNA的提取以及RNA提取完成后的保存,都需要充分准备,防止RNA酶对RNA的降解。在具体试验过程中,需要注意两点,其一,抑制外源性RNA酶活性,在操作过程中创造一个无RNA酶的环境,对操作过程中所有试验材料进行彻底处理,灭活RNA酶。其二,抑制内源性RNA酶活性,使用RNA酶特异性抑制剂如巯基乙醇等,RNA酶抑制剂对其他核酸工具酶无影响,其中关键操作步骤在于匀浆是否快速、彻底。
[1]李杰之,常晓彤.从动物组织提取高纯度总RNA方法的改进及应用[J].生物技术通讯,2002,13(5):346 -348.
[2]邓莉,马春明,袁琼兰,等.用TRIzol试剂抽提新生鼠脑组织总 RNA[J].泸州医学院学报,2006,28(6):505 -506.
[3]邱方,陈子祥,杨清玉,等.不同方法提取血清总RNA的性能评价[J].国际检验医学杂志 ISTIC,2012,33(4):457 -458.
[4]崔山佳,罗明富,张金玲.家兔脂肪组织总RNA提取方法的比较[J].解剖科学进展,2010(1):48-50.
[5]陈星,潘迎捷,孙晓红,等.四种副溶血弧菌总 RNA提取方法的比较[J].基因组学与应用生物学,2009,28(6):1177 -1182.
[6]梁婧娴,陈志成,贺庆华,等.检测总 RNA质量的两种方法比较研究[J].西南民族大学学报:自然科学版,2012,38(1):69 -72.
[7]武荣,张俊涛,赵霞,等.Trizol与RNA Fast1000试剂盒提取外周抗凝血总 RNA 的方法比较[J].中国医疗前沿,2011,6(5):60 -61.
[8]付月君,张志云,柴宝峰,等.从棉铃虫体中提取总RNA的一种有效方法[J].生物技术通报,2004(5):40-42.
[9]李冬民,任吴超,王璇,等.利用TRIzol试剂和液氮提取大鼠胰腺高质量总 RNA[J].西安交通大学学报:医学版,2009,30(5):639 -642.
[10]任广睦,潘一民,刘季,等.死亡大鼠组织中总RNA提取的质量控制及方法评价[J].中国法医学杂志,2009,24(5):318 -320.

