Ki-67 在卵巢癌中的表达差异及卵巢癌高危因素的研究
尹龙燕,李莉平,杨 静,耿 宽,延 根
(1.广州医科大学附属广州市第一人民医院妇产科,广州 510180;2.汕头大学医学院第二附属医院影像科,广东 汕头 515041)
卵巢癌在女性生殖系统恶性肿瘤的中病死率一直居高不下。有研究[1-2]表明卵巢癌的5 年生存率约为45%,晚期患者的生存率仅为30%,这是因为卵巢癌的发病机制尚不明确,并且进展较为隐匿,部分患者确诊时已是处于晚期,并往往对化疗耐药。因此,更好地理解卵巢癌的生物机制和预后是必要的,有助于开发更有效的治疗方法。在这种背景下,应用核Ki-67 来反映细胞的增殖活性具有极高的价值[3-6]。有研究[4]表明,Ki-67 高表达与多数肿瘤的分化相应程度、是否浸润转移以及判断预后情况密切相关。失活的扩散标记PKi-67 可导致细胞死亡,特别是在增殖细胞中[4]。本研究探讨肿瘤分布及其危险因素、细胞增殖活性指标Ki-67 在不同病理类型卵巢癌中的病理意义、Ki-67 表达与卵巢癌侵润关系。
1 材料与方法
1.1 研究对象
2006—2012 年广州医科大学附属广州市第一人民医院诊断为卵巢癌(病程=5 年)的156 例患者,术前经超声、多普勒血流频谱检测、病理切片检查,符合WHO 关于卵巢癌的病理学诊断标准,均采取手术治疗,年龄为12~82 岁,平均(52.52±14.13)岁。按病理FIGO(2000 年)分期法分类:浆液性肿瘤(浆液性乳头状癌)81 例,黏液性肿瘤(黏液性乳头状癌)26 例,子宫内膜样癌16 例,透明细胞癌8 例,恶性畸胎瘤5 例,颗粒细胞瘤12 例,未分化癌3例,无性细胞瘤5 例。
1.2 主要试剂与仪器
Ki-67 抗体即用型,克隆号为K-2(北京中杉金桥生物技术有限公司)。DAB 显色试剂盒和Maxvision 即用型二抗(福州迈新生物技术开发有限公司)。Phy-3 型病理组织烘漂仪(常州钟伟电子仪器厂)。OlympusBX40 显微照相镜(日本Olympus 公司)。
1.3 Ki-67 的免疫组织化学检测
标本采用10%中性甲醛溶液固定,常规脱水、石蜡包埋以及切片。免疫组织化学染色首先经高温高压抗原修复,冷却至室温后,倒掉缓冲液,清水中冲洗2 次,每次5 min,再用PBS 冲洗2 次,每次5 min。将组织周围PBS 液擦拭干净,采用BSA 封闭液封闭,在37 ℃恒温箱中进行30 min 的血清封闭过程。一抗室温2 h,二抗室温20 min,而后加入A、B、C 试剂各1 滴,显微镜下控制反应时间及DAB 显色过程,经显色确认后苏木精轻度复染。脱水、透明、中性树脂封片,显微镜下观察。
1.4 评定标准
免疫组织化学阳性染色呈细胞核内棕黄色颗粒,根据染色程度和染色阳性细胞百分比来进行评分。Olympus 光学显微镜下观察,每份切片随机挑选5 个高倍视野(×400),按照如下判断标准:0 级(基本不着色),阳性细胞数约为0%~5%;Ⅰ级,阳性细胞数为6%~25%或胞浆或胞核内稀疏的棕色颗粒,就是棕褐色不明显;Ⅱ级,阳性细胞数为26%~50%,出现较多的棕黄色颗粒;Ⅲ级,阳性细胞数>50%,显示弥漫粗大的棕褐色颗粒。
1.5 随访
前5 年每3~6 个月进行随访1 次,之后每年1次。随访方式主要包括:电话询问、信访、门诊复查。主要进行妇科双合诊及超声检查,全血细胞计数和生化检查。如检查中CA125 水平升高伴超声检查中发现异常时做相应的临床处置。随访时间为3~60个月。
1.6 统计学方法
采用统计学软件SPSS17.0 进行数据分析。计量资料以表示,2 组间参数比较采用t 检验;率的比较用卡方检验、Fisher 精确检验;以是否发生转移或者局部浸润为因变量,以患者的一般情况和临床情况为应变量,使用Logistic 回归统计进行多因素分析;以患者出现转移、复发或者死亡作为结局事件,采用逐步回归法进行Cox 模型分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 肿瘤分布及危险因素分析
左侧肿瘤47 例 占30.1%,右侧肿瘤78 例占50.0%,双侧肿瘤31 例占19.9%;局部淋巴结转移84 例,占59.6%;多部位转移或者浸润多个器官36例,占25.5%;临近肠壁浸润42 例,占29.8%;大网膜浸润62 例,占44.0%;转移到肝脏、肺部或者远处淋巴结7 例,占5.0%。以患者出现转移、复发或者死亡作为结局事件,采用逐步回归法进行Cox 模型分析,发现化疗次数和孕次是保护因素,而局部淋巴结转移、远处转移和盆腔浸润是危险因素,见表1。

表1 卵巢癌Cox 模型筛选的危险因素及参数估计
2.2 有无浸润及不同病理组织分类中Ki-67 表达比较
156 例患者中85 例患者进行Ki-67 的免疫组织化学检测。Ki-67 表达呈阴性(0 级)18 例:上皮性肿瘤11 例,生殖性肿瘤7 例;未见远处组织或周边组织的浸润11 例,有浸润7 例。Ki-67 表达呈弱阳性(Ⅰ级)21 例:上皮性肿瘤20 例,生殖性肿瘤1例;未见远处组织或周边组织的浸润8 例,有浸润13 例。Ki-67 表达呈强阳性(Ⅱ级)20 例:上皮性肿瘤19 例,生殖性肿瘤1 例;未见远处组织或周边组织的浸润2 例,有浸润18 例。Ki-67 表达呈强阳性(Ⅲ级)26 例:上皮性肿瘤24 例,生殖性肿瘤2 例;未见远处组织或周边组织的浸润6 例,有浸润20例。有无浸润之间Ki-67 表达水平比较差异有统计意义(有浸润的肿瘤组织Ki67 阳性程度比较高,P<0.01);不同病理组织分类之间Ki-67 表达水平比较差异有统计意义(P<0.05)。见表2—4。

表2 156 例患者Ki-67 检测情况 %

表3 有无浸润患者Ki-67 等级 例
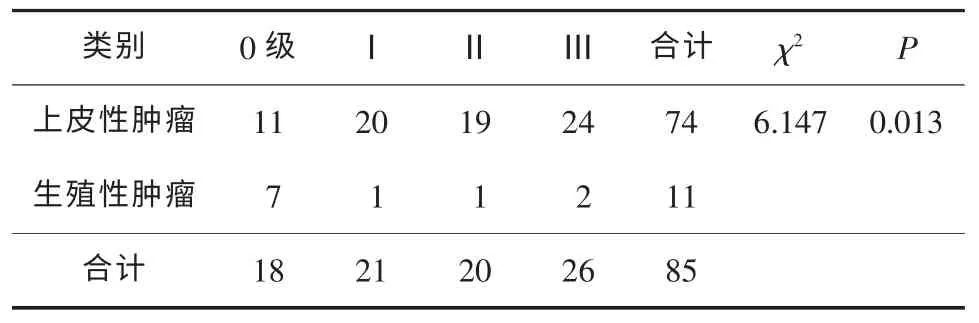
表4 不同病理组织类别Ki-67 等级 例
3 讨论
对卵巢癌患者全面确定病理组织类型及病理分期探查术是近年来提出的新手术观念,目的是对恶性卵巢癌准确分期,以指导治疗方案。NCCN 指南(2011 年版)[7]指出需要行手术治疗的患者,不管是根治性手术还是保守手术,都应该仔细、全面、认真地分期,这样可以更全面地评价肿瘤,从而有可能降低术后复发率。Ki-67 是细胞核内一种蛋白抗原,主要参与细胞分裂增殖相关过程,分子质量为345 ku和395 ku,其相关基因编码的位置处于第10 号染色体上[8]。Ki-67 出现于细胞有丝分裂期的G1 中期到晚期,随着有丝分裂的进行,再S 期和G2 期逐渐达到峰值,分裂结束后,将抗原决定簇迅速降解或丢失,在G0 期时则不表达,半衰期为l h 或更短。目前研究[4,9-11]已经表明,Ki-67与相关肿瘤的发生、转移、预后有着密切关系,近年来在临床或者肿瘤研究中得到广泛应用,被认为是反映细胞增殖活性的理想指标。Ki-67 的高表达被认为与多数肿瘤的相关分化程度、是否浸润转移及预后情况有关[4,12-13];Ki-67 在卵巢良性、交界性、恶性上皮性肿瘤中,其表达水平依次提高,尤其是恶性组的表达水平显著高于良性组及交界组[14-16]。本研究结果显示:有无侵润及不同病理组织分类中Ki-67 表达水平比较差异有统计学意义(P<0.05 或P<0.01)。Ki-67 作为一种判断细胞增殖状态的指标,对于判断卵巢癌发生、发展以及预后判断都是极有意义的,并可以间接指导治疗方案。
恶性肿瘤转移的途径与方式主要是血行转移和种植性转移。卵巢癌易发生种植播散,肿瘤多穿透盆腔形成腹膜种植,脱落的种植细胞可随腹水种植到膈下。淋巴转移主要累及髂内、外淋巴结,主动脉旁及主动脉前淋巴结。腹膜种植转移可分成两种:浸润性种植与非浸润性种植。其中浸润性种植较为典型,特点为上皮组织增生不规则,并浸润邻近或下方的正常组织。对于浸润性与非浸润性种植的诊断标准,目前尚有争议。Bell 等[17]提出的对浸润性种植的诊断标准是:上皮不规则增生,浸润腹膜邻近或下方的正常组织,并且另外提出了2 个诊断浸润性种植的额外附加标准:1)微乳头结构;2)实性上皮巢或乳头被空隙包围。NCCN 指南(2011 年版)针对卵巢肿瘤化疗一线方案仍建议采用包括腹腔化疗和紫杉醇化疗在内的4 种方案。Bell 等[18]认为有以下危险因素:1)年龄>55 岁;2)肿瘤包膜不完整、肿瘤破裂;3)腹水及广泛粘连;4)组织学为非浆液性者;5)DNA 指数为非整倍体;6) CA125、血清基质金属蛋白酶2(MP-2)明显增加,尿微量白蛋白(UMA)及CEA 强阳性表达者及处于进展期者,应在术后行辅助化疗。在本研究中,笔者利用逐步回归法对Cox 模型进行分析,探讨化疗次数和孕次、局部淋巴结转移、远处转移和盆腔浸润等多因素作用下预后及生存率的关系。结果示化疗次数和孕次是保护因素,局部淋巴结转移、远处转移和盆腔浸润是高危因素。因此,临床工作中应注重这些危险因素的处理与化疗结合的密切关系。
Ki-67 的表达与卵巢癌病理分期密切相关,对临床治疗提供了一个全面、客观的信息。由于卵巢癌预后多发危险因素,应对患者进行密切随访。在对卵巢癌患者的诊断及治疗时应全面观察及评价,对有高危因素者及有条件化疗者应给予化疗。
[1]Burger R A,Brady M F,Bookman M A,et al.Incorporation of bevacizumab in the primary treatment of ovarian cancer[J].N Engl J Med,2011,365(26):2473-2483.
[2]Siegel R,Ward E,Brawley O,et al.The impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
[3]Aune G,Stunes A K,Tingulstad S,et al.The proliferation markers Ki-67/MIB-1,phosphohistone H3,and survivin may contribute in the identification of aggressive ovarian carcinomas[J].Int J Clin Exp Pathol,2011,4(5):444-453.
[4]Rahmanzadeh R,Rai P,Celli J P,et al.Ki-67 as a molecular target for therapy in an in vitro three-dimensional model for ovarian cancer [J].Cancer Res,2010,70 (22):9234-9242.
[5]Kuhn E,Kurman R J,Sehdev A S,et al.Ki-67 labeling index as an adjunct in the diagnosis of serous tubal intraepithelial carcinoma[J].Int J Gynecol Pathol,2012,31(5):416-422.
[6]Li W,Cai J H,Zhang J,et al.Effects of cyclooxygenase inhibitors in combination with taxol on expression of cyclin d1 and ki-67 in a xenograft model of ovarian carcinoma[J].Int J Mol Sci,2012,13(8):9741-9753.
[7]Schnipper L E,Smith T J,Raghavan D,et al.American society of clinical oncology identifies five key opportunities to improve care and reduce costs:the top five list for oncology[J].J Clin Oncol,2012,30(14):1715-1724.
[8]Chalkidou A,Landau D B,Odell E W,et al.Correlation between Ki -67 immunohistochemistry and 18F -fluorothymidine uptake in patients with cancer:A systematic review and meta-analysis[J].Eur J Cancer,2012,48(18):3499-3513.
[9]Keam B,Im S A,Lee K H,et al.Ki-67 can be used for further classification of triple negative breast cancer into two subtypes with different response and prognosis[J].Breast Cancer Res,2011,13(2):R22.
[10]Fasanella S,Leonardi E,Cantaloni C,et al.Proliferative activity in human breast cancer:Ki-67 automated evaluation and the influence of different Ki-67 equivalent antibodies[J].Diagn Pathol,2011,6(S 1):S7.
[11]Aune G,Stunes A K,Tingulstad S,et al.The proliferation markers Ki-67/MIB-1,phosphohistone H3,and survivin may contribute in the identification of aggressive ovarian carcinomas[J].Int J Clin Exp Pathol,2011,4(5):444-453.
[12]Rattan R,Graham R P,Maguire J L,et al.Metformin suppresses ovarian cancer growth and metastasis with enhancement of cisplatin cytotoxicity in vivo[J].Neoplasia,2011,13(5):483-491.
[13]Mitra A K,Sawada K,Tiwari P,et al.Ligand-independent activation of c-Met by fibronectin and α(5)β(1)-integrin regulates ovarian cancer invasion and metastasis [J].Oncogene,2011,30(13):1566-1576.
[14]Nieman K M,Kenny H A,Penicka C V,et al.Adipocytes promote ovarian cancer metastasis and provide energy for rapid tumor growth[J].Nat Med,2011,17(11):1498-1503.
[15]Vaughan S,Coward J I,Bast R C,et al.Rethinking ovarian cancer:recommendations for improving outcomes[J].Nat Rev Cancer,2011,11(10):719-725.
[16]Zillhardt M,Park S M,Romero I L,et al.Foretinib (GSK 1363089),an orally available multikinase inhibitor of c-Met and VEGFR-2,blocks proliferation,induces anoikis,and impairs ovarian cancer metastasis [J].Clin Cancer Res,2011,17(12):4042-4051.
[17]Bell K A,Smith Sehdev A E,Kurman R J.Refined diagnostic criteria for implants associated with ovarian atypical proliferative serous tumors(borderline) and micropapillary serous carcinomas [J].Am J Surg Pathol,2001,25(4):419-432.
[18]Bell D A,Scully R E.Ovarian serous borderline tumors with stromal microinvasion:a report of 21 cases[J].Hum Pathol,1990,21(4):397-403.

