微波改性对活性炭及其甲醇吸附的影响*
李立清,梁 鑫,姚小龙,李海龙,马卫武,刘 飒
(中南大学 能源科学与工程学院,湖南 长沙 410083)
甲醇是常见于农药、医药、涂料、染料等有机化工产业产生的挥发性有机化合物(VOCs)之一,它对人体具有强烈的毒性,麻醉中枢神经系统引起急慢性中毒.由于其极易挥发,所以对空气中存在的甲醇进行去除显得非常必要.活性炭(AC)是一种具有巨大比表面积的多孔吸附材料,活性炭吸附也越来越广泛地用于VOCs的去除[1-2].活性炭的表面化学性质及孔结构决定其吸附性能,通过各种途径对活性炭进行改性,研究改性后活性炭的吸附性能一直是研究的热点.
热处理能改变活性炭的表面化学特性,同时也能有效调节活性炭的孔结构[3].微波加热属于内加热,升温迅速,微波场中无温度梯度存在,受热均匀,加热效率高,能耗低,在活性炭改性研究中得到重视.有学者对比研究了微波加热和传统加热对活性炭吸附行为的影响,发现微波改性活性炭具有更大的微孔孔容[4],基于微波加热的优越性,本文对不同温度微波改性活性炭吸附甲醇进行了实验研究,多角度探讨了微波改性对活性炭本身及其吸附甲醇的影响.
1 实验部分
1.1 热重实验
利用热重分析仪(LABSYS TG,SETARAM,France)在氮气氛围下测试原始未改性活性炭的TG 特性曲线.
1.2 活性炭改性
称取50g活性炭(RS-5型,河南长葛利民活性炭有限公司)进行预处理:将活性炭置于烧杯中,采用电子万用炉用水煮沸30min(煮沸);煮沸后的活性炭用去离子水洗涤4~5次(漂洗);漂洗后的活性炭置真空干燥箱(DZF 型,北京市永光明医疗仪器厂)中在110°C下干燥12h(烘干).这样所得样品为原始未改性活性炭,记为AC-1.称取10g AC-1置于微波高温烧结炉(WZ3/2.45型,长沙隆泰科技有限公司)中,在流量为600mL·min-1的高纯N2气氛下进行微波辐照,微波频率为2.45GHz,根据热重实验结果,分别选定在600,700和800 ℃3个温度点下加热30 min,冷却后置于真空干燥箱中110℃下干燥24h,所得样品分别记为AC-600,AC-700和AC-800.
1.3 活性炭表征
1.3.1 孔结构表征
活性炭的孔结构参数采用低温氮气吸附法进行测定.利用比表面积及孔径分析仪SA3100(BECKMAN COULTER,USA)测定77K 下高纯N2在活性炭上的吸附等温线.BET 比表面积SBET由标准BET 法得到;微孔孔容Vmicro,微孔比表面积Smicro由t-Plot方法计算得到;中孔孔容Vmeso,大孔孔容Vmacro基于BJH 法计算得到,总孔容Vtotal由相对压力为0.9814时的液氮吸附量换算成液氮体积得到;孔径分布是基于BJH 方法通过分析吸附或脱附等温线分支得到.
1.3.2 表面官能团表征
利用Boehm 滴定定量测试活性炭表面总酸性基团、总碱性基团、羧基以及酚羟基的含量;采用傅立叶转换红外光谱仪NEXUS670(Nicolet,USA)表征活性炭表面某些特定结构的官能团.
1.4 吸附实验
固定床吸附实验装置如图1所示,该装置由配气系统、恒温系统、吸附床和测试系统组成.室内空气经过硅胶干燥器干燥后,一部分直接进入混合器,另一部分穿过微型喷淋区和恒温区得到饱和有机蒸汽,干燥空气和饱和有机蒸汽在混合器中混合,混合气体用真空泵吸取并泵入固定床进行吸附,尾气经净化后排放.吸附柱进气浓度和出气浓度由气相色谱仪(SP-6890型,山东鲁南瑞虹化工仪器公司)测定,待出气浓度与进气浓度相等,并保持30 min左右,则认为吸附已达平衡[5-6].每次实验中,将4g活性炭样置于内径为1.1cm 石英管吸附柱,吸附温度用恒温水箱(DC1015 型,上海天平仪器公司)保持在10°C.分别在C1为6.11,C2为11.03,C3为13.69,C4为18.91和C5为24.82g·m-35种进气浓度条件下,利用电子天平称重法(JA1203N 型,上海精密科学仪器有限公司)测得不同浓度下4种活性炭对甲醇(分析纯AR,国药集团化学试剂有限公司)的吸附量,从而得到甲醇的等温吸附曲线.

图1 固定床吸附实验装置Fig.1 Fixed-bed adsorption experiment device
2 结果与讨论
2.1 热重分析
AC-1的热重曲线如图2所示.曲线在50~100°C范围内呈现轻微的下降趋势,这可能是活性炭中少量水分蒸发引起;在100~500°C范围时,随温度升高活性炭质量基本保持不变,这说明该阶段活性炭内部的基团保持相对稳定;而在500~900°C 范围时,曲线以约0.01mg·°C-1的速度下滑,这说明此温度范围内,活性炭表面某些物质或者基团发生了热分解.因此本文选定在600,700和800°C 3个温度点下对活性炭进行微波加热改性.

图2 AC-1的热重曲线Fig.2 TG curve of AC-1
2.2 改性对孔结构的影响
表1为活性炭的孔结构参数结果.由表可知,AC-1的BET 比表面积、总孔容均为最大,分别为971.74m2·g-1和0.517 5mL·g-1.微波改性后,BET 比表面积和总孔容随着温度的增加先减小后增大,其大小顺序为:AC-1>AC-800>AC-600>AC-700,但是微孔比表面积的大小顺序与之刚好相反,AC-700具有最大的微孔比表面积,比AC-1 大156.27m2·g-1.而且,与AC-1相比,AC-700微孔孔容占总孔容的比例Vmicro/Vtotal由72%升至83%,这些都说明,在600~700 ℃范围内,形成了很多新的微孔[7].当温度升至800 ℃时,微孔比表面积和微孔孔容又降低,可能是由于一部分较小微孔的堵塞,同时,中孔孔容和大孔孔容也有一定程度的降低,这可能是由于某些炭骨架的塌陷所引起.
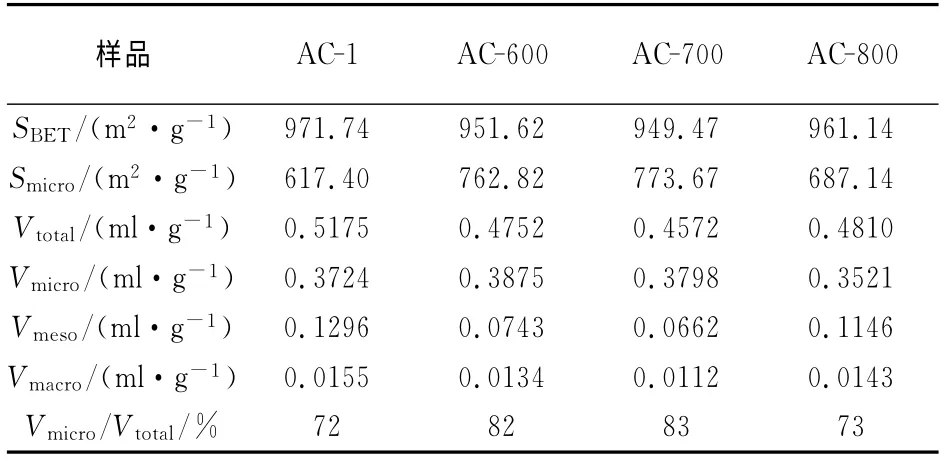
表1 活性炭的孔结构参数Tab.1 Pore structure parameters of ACs
2.3 改性对表面官能团的影响
2.3.1 Boehm 滴定
表2为Boehm 滴定结果.微波改性后,酚羟基、羧基的数量逐渐减小,温度越高,酸性基团分解量越大,AC-600和AC-700酸性基团总量分别为AC-1的40.8%和17.7%,温度达800℃时,酸性基团完全分解.随着温度的升高,含氧官能团从活性炭表面去除之后,活性炭的碱性基团则逐渐生成[8],碱性基团总量的大小顺序为:AC-800>AC-700>AC-600>AC-1,AC-800的碱性基团总量约为AC-1的2.6倍.

表2 Boehm 滴定结果Tab.2 Results of Boehm Titration
2.3.2 傅立叶转换红外光谱(FTIR)
图3为FTIR 的测试结果.在某些相同波数段,改性活性炭和原始活性炭均出现明显的吸收峰,同时,改性活性炭在不同波数段出现新的吸收峰,这表明,改性后既保留了原有的某些基团,又产生了新的基团.
由图所示,2 845~2 975cm-1处的吸收峰,表明存在C-H 键的伸缩振动;AC-1,AC-600和AC-700在1 620~1 670cm-1处的吸收峰,则表明存在碳碳双键的伸缩振动,而AC-800 无此峰,这说明800 ℃下碳碳双键已经被破坏;AC-1,AC-600 和AC-700在3 200~3 670cm-1处宽而尖锐的吸收峰,表明存在羟基的伸缩振动,而AC-800在此波数段表现为双峰,说明羟基在800 ℃下已完全分解,3 200和3 350cm-1处的双峰显示伯酰胺氢键的缔合,由N-H 的伸缩振动引起.1 030~1 230cm-1处的吸收峰表明存在脂肪胺C-N 的伸缩振动.随着温度的升高,1 680~1 750cm-1波数段的峰强明显减小,表明活性炭表面羰基C=O,羧基COOH,酯键COO 的数量逐渐减小.

图3 活性炭的红外光谱Fig.3 The FTIR spectra of ACs
2.4 改性对等温吸附线的影响
等温吸附线的测量方法详见1.4,实验得到4种活性炭的等温吸附线如图4所示.根据国际纯粹与应用化学联合会(IUPAC)分类法,其均属于Ⅰ型等温吸附线.微波改性后,吸附量由大到小顺序为AC-800>AC-600>AC-1>AC-700.
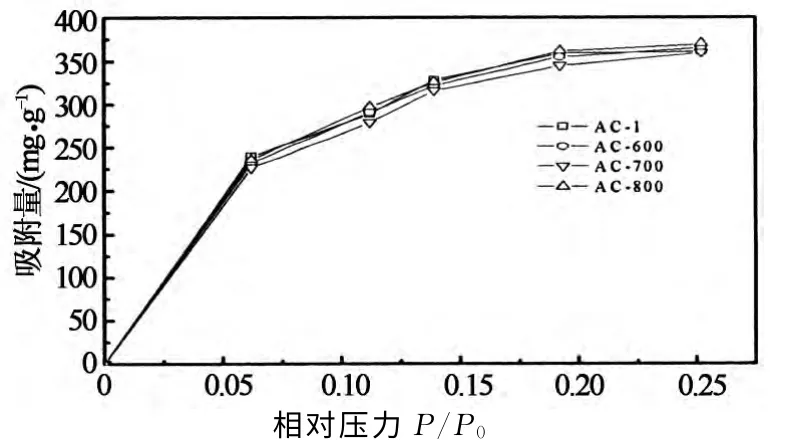
图4 甲醇的吸附等温线Fig.4 The adsorption isotherms of methanol
Langmuir模型的数学形式可表示为

其中:qe为平衡吸附量,mg·g-1;qmax为单分子层饱和吸附量,mg·g-1;Ce是被吸附气体的平衡浓度,g·m-3;KL是Langmuir常数,m3·g-1,与吸附能有关.Freundlich模型的数学形式可表示为

其中:qe,Ce同上;Kf为Freundlich常数,当Ce等于1时,Kf与qe的值相等,它被认为是相对吸附容量.nf为代表吸附剂吸附强度的常数.Langmuir方程和Freundlich方程对图4等温吸附实验数据的拟合参数见表3.

表3 Langmuir方程和Freundlich方程的拟合参数Tab.3 The fitting parameters of Langmuir Equation and Freundlich equation
由表3 可知,Langmuir方程拟合的相关系数R2均大于0.991,表明甲醇在活性炭上的吸附等温线能较好地用Langmuir模型来预测,Freundlich方程拟合的相关系数相对较小,说明吸附并不是发生在非均匀固体表面.据文献[9],一般认为0.1<nf<1.0时,有利于吸附,位于0.1~0.5这个区间时容易吸附,且nf值越小,吸附越容易进行,而nf>1.0时,吸附作用力变弱,不利于吸附.此处nf都位于0.22~0.31区间,并且微波改性炭的nf值均比AC-1小.nf还是吸附线性偏差的一个度量,用来验证吸附的类型,一般认为nf等于1.0时,吸附是线性的,如果nf小于1.0,则说明吸附是一个物理吸附,如果nf大于1.0,则说明吸附是一个化学吸附.这里最大的nf值为0.308 9,表明甲醇在4种活性炭上均以物理吸附为主,吸附时起主要作用的是范德华力而不是化学键力[10].
2.5 改性对吸附动力学的影响
甲醇在4种活性炭上的动态吸附曲线如图5所示.由图可知,随着吸附时间增大,活性炭的吸附速率减小,前20min内,吸附速率约为6mg·min-1,而后40min内,吸附速率降至0.4mg·min-1.

图5 甲醇的动态吸附曲线Fig.5 The dynamic adsorption curves of methanol
为了全面研究4种活性炭对甲醇的吸附动力学特性,找到最适合描述此吸附过程的动力学模型,本文选用3种动力学模型来对图5的数据进行拟合.准一阶模型主要用于描述物理吸附过程,其动力学方程如下[11]:
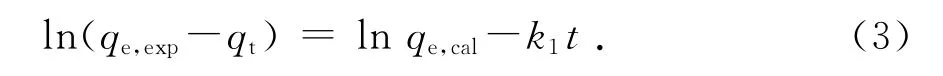
其中:qt和qe,exp分别是吸附时刻t和吸附平衡时刻的吸附量,mg·g-1;qe,cal为模型预测的平衡吸附量,mg·g-1;k1为准一阶模型吸附速率常数,min-1.准二阶模型主要用于描述物理和化学复合的吸附过程,其动力学方程如式(4)[12]:

其中:qt和qe,cal同上;k2为准二阶模型吸附速率常数,g·mg-1·min-1.对图5 数据作ln(qe,exp-qt)~t以及t/qt~t的线性关系图,通过计算直线的斜率及截距得到的拟合结果见表4.
由表4可知,4种活性炭吸附甲醇的过程用准一阶模型和准二阶模型拟合的线性相关系数均大于0.98,说明两种模型均能很好地模拟甲醇的吸附动力学过程.但是,准二阶动力学方程拟合的线性相关系数均比准一阶动力学方程大,又说明4种活性炭吸附甲醇的过程是一个物理和化学复合的吸附过程,吸附受到活性炭表面官能团的影响,但是官能团的影响在吸附过程中不起主导作用.并且,对于AC-600,AC-700和AC-800,两种模型预测的平衡吸附量qe,cal的大小顺序均与实验得出的平衡吸附量qe,exp大小顺序相吻合.

表4 准一、二阶动力学方程拟合参数Tab.4 Fitting parameters of pseudo-first-order and pseudo-second-order kinetic equation
Weber等提出的颗粒内扩散模型的Weber-Morris方程如式(5)[13]:

其中:qt为t时刻的吸附量,mg·g-1;KW为颗粒内扩散速率常数,mg·g-1·min-0.5;t为吸附时间,min;b为直线截距,其数值大小反应了边界层效应.Weber和Morris认为,如果吸附量qt与t0.5所作直线通过原点,则表明吸附速率由内扩散控制;若不通过原点,截距b越大,膜扩散在速率控制中的影响也越大.利用图5数据作qt~t0.5的线性关系图,拟合曲线见图6,拟合参数见表5.

图6 颗粒内扩散模型拟合曲线Fig.6 Fitting curves of intra-particle diffusion model
由上图可知,qt对t0.5呈现3 个线性阶段.第1阶段为吸附质分子在吸附剂上的表面吸附阶段,此阶段在前2min内迅速完成,吸附速率常数KW1较小,吸附速率主要受吸附质浓度的影响.第2阶段为渐近吸附阶段,此阶段约在2~40min左右完成,该阶段吸附速率常数KW2的大小顺序为:AC-800>AC-700>AC-600>AC-1,且截距b2不为0,说明吸附速率受颗粒内扩散和膜扩散的共同影响.第3阶段为最终吸附平衡阶段,40min后活性炭的大部分的微孔被吸附质填充,接着开始在中孔和大孔表面形成多层吸附,吸附速率相比第2阶段明显减小,该阶段b3值较大,说明膜扩散在此阶段起到了重要作用.由表5还可知,3个阶段的吸附速率常数由大到小为KW2,KW3,KW1,吸附质通过颗粒内扩散到吸附质内表面被吸附时的速率常数最大.3个阶段线性拟合的相关系数均较大,拟合效果较好,甲醇在活性炭上的整个吸附过程受到颗粒内扩散和膜扩散的共同作用.

表5 颗粒内扩散模型拟合参数Tab.5 Fitting parameters of intra-particle diffusion model
2.6 改性对吸附能的影响
D-R 方程的数学表达形式为[14]:

式(6)可简化变形为:

其中,W为相对压力p/p0下吸附质的平衡吸附量,mL·g-1;W0为微孔极限吸附量,mL·g-1;A为吸附势,A=RTln(p0/p),kJ·mol-1;β为与吸附质有关的吸附亲和系数;E0,E分别为标准吸附质苯和所用吸附质的特征吸附能,kJ·mol-1;p0,p分别为饱和蒸汽压和平衡压力,Pa;R为通用气体常数,J·mol-1·K-1;T为绝对温度,K.
利用4种活性炭的氮气吸附等温数据,通过式(7)作lnW~ln2(p0/p)的线性关系图,直线的斜率为-2.303(RT/βE0)2,N2的亲和系数为0.33[15],由此可求得AC-1,AC-600,AC-700,AC-800的特征吸附能E0分别为15.08,17.02,17.13和16.46kJ·mol-1.同理,甲醇的亲和系数为0.40,根据E=βE0可计算出活性炭对甲醇的吸附能(见表6).R2值为0.985~0.998,表明拟合效果较好.计算得出的吸附能位于6.03~6.85kJ·mol-1,其数值相对较小,可以推断甲醇在活性炭上的吸附过程以物理吸附为主.MANGUN C L[16]等人认为,活性炭表面含氮官能团越多,吸附能越大,活性炭在氮气氛围下进行微波改性后,经图3 的FTIR 验证,AC-600,AC-700和AC-800表面生成含氮官能团,故微波改性活性炭的吸附能大于未改性活性炭.

表6 甲醇在活性炭上的吸附能Tab.6 Adsorption energies of methanol onto ACs
3 结 论
1)微波辐照加热改性后,活性炭的总比表面积、孔容较小幅度减小,但微孔比表面积显著增大,形成许多新的微孔.随着温度升高,酸性基团大量分解,碱性基团逐渐形成.
2)4种活性炭对甲醇的吸附量大小顺序为AC-800>AC-600>AC-1>AC-700,说明最佳微波改性温度为800°C.
3)Langmuir方程和Freundlich方程均能较好的描述甲醇在活性炭上的吸附.
4)准二阶动力学方程最适合描述甲醇的动态吸附过程,说明甲醇吸附是一个物理和化学复合的吸附过程,吸附受到活性炭表面官能团的影响.颗粒内扩散模型拟合结果分为3个线性阶段:表面吸附阶段、渐近吸附阶段和吸附平衡阶段.甲醇在活性炭上的吸附受到颗粒内扩散和膜扩散的共同作用.
5)微波改性后活性炭对甲醇的吸附能均增大,吸附能与活性炭表面含氮官能团总量成正比.
[1]CHIANG Yu-Chun,CHIANG Pen-Chi,HUANG Chin-Pao.Effects of pore structure and temperature on VOC adsorption on activated carbon[J].Carbon,2001,39(4):523-534.
[2]RAMOS M E,BONELLI P R,CUKIERMAN A L,etal.Adsorption of volatile organic compounds onto activated carbon cloths derived from a novel regenerated cellulosic precursor[J].Journal of Hazardous Materials,2010,177(1/3):175-182.
[3]MENENDEZ J A,MENENDEZ E M,IGLESIAS M J,etal.Modification of the surface chemistry of active carbons by means of microwave-induced treatments[J].Carbon,1999,37(7):1115-1121.
[4]HUANG Li-hui,SUN Yuan-yuan,WANG Wei-liang,etal.Comparative study on characterization of activated carbons prepared by microwave and conventional heating methods and application in removal of oxytetracycline(OTC)[J].Chemical Engineering Journal,2011,171(3):1446-1453.
[5]李立清,Hans-Jürgen Röhm,Wolf-Dieter Suβebach.活性炭C40/4吸附甲苯和丙酮吸附性能研究[J].湖南大学学报:自然科学版,2003,30(5):47-50.
LI Li-qing,Hans-Jürgen Röhm,Wolf-Dieter Suβebach.Study on adsorption isotherm of toluene and acetone onto activated carbon C40/4[J].Journal of Hunan University:Natural Sciences,2003,30(5):47-50.(In Chinese)
[6]李立清,石瑞,顾庆伟,等.酸改性活性炭吸附甲苯的性能研究[J].湖南大学学报:自然科学版,2013,40(5):92-98.
LI Li-qing,SHI Rui,GU Qing-weietal.Adsorption of toluene on activated carbons with acid modified[J].Journal of Hunan University:Natural Sciences,2013,40(5):92-98.(In Chinese)
[7]CHINGOMBE P,SAHA B,WAKEMAN R J.Surface modification and characterisation of a coal-based activated carbon[J].Carbon,2005,43(15):3132-3143.
[8]CARROTT P J M,NABAIS J M V,CARROTT M M L R,etal.Thermal treatments of activated carbon fibres using a microwave furnace[J].Microporous and Mesoporous Materials,2001,47(2/3):243-252.
[9]GERELI G,SEKI Y,KUSOGLU I M,etal.Equilibrium and kinetics for the sorption of promethazine hydrochloride onto K10montmorillonite[J].Journal of Colloid and Interface Science,2006,299(1):155-162.
[10]VIMONSES V,LEI Shao-min,JIN B,etal.Kinetic study and equilibrium isotherm analysis of Congo Red adsorption by clay materials[J].Chemical Engineering Journal,2009,148(2/3):354-364.
[11]HAMEED B H,AHMAD A A,AZIZ N.Isotherms,kinetics and thermodynamics of acid dye adsorption on activated palm ash[J].Chemical Engineering Journal,2007,133(1/3):195-203.
[12]HO Y S,MCKAY G.Pseudo-second-order model for sorption process[J].Process Biochemistry,1999,34(5):451–465.
[13]WEBER W J,MORRIS J C.Kinetics of adsorption on carbon from solution[J].J Sanit Eng Div Am Soc Civ Eng,1963,89(17):31-60.
[14]CHEN S G,YANG R T.Theoretical basis for the potential theory adsorption isotherms.The Dubinin-Radushkevich and Dubinin-Astakhov equations[J].Langmuir,1994,10(11):4244-4249.
[15]WOOD G O.Affinity coefficients of the Polanyi/Dubinin adsorption isotherm equations:A review with compilations and correlations[J].Carbon,2001,39(3):343-356.
[16]MANGUN C L,DEBARR J A,ECONOMY J.Adsorption of sulfur dioxide on ammonia-treated activated carbon fibers[J].Carbon,2001,39(11):1689-1696.

