不同剂量银杏叶提取物对红藻氨酸致痫大鼠神经肽Y蛋白表达的影响*
王 芳,俸军林 ,张小芬,蒋静子,吴 岚,梁 静,陈春莲,易玉芳
1)桂林医学院附属医院神经内科 桂林541001 2)桂林医学院附属医院老年科 桂林541001
#通讯作者,男,1965年6月生,硕士,主任医师,研究方向:癫痫与脑血管病,E-mail:2274196104@qq.com
癫痫是由各种原因引起的脑细胞异常放电导致的脑功能障碍综合征,虽然80%左右患者的癫痫发作能被现代抗癫痫药控制,但仍有约20%的患者反复发作,且大部分患者需长期甚至终生服药治疗,寻找更安全、高效的疗法和方药具有很重要的临床意义。银杏叶提取物(ginkgo biloba extract,GBE)是从银杏叶中利用醇溶液提取出的混合成分,它除了对心血管系统具有明显的药理作用外,对减少神经细胞损伤、增加神经递质的含量、改善脑细胞功能、促进脑功能恢复等也具有很好的药理作用,可作为抗癫痫的辅助药物[1]。神经肽Y(neuropeptide Y,NPY)是一种抑制性神经递质,研究[2]显示其具有抑制局部和全身性癫痫发作的作用。该研究通过于侧脑室注射红藻氨酸(kainic acid,KA)建立癫痫模型,观察不同剂量GBE 急性期给药对癫痫的干预效应及其对NPY 蛋白表达的影响,以探讨GBE 的抗癫痫机制,为开发出高效、广谱、低毒的抗癫痫药提供新的思路。
1 材料与方法
1.1 主要试剂及仪器 KA 注射液购自美国Sigma公司,银杏叶提取物761(GBE761)购自西安天本生物工程有限公司,兔抗大鼠NPY 蛋白多克隆抗体购自Bioworld Technology 公司,日本产Narishige SR-6R型大鼠脑立体定向仪、电子显微镜等。
1.2 动物分组及给药方法 雄性SD 大鼠90 只,体重250~300 g,由桂林医学院实验动物中心提供。所有实验动物均在温暖(20℃)、避强光、避噪音、自由进食及饮水条件下单笼饲养。大鼠经适应性喂养3 d 后采用随机数字表法分为以下几组:假手术组(n=18);GBE 对照组(n =18),用同体积的体积分数50% 1,2-丙二醇代替GBE;癫痫模型组(n =18);小剂量GBE组(n =18),于制备癫痫模型0.5 h 后按100 mg/kg 腹腔注射溶于体积分数50%的1,2-丙二醇的质量分数1%的GBE761 注射液;大剂量GBE组(n=18),于制备癫痫模型后0.5 h 按200 mg/kg 腹腔注射质量分数1%的GBE761 注射液。根据致痫后处死时间不同,各组再分为造模成功后6、12 及24 h 3 个亚组(n=6)。
1.3 癫痫模型制作 采用腹腔注射体积分数10%水合氯醛(0.036 mL/kg)麻醉,将大鼠头部固定于立体定向仪上,剪除其头部的毛发,局部消毒;术者戴无菌手套,沿头部正中线切开头皮10~15 mm,接着用体积分数30%的双氧水腐蚀颅骨上腱膜及颅骨外膜,暴露前囟。依照大鼠脑立体定向图谱定位右侧侧脑室,钻一直径为1.0 mm 的圆孔,深达硬脑膜表面。将预先装有KA 的微量进样器沿钻孔进针,进针深度达4.5 mm 时向侧脑室内注射0.8 g/L KA 溶液1 μL,在10 min 内缓慢匀速地注射完毕,留针5 min 后缓慢拔针。最后用骨蜡封闭颅骨所钻孔,缝合头皮,放回笼中进行行为学观察。假手术组不注射KA。
1.4 大鼠行为学观察 将大鼠癫痫发作级别分为6 级。0 级:正常;Ⅰ级:立须、咀嚼等面肌抽动;Ⅱ级:点头等颈肌抽动;Ⅲ级:一侧前肢的抽动、阵挛;Ⅳ级:双侧前肢的抽动、阵挛,伴站立;Ⅴ级:四肢强直、抽动,伴站立、跌倒及身体强直背曲。观察各组大鼠的行为2 h 并记录癫痫发作级别,Ⅲ级及以下为轻型发作,Ⅳ~V 级为重型发作。Ⅳ~V 级视为癫痫造模成功,如果造模失败,则以相同数量动物补充造模。
1.5 灌注取材及标本制备 先将大鼠麻醉,再剪开大鼠胸腔暴露心脏,将针头从大鼠心尖刺入,同时剪开右心耳放血。接着向心脏内快速推注生理盐水约200 mL,使从右心耳流出的液体最终清亮,肺脏变白。然后向心脏内快速灌注40 g/L 多聚甲醛约400 mL,使四肢及头尾变硬。注射完毕即刻断头取脑,于40 g/L 多聚甲醛中固定24 h。取前囟后2.5~4.5 mm 处脑组织,脱水包埋制成蜡块,用于HE 染色及免疫组化染色。
1.6 海马组织HE 染色 切取石蜡切片,厚约3 μm,进行HE 染色,置于显微镜下观察神经细胞形态学变化。
1.7 海马组织NPY 蛋白免疫组化染色 切取石蜡切片,厚约4 μm,进行免疫组化染色,取海马齿状回门区组织观察NPY 蛋白,阳性细胞胞质呈棕黄色。光学显微镜下观察5 个高倍(×400)视野,计数阳性细胞数,取其均值作为NPY 蛋白表达量。
1.8 统计学处理 采用SPSS 17.0 进行数据分析。5组间以及3 个时间点间海马组织NPY 蛋白表达量的比较采用单因素方差分析,两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.1 行为学观察结果 见表1。假手术组无痫样发作,GBE 对照组和癫痫模型组均为Ⅳ~Ⅴ级发作,小剂量GBE组与大剂量GBE组均为Ⅱ~Ⅳ级发作。
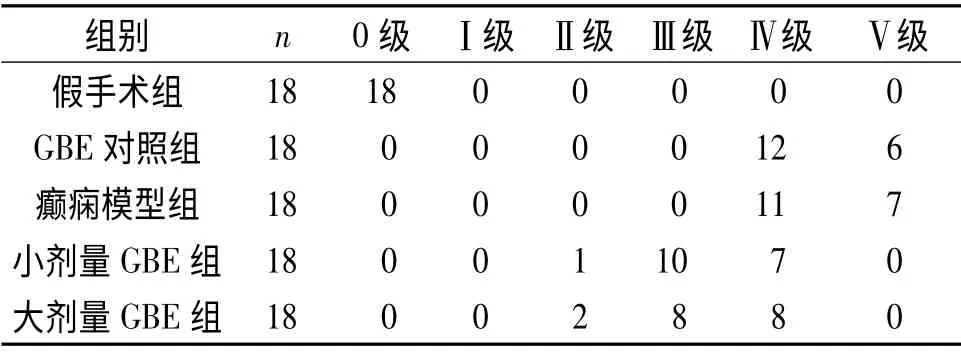
表1 各组大鼠行为学观察结果例
2.2 海马组织HE 染色结果 在KA 注射后6 h 即可见癫痫模型组注射侧海马各区神经元受到损害,正常细胞明显减少,神经元发生变性、坏死,尤以海马CA3 区最明显。变性的神经元细胞肿胀,细胞排列不整齐、轮廓不清、间隙增大,核仁模糊,胞核移位。坏死的神经元胞质浓缩、深染,核碎裂;星形胶质细胞体积增大,胞质淡染;齿状回颗粒细胞部分受损,细胞排列杂乱,胞核固缩。于KA 注射后12 h 神经元变性、坏死更明显。KA 注射后24 h,CA3 区锥体细胞脱失,细胞排列稀疏、层次减少;小剂量GBE组与大剂量GBE组CA3 区神经元损害均较癫痫模型组减轻;GBE 对照组CA3 区神经元损害程度与癫痫模型组相同。见图1。
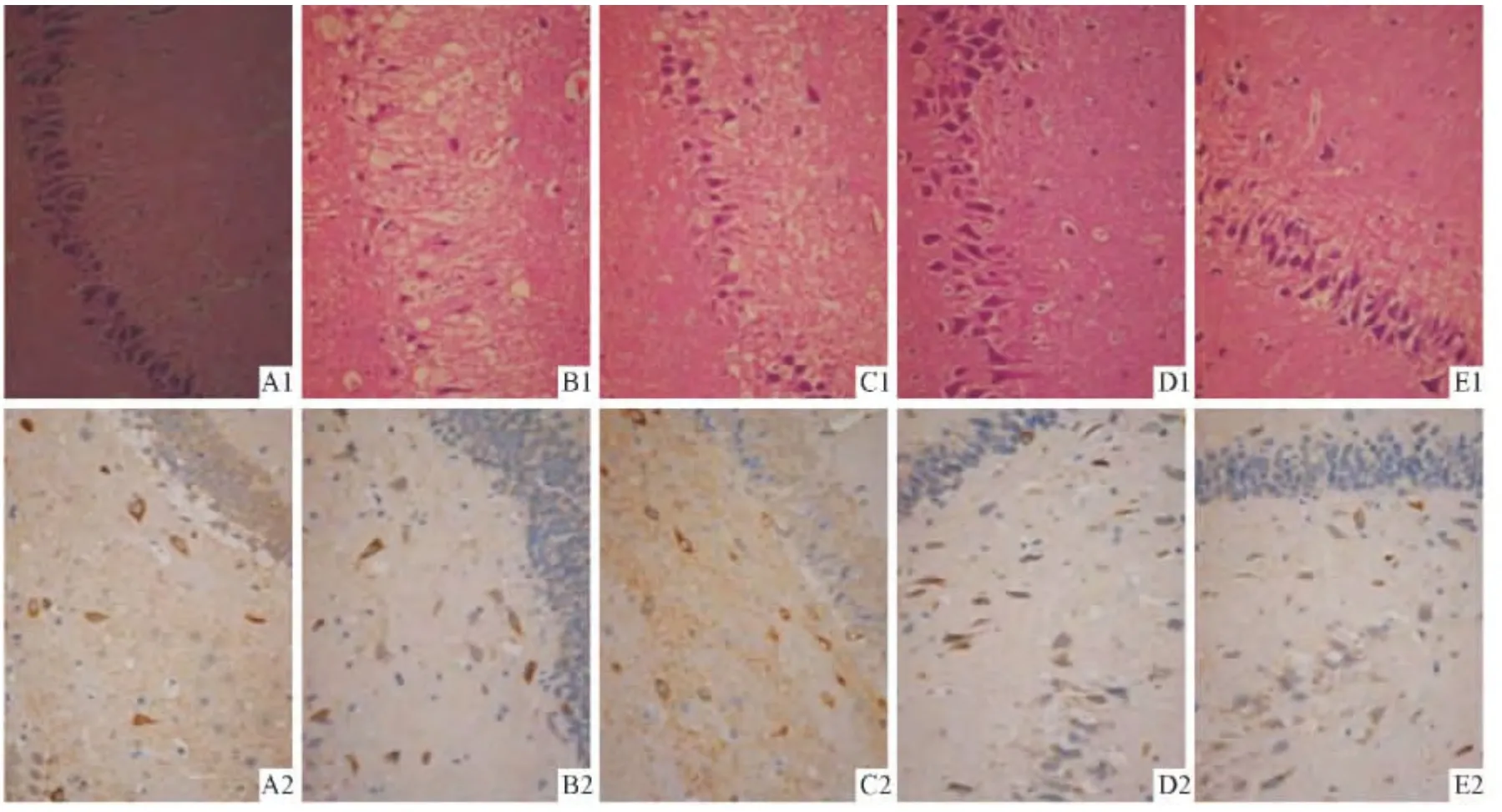
图1 各组大鼠KA 注射后24 h 右侧海马CA3 区HE 染色(1)和齿状回区NPY 蛋白免疫组化染色(2)结果(×400)
2.3 海马组织免疫组化染色结果 见图1、表2。

表2 各组大鼠右侧海马齿状回区NPY 蛋白表达量比较
3 讨论
GBE 所含成分银杏总黄酮苷和银杏苦内酯等具有扩张脑血管、促进脑血液循环、增加脑血流量等作用,可改善缺氧脑细胞的能量代谢和营养,提高脑细胞耐缺氧能力,减轻脑水肿,减少神经细胞损伤,增加神经递质的含量,改善脑细胞功能,促进脑细胞的恢复[1-3]。该实验中KA 模型有与人类颞叶癫痫极为相似的海马硬化神经病理形态学改变及癫痫发作行为特征[4-5],结果显示,GBE 对照组和癫痫模型组均为Ⅳ~Ⅴ级发作,小剂量及大剂量GBE组均为Ⅱ~Ⅳ级发作。结果表明GBE 对致痫大鼠具有一定抗癫痫作用,GBE 急性期给药能减少致痫大鼠神经元损害并减轻其癫痫发作程度,但2 种剂量GBE的效果差异无统计学意义。
NPY 是一种含36 个氨基酸的神经肽,大脑皮层、海马、丘脑及下丘脑为其主要分布区。NPY 具有多方面的生物学作用[6]。另外,在神经元兴奋性尤其是在中间神经元的释放方面,NPY 也发挥着极其重要的作用[7]。此外,还有研究[8]显示,癫痫的短暂发作诱导的NPY 持续过度表达在预防癫痫方面有重要作用。海马旁区域的可塑性及NPY 过度表达可被癫痫的反复发作持久激活[9]。癫痫发作后脑组织内NPY 表达增多是机体抑制癫痫发作的代偿机制,同时也是机体自我保护机制的表现[10-12]。该实验中,同一处死时间点各组大鼠相比较,癫痫模型组海马中NPY 蛋白表达量较假手术组明显增多,同组内3 个时间点NPY 蛋白表达量呈上升趋势,进一步验证了上述理论。该实验中,小剂量GBE组和大剂量GBE组NPY 蛋白的表达量均高于癫痫模型组,由此推测GBE 的抗癫痫作用很可能是通过上调NPY 的表达进一步激发NPY 的抑制癫痫作用来实现。
综上所述,2 种剂量GBE 急性期给药均可使大鼠癫痫发作级别降低,神经元损害减轻,NPY 蛋白表达增多,提示GBE 急性期给药有一定的抗癫痫作用。GBE 的抗癫痫机制与减轻神经元的损害、降低癫痫发作程度、上调NPY 蛋白的表达有关,这种作用机制有可能是抗癫痫治疗的一种新思路。
[1]仲玉洁,王金兰,陈琛,等.EGb761 对慢性脑缺血大鼠认知功能及神经胶质细胞变化的影响[J].中国实用神经疾病杂志,2010,13(4):11
[2]van Raay L,Jovanovska V,Morris MJ,et al.Focal administration of neuropeptide Y into the S2 somatosensory cortex maximally suppresses absence seizures in a genetic rat model[J].Epilepsia,2012,53(3):477
[3]李国强,刘仕勇,周政,等.慢性颞叶癫痫模型鼠海马结构形态学的变化[J].第三军医大学学报,2007,29(2):125
[4]Sperk G.Kainic acid seizures in the rat[J].Prog Neurobiol,1994,42(1):1
[5]Babb TL,Pereira-Leite J,Mathern GW,et al.Kainic acid induced hippocampal seizures in rats:comparisons of acute and chronic seizures using intrahippocampal versus systemic injections[J].Ital J Neurol Sci,1995,16(1/2):39
[6]张小芬,俸军林,蒋静子,等.银杏叶提取物预处理对红藻氨酸致痫大鼠神经肽Y 表达的影响[J].安徽医科大学学报,2013,48(8):925
[7]Baraban SC,Tallent MK.Interneuron diversity series:interneuronal neuropeptides:endogenous regulators of neuronal excitability[J].Trends Neurosci,2004,27(3):135
[8]Cardoso A,Freitas-da-Costa P,Carvalho LS,et al.Seizureinduced changes in neuropeptide Y-containing cortical neurons:potential role for seizure threshold and epileptogenesis[J].Epilepsy Behav,2010,19(4):559
[9]Drexel M,Kirchmair E,Wieselthaler-Hölzl A,et al.Somatostatin and neuropeptide Y neurons undergo different plasticity in parahippocampal regions in kainic acid-induced epilepsy[J].J Neuropathol Exp Neurol,2012,71(4):312
[10]Fu LY,van den Pol AN.GABA excitation in mouse hilar neuropeptide Y neurons[J].J Physiol,2007,579(Pt 2):445
[11]董长征,赵文清,李文玲,等.重组腺相关病毒介导人源性神经肽Y 基因转染对红藻氨酸致痫大鼠行为及脑电图的影响[J].第三军医大学学报,2010,32(19):2140
[12]Kang TC,Park SH,Park SK,et al.The temporal and spatial expressions of neuropeptide Y induced by seizure in the hippocampal complex of gerbil[J].Brain Res,2000,870(1/2):179