热处理对乳中重要生物活性成分影响的研究进展*
李延华,孟岳成,陈杰
(浙江工商大学食品与生物工程学院,浙江 杭州,310018)
乳是哺乳动物分泌的提供给后代的营养源,其中包含乳蛋白质、乳脂肪、乳糖、维生素和矿物质等营养成分,同时乳中也存在一系列生物活性物质。乳中生物活性物质包括:源自乳蛋白水解的生物活性肽,存在形式是蛋白质某一区域呈现的,通过蛋白水解消化而释放并激活的生物活性肽;乳清中的α-乳白蛋白、β-乳球蛋白、免疫球蛋白、乳铁蛋白、过氧化物酶、溶菌酶;乳脂肪中的乳脂肪球膜蛋白、共轭亚油酸;生长因子、激素和细胞活素类[1]。
近年来,有关牛乳中生物活性成分的种类及功能研究较为全面,已明确了不同生物活性成分的具体生物功能。然而,乳制品在加工过程中不可避免的会对乳体系中功能性成分的活性、结构产生影响。热处理是不同乳制品生产过程中不可或缺的工艺手段,尽管已有研究表明,添加保护剂可以减少某些生物活性成分在热处理过程中的热失活现象,但加热一定会导致生物活性成分发生活性降低、变性或者激活,进而影响乳制品中功能性活性成分的生理作用,评估热处理对乳中生物活性成分的影响具有重要的现实意义。
1 热处理过程中乳铁蛋白的生物活性和分子结构的变化
1.1 乳铁蛋白的含量与生理功能
乳铁蛋白(lactoferrin,LF)是铁与糖蛋白结合的产物,常乳中LF含量范围为0.004~0.271 mg/mL,平均为0.101 mg/mL[2],当 LF 失去铁使铁饱和度在5%以下时,为缺铁型乳铁蛋白(apo-lactoferrin,apo-LF),而当LF结合铁使铁饱和度大于85%,为铁饱和乳铁蛋白(holo-lactoferrin,holo-LF)[3]。研究表明 LF具有抗菌、抗病毒、免疫调节、促进铁吸收、促进骨重建和抑制破骨细胞介导的骨吸收等功能[4-5]。
1.2 乳铁蛋白生物活性的热稳定性
大量研究表明,LF的热稳定性与pH紧密相关。Ruegg等发现,牛乳LF在pH6.6,65~69℃时开始失活[6]。Abe等研究发现,牛乳apo-LF在酸性条件下比较稳定,pH 4.0酸性条件下,采用90℃加热5 min后LF的抗原活性、铁结合力、抑菌活性几乎无变化;采用70℃预热3 min,然后进行UHT杀菌(130℃、2 s)发现铁结合能力仅损失3%,LF在酸性条件下较耐热,在中性和碱性条件下会发生浑浊和凝胶化[7]。然而,Sreedhara等指出,在 pH 2.0~8.0内,牛乳 LF变性是不可逆的,并且变性温度随着pH减小而降低,同时指出由于pH 2.0条件下LF具有最大的疏水性,使其在(25±1)℃时发生变性,并且此时变性温度并不容易准确测定,所以认为牛乳LF的变性温度在 pH 3.0 下降到最低[8]。
基于不同加热强度LF活性的变化,Paulsson等发现,巴氏杀菌(72℃、15 s)对apo-LF和holo-LF的抗菌活性没影响,但UHT(135℃、4 s)处理后holo-LF不能结合到细菌上,并且apo-LF也失去抑菌活性[9]。Oria等研究发现,137℃、8 s处理后LF对单核细胞的增殖作用几乎没影响[10]。Dupont等检测发现,与原料乳相比较,巴氏杀菌对乳中LF并无显著影响,经过120~139℃、4 s处理后,LF的活性基本完全丧失,变性率为 95.38%[11]。
1.3 热处理诱导乳铁蛋白的结构表征
Sanchez等对牛乳LF在72℃到85℃变性一级反应动力学发现,apo-LF比holo-LF更易变性,分析原因可能是因为铁离子的结合促使LF二硫化物结合,从而防止了蛋白聚合[12]。Indyk等采用免疫分析方法,通过多表位决定因素分析加热后蛋白质变性导致完整构象损失,发现将原料乳和水溶液中的LF(pH 6.8)经过70℃、2 min的热处理后,85%的 LF保持完整的抗原特性,证实典型的巴氏杀菌所造成的LF的热暴露,能够保留构象的完整性,较高温度和时间的加热强度使LF的完整构象发生显著损失,研究中通过热诱导的动力学参数确定牛乳LF变性的第一阶段为蛋白质构象的展开,同时LF的变性受到铁结合状态的影响,而且apo-LF和holo-LF构象的展开是相互独立的,提出蛋白质发生部分的变性会导致其构象受到干扰,结果是仍保留其活性功能或者导致聚集、沉淀和功能丧失[13]。
Guillaume等描述了LF的热聚合机制,如图1所示,提出在早期阶段,加热后LF形成非共价键结合的可溶性低聚体,然后这些低聚物通过二硫键或者非共价键的分子间聚集形成较大的不溶性聚合物。聚合物形成的程度取决于LF的铁饱和度,apo-LF对热较敏感,接近60℃加热时开始发生变性,暴露非共价键的位点,通过非共价键和二硫键反应并形成非共价键聚合体。Holo-LF中结合的铁可以稳定蛋白质结构,当温度达到80℃时二硫键发生反应,通过分子间二硫键交联形成可溶性的聚合体[14]。
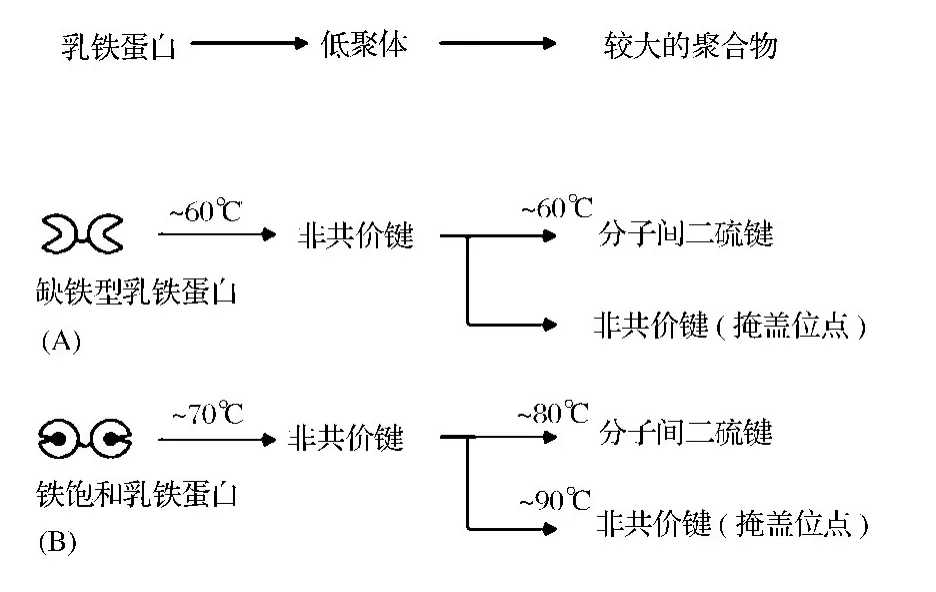
图1 缺铁型乳铁蛋白(A)和铁饱和乳铁蛋白(B)的热聚合机制Fig.1 General mechanism proposed for the thermal aggregation of native apo-lactoferrin(apo-Lf)(A)and holo-Lf(B)
2 乳过氧化物酶体系生物活性的热稳定性
乳过氧化物酶体系(lactoperoxidase systems,LPS)是一种牛乳中天然的抑菌系统,含有乳过氧化物酶(Lactopcroxidase,LPO),硫氰酸根(SCN-)和H2O2。在H2O2存在的条件下,LPO催化SCN-,使其氧化成亚硫氰酸(HOSCN),HOSCN会分离,中间产物OSCN-的主要抗菌机制是氧化包括酶在内的蛋白质分子巯基(SH),使之成为硫(氧)基衍生物,并进一步水解产生次磺酸。
LPO在牛乳酶系中热稳定性最大,LPO活力的残留可以用来检验牛乳巴氏杀菌的效果。Korhonen报道,LPO在低温巴氏杀菌(63℃、30 min或72℃、15 s)后仍有活力,但是经 80 ℃、2.5 s处理后失活[15]。另外,De Wit等报道 LPO完全失活需要78℃、15 s[16]。Marks等发现常规巴氏杀菌不能使牛乳中LPO失活,72℃、15 s巴氏杀菌后,接种铜绿假单胞菌、金黄色葡萄球菌、嗜热链球菌,激活LPS后可以增强原料乳的保存性,但是激活的LPS在80℃、15 s处理后对以上微生物无作用或只有些少许作用[17]。Wendie等综述报道经过72℃、15 s巴氏杀菌,LPO的活性为加热前的70%,在这种加热条件下,LPO仍保持其全部的生物活性,经过UHT处理后LPO没有活性[18]。纯化分离的LPO经70℃、15 min杀菌后,LPO依然是稳定的,而78 ℃、15 s时完全失活[19]。
Tayefi-Nasrabadi等研究得出,牛乳中LPO的活性在 67、69、71、73 ℃ 的 D 值分别为 116.27、31.05、9.78、6.77 min;牛乳中 LPO 的 Z 值为 4.7 ℃[20]。Lorenzena等指出牛乳中LPO的活性经过75℃、28 s加热后为原料乳的50% ~60%,同时发现原料乳的LPO 活性为(2 940 ±40)U/L,经过 35、45、55、65、75、85℃加热90 s后,活性分别为(2 550±50)、(2425±25)、(2375 ±75)、(1913 ±38)、(338 ±19)、<5U/L[21]。Dumitrascu 等得出牛乳中 LPO 在 70、71、72、73、75、77 ℃的 D 值分别为(89.52 ±10.69)、(42.88±3.38)、(22.97 ± 0.70)、(13.59 ± 1.02)、(3.58 ±0.14)、(0.77 ± 0.14)min,Z 值为(3.58 ± 0.004)℃[22]。LPO钝化温度的差异主要是由于牛乳样品中脂肪含量的差异引起[23],也可能是由于体系中酸度不同引起,原因是LPO在酸性条件下热稳定性下降[24]。有研究认为LPO的热稳定性与其结构高度有序相关,LPO中含有8个二硫键和钙离子[25],然而这一假设需要进一步验证。
3 热处理对免疫球蛋白生物活性的影响
3.1 免疫球蛋白的热稳定性
免疫球蛋白是牛初乳和常乳里最重要的免疫活性蛋白,牛乳中的免疫球蛋白主要有IgA(Immunoglobulin,IgA),IgG(Immunoglobulin,IgG),IgM(Immunoglobulin,IgM)。免疫球蛋白相对于其他乳清蛋白更易变性,因而免疫球蛋白热稳定性的相关研究较多。
Mainer等通过对比免疫球蛋白(IgA、IgG、IgM)经过62~81℃热处理后的热变性情况,指出IgG最耐热,IgM是最不耐热;低温长时杀菌(63℃、30 min)IgM将变性30%,而对IgA和IgG不会产生影响;高温短时杀菌(75℃、15 s)后IgG仅变性1%,IgA变性2%,IgM 变性14%[26]。Ustunol等发现经过80℃、25 min处理后IgA对乳酸乳球菌的结合能力完全失活;85℃、20 min热处理后IgM完全失活;IgG在85℃、30 min处理后完全失活[27]。Jelena等通过实验结果得出牛乳中免疫球蛋白受加热强度的变化,结果见表1 所示[28]。

表1 牛乳中不同免疫球蛋白浓度随加热强度的变化Table 1 Changes in concentration of immunoglobulin in milk according to heat intensity
此外,Dominguez等曾证实IgG能够结合抗原,从而发挥免疫作用,同时发现经过60~65℃、30 min的热处理后,IgG的活性未发生显著变化;在69、72、77、81℃加热时,IgG 的 D 值分别为8 504、1 387、285、52 s;Z 值为 6.6 ℃,活化能为 386.83KJ/mol[29]。
3.2 不同乳体系中免疫球蛋白的热稳定性
Chen等提出在75~100℃加热时,牛初乳中的IgG比乳清和磷酸盐缓冲液(phosphate buffered saline,PBS)中的IgG更加稳定,经过75℃、5 min的热处理后PBS缓冲液中的IgG活性降低了40%;经过95℃、15 s的处理后活性降低100%,而乳清和牛初乳中的IgG分别残留42%和59%。同时,该研究也发现添加一定浓度的果糖、麦芽糖、糖醇(山梨糖醇、麦芽糖醇)、氨基酸(半胱氨酸、谷氨酸、甘氨酸、天门冬氨酸)可以增加IgG的热稳定性[30]。
Li-Chan等[31]将IgG溶解在PBS溶液、煮沸过的牛乳和超高温灭菌乳中,加热温度设定为从62.7℃到80℃,发现IgG经过62.7℃、30 min的处理后活性没有变化,在72~80℃内,PBS溶液、煮沸过的牛乳和 UHT乳中 IgG 的 Z值分别为 6.7,8.9和 8.5℃,活化能分别为 353.3、258.3、298.5 kJ/mol。商业巴氏杀菌过程不会导致IgG完全破坏,同时也发现在商业加工的产品中,IgG具有结合细菌脂多糖的特异性抗体活性,在HTST巴氏杀菌乳、复原脱脂奶粉和源自切达干酪的乳清中都表现出很高的IgG水平,而罐装炼乳、UHT乳中很少或根本没有抗体活性。
3.3 热诱免疫球蛋白结构的变化
Calmettes等提出,IgG活性损失的原因为其分子经过加热后发生构象变化,牛初乳IgG活性含量的降低可能是由于热处理后IgG分子变形或展开而引起的[32]。相对于Fc片段,IgG的 Fab片段中的CH区域相对热稳定性差,容易展开,使Fab段结构发生变化,IgG失去免疫活性。免疫球蛋白的热变性过程是一个展开又聚合的复杂过程。在低温下,三级结构可能发生展开,但某些展开的区域可能发生可逆。不同的热处理条件对蛋白质变性过程中肽链的展开及蛋白质的凝聚反应的强度不同[33-34]。Li等提出在硼酸盐的中性缓冲液中,IgG改变二级结构的温度为72℃;当牛乳IgG在82℃加热120 s后,IgG二级结构中的β-折叠转变为无规则卷曲,同时IgG的免疫活性发生降低[35]。
4 热处理对乳中激素、生长因子和细胞活素类成分的影响
4.1 乳体系中的激素、生长因子和细胞活素类成分
乳中的激素和生长因子,有些是完整或经过糖基化和磷酸化等修饰从血液转入乳中的;有些是在乳腺或乳中经蛋白水解作用形成的;也被认为是在内分泌器官(乳腺)内合成并转入乳中的。牛乳中细胞活素类物质与乳牛的感染情况密切相关。目前,已报道乳中含有40多种激素、生长因子和细胞活素类物质,例如白细胞介素(interleukin,IL),IL-1β,IL-2,IL-4,IL-5,IL-6,IL-10,IL-13,IL-16;γ-干扰素;生长因子,表皮生长因子(epidermal growth factor,EGF),胰岛素生长因子(insulin-like growth factor,IGF),粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF),人巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF),转化生长因子 (transforming growth factor,TGF)和趋化因子,单核细胞趋化蛋白(monocyte chemotactic protein-1,MCP-1),巨噬细胞炎性蛋白(macrophage inflammatory protein-1,MIP-1),受激活调节正常T细胞表达和分泌因子(regulatedupon activation normal T cell expressedand secreted factor,RANTES)和嗜酸细胞活化趋化因子(eotaxin)。
4.2 激素、生长因子和细胞活素类成分的热稳定性
4.2.1 加热对胰岛素生长因子-I(IGF-I)活性的影响
热处理可以激活生长因子,Pia等发现,经过65℃和72℃加热15 s的牛乳中IGF-I的浓度较原料乳高,当原料乳经过90℃、15 s的热处理后,IGF-I的水平发生急剧增加,而经过135℃、15 s加热后,IGF-I活性发生降低[36],指出90℃加热可以激活 IGF-I。Kang等研究发现,在原料乳中添加冻干的初乳乳清粉能够增加IGF-I的水平,经过75℃和85℃加热15 min后,其浓度发生降低,分别为加热前的45.0%和45.2%[37];经过121 ℃、15 min 的热处理后牛乳中没有检测出IGF-I活性。
Zhen等从牛初乳中分离出IGF-1,样品冻干后测定牛乳类胰岛素生长因子-I(IGF-I)在2个模型系统(PBS缓冲液和UHT乳)中的热变性动力学和热力学参数。结果表明,在选定的加热温度(65、72、80、90℃)下,IGF-I在UHT乳中的热变性D值均高于在PBS缓冲液中的D值;在PBS缓冲液和UHT乳中的热变性Z值分别为24.41℃和27.12℃;且牛乳IGFI的热变性反应级数为1.1级。同时对IGF-I在两个系统中的活化能、吉布斯自由能变、焓变和熵变进行了比较。结果显示,牛乳IGF-I在UHT乳中有更强的热稳定性,同时IGF-I较乳清蛋白中的β-乳球蛋白、α-乳白蛋白、乳铁蛋白、IgG、IgA的热稳定性要强[38]。
4.2.2 加热对转移生长因子 β2(TGF-β2)活性的影响
在有关TGF-β2的研究中,Rogers等发现,巴氏杀菌乳和干酪加工获得的乳清中TGF-β2的含量分别为 4.3ng/mL 和 3.7ng/mL[39];Abderrazak 等将含有TGF-β2牛乳在57~84℃加热2 min,发现加热温度达到66℃时,在乳清蛋白中的TGF-β2含量开始降低,加热温度达到76℃时,检测不出TGF-β2的存在[40]。Ollikainen 发现,90 ℃、15 s的热处理可以激活转化生长因子 TGF-β2,同时指出尽管未激活的TGF-β2存在于乳清片段中,而激活的TGF-β2却存在于酪蛋白中[41]。
4.3 热诱生长因子分子结构的变化
加热导致的生长因子活性变化与其分子结构相关,分子具有很强的疏水性,这有利于自身聚合和与其他蛋白质的非特异性相互作用。已有研究表明,TGF-β2在Cys-77位有1个游离的巯基[42],游离巯基可使其与β-乳球蛋白、α-乳白蛋白、酪蛋白胶粒和脂肪球膜等成分发生反应,从而使其分布在脂肪球表面、酪蛋白胶束和牛乳乳清相中[43]。Sylvie等指出,生长因子多数与牛乳中高分子质量的大蛋白结合,并且以潜在的形式存在,乳中的生长因子能够耐受巴氏杀菌的加热强度;二硫键还原剂可以钝化一些生长因子,如TGF-β2;此外,研究也指出由于IGF-I中有3个二硫键,而TGF-2中含有9个二硫键,所以 TGF-β2耐热性更强[44]。
5 热处理对乳中溶菌酶的影响
原料乳中的溶菌酶浓度为0~2 mg/L,平均浓度为 0.60 mg/L[45]。Abd 提出,牛乳中溶菌酶的浓度为(1.67 ±0.65)μg/mL,经过 65 ℃、30 min 的加热处理后,溶菌酶的浓度降低为(0.71 ±0.22)μg/mL;经过75 ℃、15 s的处理后浓度为(1.60±0.64)μg/mL;与未加热样品相比,经过85℃、1 s的处理后,溶菌酶的浓度增加23.87%,提出高温短时间杀菌可以激活溶菌酶的活性,而低温长时杀菌会降低该酶的活性[46]。Fox等指出溶菌酶具有一定的热稳定性,经过75℃、15 min和80℃、15 s的加热后其活性为加热前的75%[47]。此外,Jelena等研究了牛乳中溶菌酶浓度随加热强度的变化,结果如表2所示[28]。

表2 牛乳中溶菌酶浓度随加热强度的变化Table 2 Changes in concentration of lysozyme in milk according to heat intensity
6 结论
目前,有关牛乳中生物活性成分的种类及各种生物活性成分的功能方面的研究较为全面,总体上已经明确了不同生物活性成分的具体生物功能。然而有关不同体系(牛乳体系、初乳粉、分离纯化的样品、PBS缓冲液、乳模拟体系)中各种生物活性成分的测定方法存在不同,又由于不同体系中生物活性成分的含量、浓度和活性均较低,不同研究所报告的结果不可避免的存在一定差异。同时,加热过程中活性成分变化的分析与讨论主要集中于活性的比较层面上,也有针对加热过程中生物活性成分保护剂(集中于免疫球蛋白)的相关报道。然而,基于热处理过程中生物活性成分变性或者活性降低的同时,生物功能变化方面的研究相对较少,研究主要集中在活性降低(热失活)或者升高(热激活)比例的层次上,而针对加热导致的乳中活性成分的构效关系的相关研究甚少,主要体现在乳铁蛋白、免疫球蛋白、乳过氧化物酶、生长因子(IGF-1和TGF-β2)等成分在加热过程中会通过二硫键或者是非共价键聚合进行研究,但是缺乏对这些化学键及二级结构域的变化与生物活性成分活性降低、变性与复性程度、生物功能的关联研究,这方面有待于进一步探讨。
[1] Shah N P.Effects of milk-derived bioactives:an overview[J].British Journal of Nutrition,2000,84(Suppl 1):S3-S10.
[2] Cheng J B,Wang J Q,Bu D P.Factors affecting the laetoferrin concentration in bovine milk[J].Joumal of Dairy Science,2008,91(3):970-977.
[3] Steijns J M,Van Hooijdonk A.Occurence,structure,biochemical properties and technological characteristics of lactoferrin[J].British Journal of Nutrition,2000,84:11-17.
[4] Valenti P,Antonini G.Lactoferrin:an important host defence against microbial and viral attack[J].Cellular and Molecular Life Sciences,2005,62:2 576-2 587.
[5] Actor J K,Hwang S A,Kruzel M L.Lactoferrin as a natural immune modulator[J].Current Pharmaceutical Design,2009,15(17):1 956-1 973.
[6] Ruegg M,Moor U,Blanc B.A calorimetric study of the thermal denaturation of whey proteins in simulated milk ultrafiltrate[J].Journal of Dairy Research,1977,44(3):509-520.
[7] Abe H,Saito H,Miyakawa H.Heat stability of bovine lactoferrin at acidic pH[J].Journal of Dairy Science,1991,74(1):65-71.
[8] Sreedhara A,Flengsrud R,Prakash V,et al.A comparison of effects of pH on the thermal stability and conformation of caprine and bovine lactoferrin[J].International Dairy Journal,2010,20(7):487-494.
[9] Paulsson M A,Svensson U,Kishore A R.Thermal behavior of bovine lactoferrin in water and its relation to bacterial interaction and antibacterial activity[J].Journal of Dairy Science,1993,76(12):3 711-3 720.
[10] Oria R,Ismail M,Sanchez L.Effect of heat treatment and other milk proteins on the interaction of lactoferrin with monocytes[J].Journal of Dairy Research,1993,60(3):363-369.
[11] Dupont D,Arnould C,Rolet-Repecaud O,et al.Determination of bovine lactoferrin concentrations in cheese with specific monoclonal antibodies[J].International Dairy Journal,2006,16(9):1 081-1 087.
[12] Sanchez L,Peiro J M,Castillo H.Kinetic parameters for denaturation of bovine milk lactoferrin[J].Journal of Food Science,1992,57(4):873-879.
[13] Indyk H E.,McGrail I J,Watene G A,et al.Optical biosensor analysis of the heat denaturation of bovine lactoferrin[J].Food Chemistry,2007,101:838-844.
[14] Guillaume B,Michel B,Yves P.Heat-induced aggregation of bovine lactoferrin at neutral pH:Effect of iron saturation[J].International Dairy Journal,2007,17:617-624.
[15] Korhonen H.A new method for preserving raw milk-The lactoperoxidase antibacterial system[J].World Animal Review,1980,35:23-29.
[16] De Wit J N,van Hooydonk A C M.Structure,functions and applications of lactoperoxidase in natural antimicrobial systems[J].Netherlands Milk and Dairy Journal,1996,50:227-244.
[17] Marks N E,Grandison A S,Lweis M J.Challenge testing of the lactoperoxidase system in pasteurised milk[J].Journal of Applied Microbiology,2001,91:735-741.
[18] Wendie L C,Sabine C,Georges D,et al.Raw or heated cow milk consumption:Review of risks and benefits[J].Food Control,2013,31:251-262.
[19] Paul K G,Ohlsson P I.The chemical structure of lactoperoxidase.In Pruitt K M,Tenovuo J O(Eds),The lactoperoxidase system:Chemistry and biological significance[M].New York:Marcel Dekker.1985:15-29.
[20] Tayefi-Nasrabadi H,Hoseinpour-fayzi M A,Maryam M.Effect of heat treatment on lactoperoxidase activity in camel milk:a comparison with bovine lactoperoxidase[J].Small Ruminant Research,2011,99:187-190.
[21] Lorenzena P C,Martina D,Clawin-Radecker I,et al.Activities of alkaline phosphatase,glutamyltransferase and lactoperoxidase in cow,sheep and goatilk in relation to heat treatment[J].Small Ruminant Research,2010,89:18-23.
[22] Dumitrascu L,Stanciuc N,Stanciu S,et al.Thermal inactivation of lactoperoxidase in goat,sheep and bovine milk-A comparative kinetic and thermodynamic study[J].Journal of Food Engineering,2012,113:47-52.
[23] Claeys W L,Ludikhuyze L R,van Loey A M,et al.Inactivation kinetics of alkaline phosphatase and lactoperoxidase,and denaturation kinetics of beta-lactoglobulin in raw milk under isothermal and dynamic temperature conditions[J].Journal of Dairy Research,2001,68(1):95-107.
[24] Van Hooijdonk A C M,Kussendrager K D,Setijins,J M.In vivo antimicrobial and antiviral activity of components in bovine milk and colostrums involved in non-specific defence[J].Brithish Journal of Nutrition,2000,84(Suppl.1):S127-S134.
[25] Kussendrager K D,van Hooijdonk A C M.Lactoperoxidase:physicochemical properties,occurrence,mechanism of action and applications[J].Brithish Journal of Nutrition,2000,84(1),519-525.
[26] Mainer G,Sanchez L,Ena J M,et al.Kinetic and thermodynamic parameters for heat denaturation of bovine milk IgG,IgA and IgM[J].Journal of Food Science,1997,62(5):1 034-1 038.
[27] Ustunol Z,Sypien C.Heat stability of bovine milk immunoglobulins and their ability to bind lactococci as determined by an ELISA[J].Journal of Food Science,1997,62(6):1 218-1 222.
[28] Jelena Z,Inga C.The influence of heat treatment on antimicrobial proteins in milk[J].World Academy of Science,Engineering and Technology,2012,64:832-836.
[29] Dominguez E,Perez M D,Calvo M.Effect of heat treatment on the antigen-binding activity of anti-peroxidase immunoglobulins in bovine colostrum[J].Journal of Dairy Science,1997,80(12):3 182-3 187.
[30] Chen C C,Chang H M.Effect of thermal protectants on the stability of bovine milk immunoglobulin[J].Journal of Agricultural and Food Chemistry,1998,46(9):3 570-3 576.
[31] Li-Chan E,Kummer A,Losso J N,et al.Stability of bovine immunoglobulins to thermal treatment and processing[J].Food Research International,1995,28(1):9-16.
[32] Calmettes P,Cser L,Rajnavolgyi E.Temperature and pH dependence of immunoglobulin G conformation[J].Archives of Biochemistry and Biophysics,1991,291(2):277-283.
[33] Arnoldus W P V,Willem N.The Thermal stability of immunoglobulin:unfolding and aggregation of a multi-domain protein[J].Biophysical Journal,2000,78(1):394-404.
[34] Elizondo-Salazar J A,Jayarao B M,Heinrichs A J.Effect of heat treatment of bovine colostrum on bacterial counts,viscosity,and Immunoglobulin G concentration[J].Journal of Dairy Science,2010,93(3):961-967.
[35] LI S Q,Bomser J A,ZHANG Q H.Effects of pulsed electric fields and heat treatment on stability and secondary structure of bovine immunoglobulin G[J].Journal of Agricultural and Food Chemistry,2005,53(3):663-670.
[36] Pia O,Anne-Maria R.Effects of heat-treatment on insulin-like growth factor-1 in bovine milk[J].International Dairy Journal,2012,23:73-78.
[37] Kang S H,Kim J U,Imm J Y,et al.The effects of dairy processes and storage on Insulin-like Growth Factor-I(IGF-1)in milk and in model IGF-1 fortified dairy products[J].Journal of Dairy Science,2006,89:402-409.
[38] ZHEN Y Y,HE P,ZHANG X Z,et al.Kinetic and thermodynamic studies on the thermal denaturation of bovine milk insulin-like growth factor-I in model systems[J].Lait,2007,87:139-148.
[39] Rogers M L,Goddard C,Regester G O,et al.A.Transforming growth factor-β in bovine milk:Concentration stability and molecular mass forms[J].The Journal of Endocrinology,1996,151:77-86.
[40] Abderrazak A,Adil R,Maxime S,et al.Effect of heating on the distribution of transforming growth factor-β2 in bovine milk[J].Food Research International,2011,44:28-32.
[41] Ollikainen P.Activation of transforming growth factor-β2 in bovine milk during indirect heat treatments[J].International Dairy Journal,2011,21:921-925.
[42] Daopin S,Piez K A,Ogawa Y,et al.Crystal structure of transforming growth factor-β2:An unusual fold of the superfamily[J].Science,1992,57(5 068):369-373.
[43] Abderrazak A,Adil R,Maxime S E L,et al.Effect of heating on the distribution of transforming growth factorβ2 in bovine milk[J].Food Research International,2011,44:28-32.
[44] Sylvie F G,Yves P,Jean-Louis M.Growth factors from bovine milk and colostrum:composition,extraction and biological activities[J].Lait,2006,86:99-125.
[45] Walstra P,Geurts T J,Noomen A,et al.Principles of milk properties and processing in dairy technology[M].New York:Basel Marcel Dekker.1999:709-727.
[46] Abd El-Aziz M.Study on lysozyme level,distribution and effect of heat treatment in buffalo and cow milk[J].Journal Annals of Agricultural Science(Cairo),2006,51(2):439-446.
[47] Fox P F,Kelly A L.Review:indigenous enzymes in milk:overview and historical aspects-part 1 & 2[J].International Dairy Journal,2006,16:500-532.

