异色瓢虫HSP67B2 基因的克隆及诱导表达分析
邬梦静,沈祺达,施佐堃,王世贵,唐 斌
(杭州师范大学动物适应与进化重点实验室,杭州 310036)
热激蛋白(Heat Shock Protein,HSP)又称热休克蛋白或应激蛋白(Heat Stress Protein)(王建义和慈忠玲,2008)。1962年Ritassa 首次在从果蝇中发现(Ritassa,1964),1974年Tissieres 证实这组蛋白质并将其命名为 HSP(Tisseres and Mitchell)。相关研究表明,昆虫体内热激蛋白的表达量越高,其耐热性就越强(Le et al.,2001;Murphy et al.,2003)。热激蛋白不仅在热刺激时大量表达,在其它环境胁迫下如低温、高渗透压及重金属等因素也能大量表达(孙旭彤等,2002)。按照其相对分子量、结构和功能,可以分为以下几大类:HSP40、HSP60、HSP70、HSP90、HSPl00 和低分子量家族(陈莉,2012)。小分子热激蛋白(sHSP)家族的分子质量在15-30 kD 之间,是广泛存在于原核生物和真核生物体内的一类分子伴侣(王瑞娴等,2010),能在外界胁迫时大量表达,帮助抵抗逆境。
异色瓢虫Harmonia axyridis Pallas,属鞘翅目Coleoptera,多食亚目 Polyphage,瓢虫科Coccinellidae,肩突瓢虫族Synonychini,和瓢虫属Harmonia(姜文虎,2007)。异色瓢虫在俄罗斯阿尔泰山脉以东的广大地区及萨哈林岛、库页岛、中国、蒙古、朝鲜、日本等地均有分布,又称为亚洲瓢虫(杜波,2007)。作为一种重要捕食性昆虫资源,异色瓢虫是许多害虫的天敌,主要对蚜虫、蚧壳虫、粉蚧、木虱、螨类以及某些鳞翅目、鞘翅目害虫的卵和低龄幼虫具有控制作用,特别是对蚜虫的生物防治效果较好(Korch,2003)。同时,异色瓢虫作为瓢虫科中比较常见的种类,具有食量高,产卵量大,抗逆性强等特点(申智慧,2011),因而其在生物防治方面具有良好的应用前景,并且可有效减少农药对环境和生物的危害。我国是农业大国,富含异色瓢虫资源,在异色瓢虫的开发利用方面具有明显的优势和较大的空间。目前国内外对异色瓢虫HSP 的抗逆性研究较少,且多针对于模式生物,其作用机理也要用进一步探讨。既然异色瓢虫适应能力强、扩散能力光,能适应不同的恶劣条件,本研究探索HSP67B2 在抗逆中的表达模式。
1 材料与方法
1.1 试验虫源和实验种群的饲养
在25±1℃,湿度为70±5%条件下建立异色瓢虫试验种群。具体饲养方法为:将异色瓢虫成虫放入方形塑料养虫盒(15 cm×12 cm×7 cm)中,每盒20 头-30 头,每天饲喂1 次蚕豆蚜Aphis medicaginis,虫盒以纱布封盖。在养虫盒中放入有褶皱的纸条,作为瓢虫的产卵基质。待雌虫产卵后,将卵移至养虫笼(铝合金+60 目纱网,45 cm×30 cm×30 cm)中继续饲养,每日提供足量蚜虫作为食物繁殖3 代后,取异色瓢虫进行试验。
1.2 仪器与试剂
1.2.1 主要仪器与设备
试验中主要用到的具体仪器和设备包括,常规冰箱(西门子KK25V61TI)、-80℃冰箱(艾本德U410-86)、恒温水浴锅(上海精宏DK-8D)、高压蒸汽灭菌锅(Hiclave HVE-50)、台式高速离心机(Sigma 1-14)、台式低温离心机(艾本德)、实时荧光定量PCR 仪(BioRAD CFX96)、无菌超净工作台(ESCO)、电子分析天平(梅特勒-托利多AL204)、移液器(艾本德)和微量测定分光光度计(NanoDropTM2000)。
1.2.2 主要试剂与药品
DNA Marker DL2000、6×Loading buffer、cDNA 一链反转录试剂盒、T 载体等购自大连Takara 公司;提取总RNA 用Trizol 试剂盒购自美国Invitrogen 公司;PCR 引物由上海Invitrogen 公司合成;3'和5'RACE 试剂购自Clonetech;胶回收试剂盒购自天根生化科技有限公司产品;实时荧光定量PCR 试剂盒购自美国Bio-RAD 公司;氯仿、异丙醇、无水乙醇、EDTA 等常规试剂均购自Sigmma 公司。
1.3 试验方法
1.3.1 RNA 抽提及一链cDNA 合成
采用Trizol 法抽提(Chomczynski and Sacchi,1987)异色瓢虫脂肪体的总RNA 后,用琼脂糖凝胶电泳测定RNA 的纯度并利用微量核酸测定仪定量RNA 的浓度。取1μg 总RNA 作为模板,利用AMV 反转录试剂盒合成一链cDNA。
1.3.2 3' 与5' cDNA 末端快速扩增(Rapid amplified of cDNA end,RACE)
本实验室曾将一批异色瓢虫材料送至深圳华大基因科技有限公司进行转录组测序,得到测序结果后将序列翻译成蛋白序列,在NCBI 库中进行比对,发现有一条序列为异色瓢虫的HSP67B2 基因的中间片段。采用 SMART RACE cDNA amplification kit 建立异色瓢虫脂肪体组织的3'与5'RACE 文库。根据1.2.2 获得的中间序列,分别设计两对特异性引物(见表1),并进行PCR。具体PCR 条件为:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,共30个循环,72℃充分延伸5 min。反应结束,取5μL PCR 产物在1.2% 琼脂糖凝胶上电泳。当检测到目的条带后,进行回收纯化,然后连接到T 载体中,进行验证后,送上海英骏公司测序部测序。
1.3.3 不同龄期异色瓢虫HSP67B2 基因的表达
采用荧光定量PCR(Real-time fluorescent quantitative PCR,QRT-PCR)法测定,取异色瓢虫不同龄期幼虫及成虫(蜕皮或羽化2 h 后)为试验对象,采用相对QRT-PCR 法测定HSP 基因相对表达量。根据异色瓢虫HSP 67B2 基因保守区域设计引物探针(见表1),并根据异色瓢虫18S基因设计内参引物与探针(见表1)。提取异色瓢虫不同龄期虫体总RNA(方法同上),每个龄期重复3 头并且重复3 次,用凝胶电泳和紫外分光光度计测定RNA 纯度和浓度,取1μg 总RNA 量为进行一链cDNA 反转录。取反转录产物1μL 用于荧光定量PCR,每个处理重复3 次。QRT-PCR 按照Real-Max(probe)试剂盒体系进行荧光定量PCR,具体PCR 程序为94℃预变性5 min,94℃变性15 s,60℃退火30 s,68℃延伸30 s,40个循环,在68℃收集荧光信号,采用2-ΔΔT法进行数据分析。
1.3.4 不同温度条件下异色瓢虫HSP67B2 基因的表达
不同温度分别处理:在人工智能培养箱(Sanyo,MLR-361H,日本)中,对其分别进行-5℃、0℃、5℃、10℃、15℃处理1 h。升温处理:设定人工智能培养箱温度为-5℃、0℃、5℃、10℃、15℃、25℃梯度,首先将异色瓢虫置于-5℃保持1 h,之后转入0℃保持1 h,依次将异色瓢虫转移至5℃、10℃、15℃、25℃。上述实验进行三次重复,每个处理重复5-10 头。分别将上述各处理的异色瓢虫进行液氮研磨,抽提RNA,并参照1.3.3 的方法进行QRT-PCR,测定异色瓢虫HSP67B2 基因的相对表达量。
1.3.5 不同饥饿时间下异色瓢虫HSP67B2 基因的表达
在人工智能培养箱中,对其进行饥饿处理,分别取0 h,4 h,8 h,12 h,18 h,24 h 的异色瓢虫,实验重复3 次,每个处理重复5-10 头,抽提RNA,并参照1.3.3 的方法进行QRT-PCR,测定HSP67B2 基因的相对表达量,定量结果用2-ΔΔT法进行数据分析
1.2 序列分析及数据分析
序列分析和系统分析分别采用 Dnastar、Vector、Compute pI/Mw 和ClustalW 等,在线分析网址:http:∥expasy.org/tools/#translate,NetNGlyc 1.0 Server:http:∥www.cbs.dtu.dk/services/NetNGlyc/;TMHMM Server v.2.0:http:∥www.cbs.dtu.dk/services/TMHMM-2.0/和 ClustalW:http:∥www.ebi.ac.uk/Tools/clustalw2/index.html,用 于在线分析昆虫HSP67B2 基因同源性。另外使用MEGA 5.05 软件,采用邻接法(neighbor-joining,NJ)构建进化树,Bootstrap 设定为1 000 次重复。其它数据分析均采用Statistica 6.0 进行分析。
2 结果与分析
2.1 异色瓢虫热激蛋白基因cDNA 全长的克隆及分析
3' 与5'RACE 比对拼接后得到了异色瓢虫HSP67B2 基因 cDNA 全长序列(序列登录号:KJ155728),并从两端设计引物,能够直接扩增出全长片段,测序后发现跟拼接序列一致。HSP67B2基因全长626 bp,其中翻译氨基酸数140个,3'非翻译区为81 bp,5'非翻译区为122 bp,等电点为6.61,预测蛋白分子量为15.97 KD(图1)。

图1 异色瓢虫HSP67B2 基因cDNA 序列Fig.1 The cDNA sequence of Harmonia Axyridis HSP67B2

表1 试验中所用的引物Table 1 Primers used in the experiments

图2 不同昆虫HSP67B2 基因蛋白序列比对结果与分析Fig.2 Alignment of the deduced amino acid sequences of HSP67B2 gene in insects
2.2 昆虫的HSP67B2 基因同源性和进化分析
目前,NCBI 上已经有多条关于昆虫的HSP67B2 基因报道,从中挑选了有代表性的物种:意大利蜜蜂 Apis florae、黑脉金斑蝶 Danaus plexippus、赤拟谷盗Tribolium castaneum、黑腹果蝇Drosophila melanogaster 和点蜂缘蝽Riptortus pedestris与异色瓢虫采用Multiple 进行比对分析结果发现,不同昆虫的HSP67B2 基因相差较大。
将已知昆虫的HSP67B2 基因的蛋白序列进行系统进化分析,结果表明异色瓢虫和赤拟谷盗虽然同属于鞘翅目,但是不聚在同一枝,这表明昆虫HSP67B2 基因可能具有多种类型,目前已有研究的是一种基因类型,本实验通过转录组得到另一种基因类型(图3)。
2.3 不同龄期异色瓢虫HSP67B2 基因相对表达量测定
异色瓢虫不同龄期HSP67B2 基因表达量存在差异。以幼虫一龄为对照,在不同龄期异色瓢虫HSP67B2 基因表达量普遍低于对照,其中幼虫期HSP67B2 基因的表达量相对较高,蛹期表达量最低,成虫期较蛹期升高,说明其在幼虫期需要储存更多的热激蛋白(图4)。
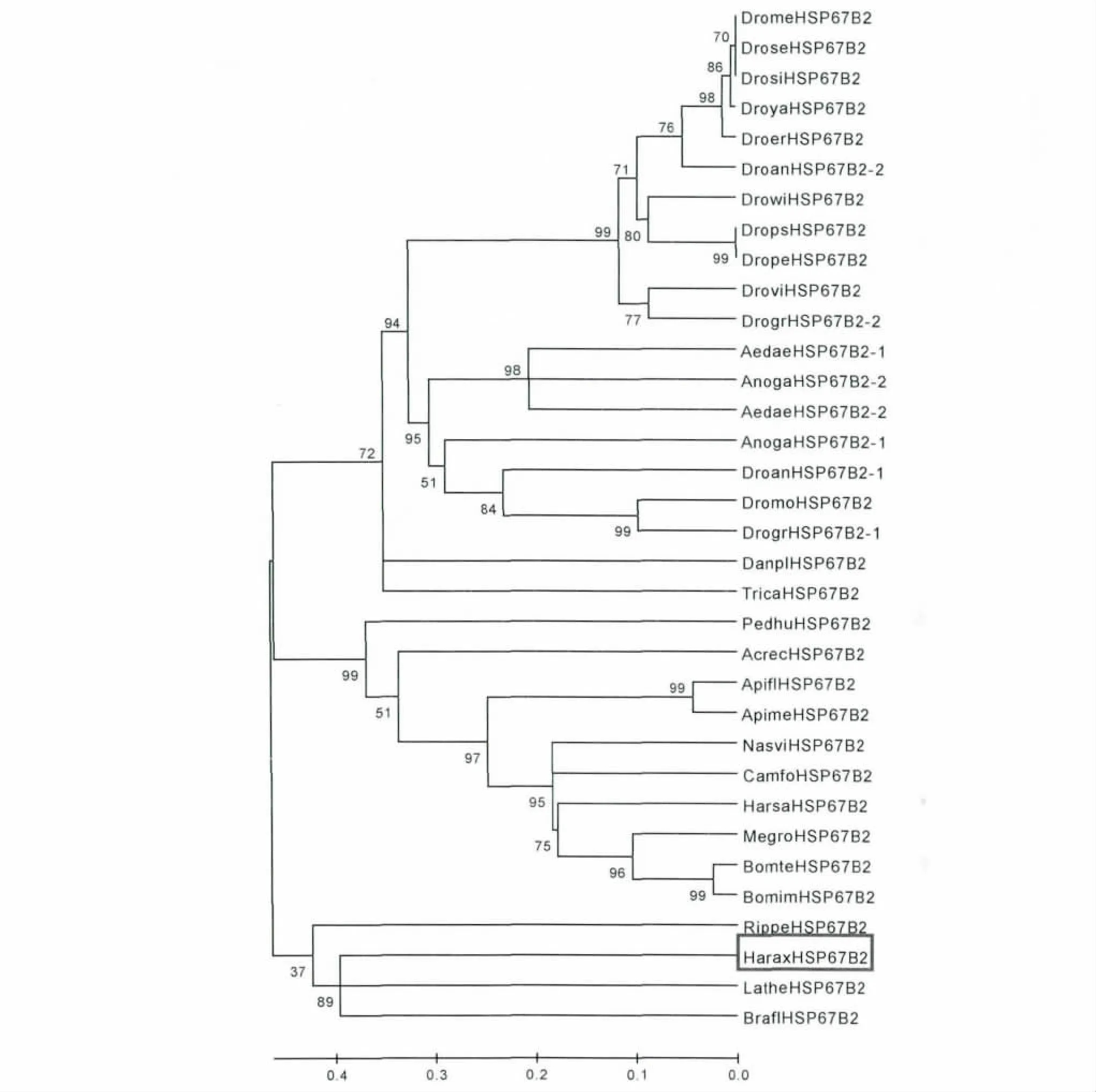
图3 异色瓢虫的HSP67B2 与相关蛋白的聚合进化分析Fig.3 Phylogenetic analysis of HaHSP67B2 and other related proteins
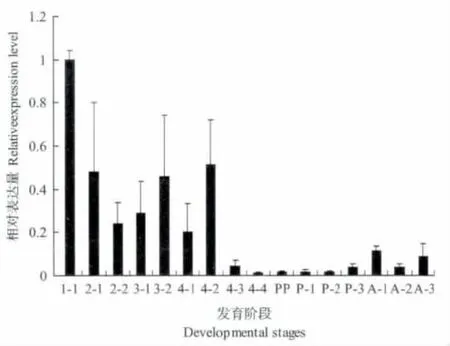
图4 不同龄期异色瓢虫HSP67B2 相对表达量Fig.4 The relative expression level of HaHSP67B2 in different instars
2.4 短时低温处理下异色瓢虫HSP67B2 基因相对表达量测定
取异色瓢虫成虫,分别置于-5℃,0℃,5℃,10℃,15℃(CK),25℃处理1 h 之后以15℃为对照,测定HSP67B2 基因的相对表达量。结果如图5 所示,低温处理下异色瓢虫HSP67B2基因的表达量普遍低于其在25℃时的水平,然而在10℃时量明显升高,与其他温度差异显著。
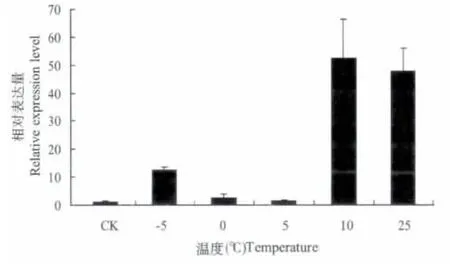
图5 不同温度分别下异色瓢虫HSP67B2 基因的表达水平Fig.5 The expression level of HaHSP67B2 gene under the the treatment of different temperature respectly
升温处理异色瓢虫,以-5℃为对照测定相对表达量发现,在经历瞬时低温冲击时,HSP67B2基因的表达量显著较高,之后HSP67B2 基因的表达量显著的下降,在5℃又显著上升。后随着温度的上升,其表达量逐渐上升(图6)。说明在前期的诱导下显著提高了HSP67B2 基因的表达,此时昆虫体内合成了较多的热激蛋白,可以满足其在一定时间内的生理需要,所以表达量低于正常水平,而随着时间的推进其表达量逐渐上升。
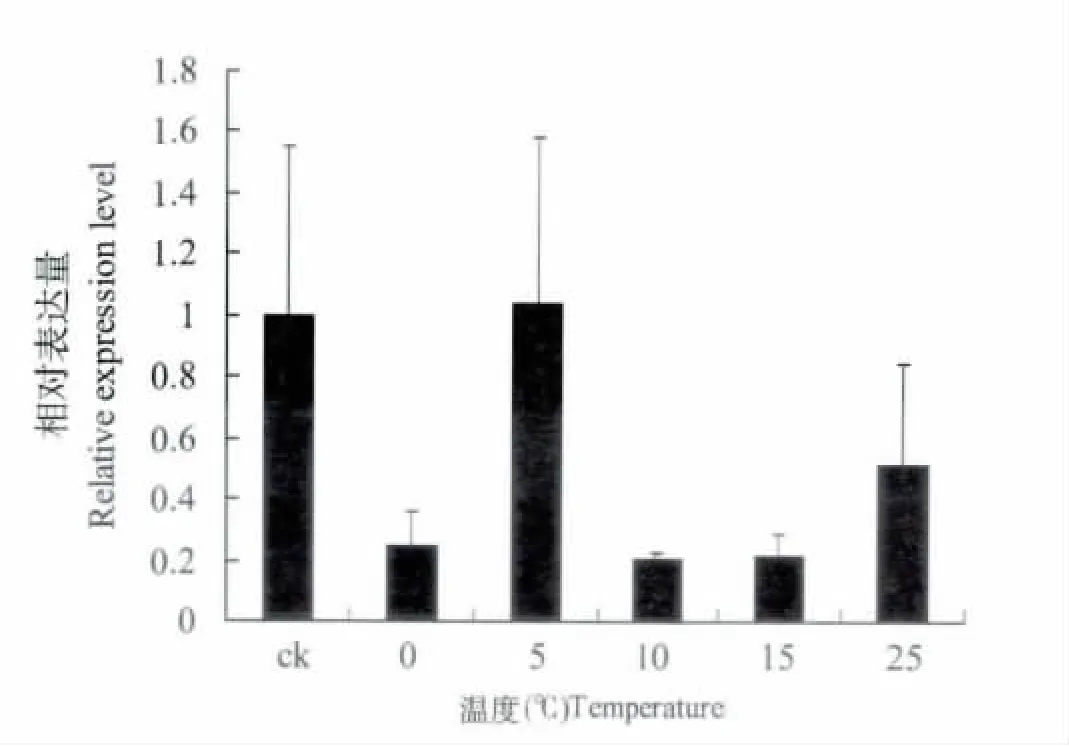
图6 升温处理下异色瓢虫HSP67B2 基因的表达水平Fig.6 The expression level of HaHSP67B2 gene under the treatment of decreasing temperature
2.5 饥饿处理下异色瓢虫HSP67B2 基因相对表达量测定
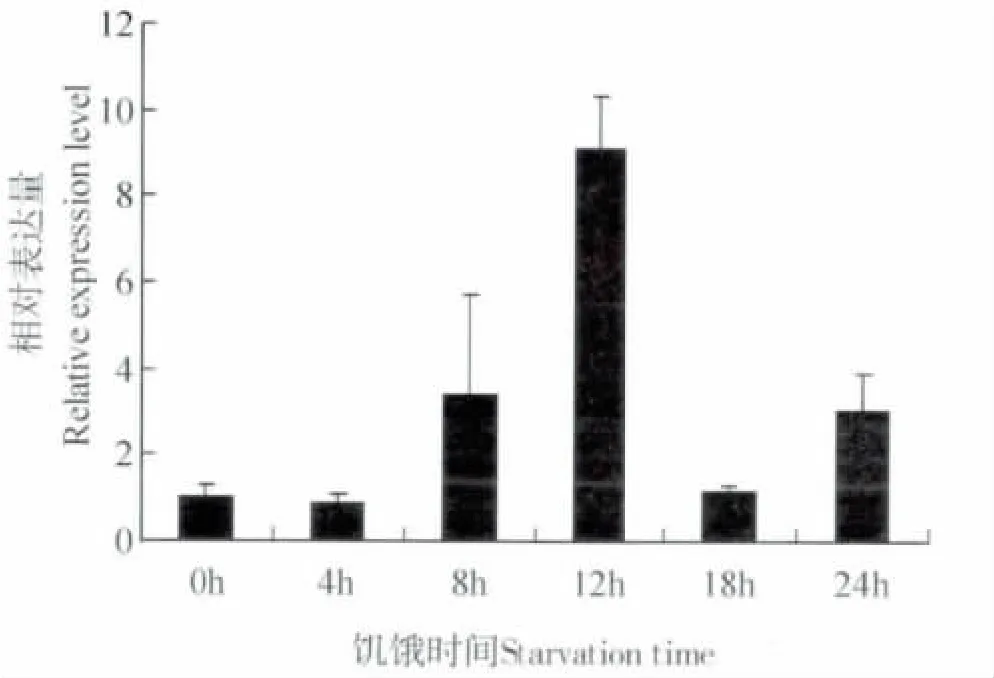
图7 饥饿处理下异色瓢虫HSP67B2 基因的表达水平Fig.7 The expression level of HaHSP67B2 gene under the the treatment of starvation
饥饿处理异色瓢虫,在0 h,4 h,8 h,12 h,18 h,24 h 分别取样后,以0 h 为对照测定饥饿处理下异色瓢虫HSP67B2 的相对表达量。结果表明,HSP67B2 表达量呈现上升后下降的趋势,在12 h前表达量逐渐上升,12 h 达到最大,18 h 显著下降,24 h 又略有上升(图7)。说明饥饿8 h 前异色瓢虫并未感到外界刺激,8 h 时其感受到强烈饥饿刺激,提高了HSP67B2 基因的表达,满足其生理需要。饥饿18 h 表达量较低,可能是12 h 表达合成的小分子热激蛋白足以满足其一段时间的生理需要,而随着时间的推进其表达量逐渐上升。
3 结论与讨论
自Ritossa 在果蝇中发现热休克蛋白以来,其研究已经有了较大的进展。研究表明,热激蛋白广泛存在于微生物和动植物体内,是一个蛋白质超家族,可以按照其相对分子量、结构和功能分为多类(陈莉,2012)。HSP 作为一类重要的分子伴侣,参与蛋白的折叠、降解以及细胞内物质的运输等过程,调节靶细胞的活性,却不参与靶蛋白的合成(黄惠芳和马飞,2004)。另有研究表明HSP 家族可以通过介入细胞凋亡信号通路从而影响细胞凋亡,其在细胞凋亡的过程中主要起着两种不同并且看似完全相反的作用:一,HSP 能抑制细胞凋亡,促进细胞的存活;二,HSP 作为某些关键凋亡蛋白的分子伴侣,促进细胞凋亡(武斌等,2011)。尽管HSP 序列保守,编码序列变异比较低,但近期已有研究表明,热激蛋白基因序列存在变异,而且此类变异可能与生物体对温度的适应性存在某些相关性(韩政等,2010)。小分子热激蛋白(sHSP)家族,分子质量在15-30 kD之间(王瑞娴等,2010),是一个非常多样的群体,不同的组织有着不同数目的sHSP,分子量也有相当大差异(李斌等,2004),甚至在同一种内,也能观察到相当多的多样性,并在序列上也有一定差异(Mansfield and Key,1987)。目前已发现了由5个不同的核基因亚家族编码20 多种sHSP,并且不同家族之间sHSP 的N 端有较大的分化(陈亚琼等,2006)。不同的sHSP 在昆虫滞育期间具有不同功能作用(Theodoros Gkouvitsas et al.,2008),并且在不同强度的刺激下也有不同的应激程度(Huang et al.,2009)。研究表明sHSP 的表达可能在某些激素的产生和热激调控系统中起到功能的联系作用,其对昆虫组织的再生和发育也具有一定作用(Huang et al.,2009)。部分热激蛋白能够单独发挥其功能,如蝶蛹金小蜂纯化的重组Pphsp20,在一定程度上能抑制高温引起的荧光素酶聚集,再次证明sHSP 能够阻止高温下蛋白质的聚集,同时也能帮助变性的荧光素酶复性(王欢等,2012)。
本次研究发现HSP67B2 在幼虫期间高表达,并且在四龄幼虫第二天时有一个高峰期。四龄幼虫时期是异色瓢虫生长的一个重要阶段,之所以会在此阶段出现高表达可能是幼虫即将蛹化导致。但是在其他昆虫中却出现在四龄幼虫期低表达的现象(Jiang et al.,2012;Li and Du,2013)。在饥饿刺激中,发现在饥饿8 h 时HSP67B2 相对表达量最高,饥饿刺激对昆虫而言是一个复杂的刺激因素,可包括能量和身体内稳态水盐平衡等(Benoit et al.,2009;Wang et al.,2012),而相关研究报道饥饿8 h 时,异色瓢虫的运动速度较快,停顿次数少且运动距离长(Tang et al.,2014),表明饥饿8 h 其需要寻找食物,导致体内产生热量,HSP67B2 基因在8 h 的高表达也正好验证了这一点(图5)。
热激蛋白的研究是当今细胞生物学、生物化学中一个重要研究领域,其中心问题是热激蛋白的生物学功能(孙旭彤等,2002)。研究证明昆虫中的小分子蛋白与植物中的存在明显进化差异,对热激蛋白等应激基因的进化、功能以及作用机制的研究能促进昆虫对不同环境的适应性的研究(Li et al.,2009),也可应用与药物开发、疾病免疫和环境监测等(王建义和慈忠玲,2008)。Staempfth 等研究认为,一些土壤污染物可以诱发昆虫体内产生热激蛋白,通过测定土壤昆虫的热激蛋白就可诊断该土壤的污染状况(Staempfli et al.,2002)。HSPS 是生物体中一种重要的应激物,在应对亚致死冷、热刺激,疾病,环境污染和饥饿等恶劣条件时都起重要作用(Feder et al.,1997),在其正常生命活动受到制约时能表达HSP 应对刺激(Colinet et al.,2010),通过研究热激蛋白和昆虫应对热刺激环境时的关系,在进一步研究昆虫适应环境温度变化上有重大意义。并且热激蛋白在异色瓢虫等天敌昆虫利用方面具有很大潜力,在天敌昆虫方面热激蛋白的研究将为天敌的保存和利用提供理论依据和基础,推动我国农业发展。
References)
Benoit JB,Lopez-Martinez G,Teets NM,et al.Responses of the bed bug,Cimex lectularius,to temperature extremes and dehydration:levels of tolerance,rapid cold hardening and expression of heat shock proteins[J].Med.Vet Entomol.,2009,23:418-425.
Chen L.Cloning and Expression Analysis of HSP90 Gene from the Chinese Oak Silkworm,Antheraea pemyi[D].Anhui:Anhui Agricultural University,2012.[陈莉.柞蚕热激蛋白90 基因的克隆与表达分析[D].安徽:安徽农业大学,2012]
Chen YQ,Xiao TJ,Zhou ZK.The relationship between heat shock proteins and biological adaptation and evolution[J].Progress in Natural Science,2006,16(9):1066-1072.[陈亚琼,肖调江,周浙昆.热激蛋白与生物环境适应及进化的关系[J].自然科学进展,2006,16(9):1066-1072]
Du B.The Application of PCR-SSCP in the Research of Entomology[D].Heilongjiang:Northeast Forestry University,2007.[杜波.帽儿山地区异色瓢虫种群的单链构象多态性(SSCP)分析[D].黑龙江:东北林业大学,2007]
Colinet H,Lee SF,Hoffmann A.Temporal expression of heat shock genes during cold stress and recovery from chill coma in adult Drosophila melanogaster[J].FEBS J.,2010,277,174-185.
Feder M E,Blair N,Figueras H.Natural thermal stress and heat-shock protein expression in Drosophila larvae and pupae[J].Funct.Ecol.,1997,11:90-100.
Han Z,Zhao LL,Chen G,et al.Research advances of the relationship between heat shock proteins and insects heat tolerance[J].Journal of Shanxi Agricultural Sciences,2010,38(8):92-94.[韩政,赵龙龙,陈光,等.热激蛋白与昆虫的耐热性关系研究进展[J].山西农业科学,2010,38(8):92-94]
Huang LH,Wang CZ,Kang L.Cloning and expression of five heat shock protein genes in relationto cold hardening and development in the leafminer,Liriomyza sativa[J].Journal of Insect Physiology,2009,55:279-285.
Jiang XF,Zhai HF,Wang L,et al.Cloning of the heat shock protein 90 and 70 genes from the beet armyworm,Spodoptera exigua,and expression characteristics in relation to thermal stress and development[J].Cell Stress and Chaperones,2012,17:67-80.
Jiang WH,Pan XH,Liu JX,et al.Studies on the type of spot in the wings of Harmonia axyridi(Pallas)in Baoding[J].Hebei Jouranl of Forestry and Orchard Research,2007,22(2):198-202.[姜文虎,潘秀华,刘军侠,等.保定市异色瓢虫色斑类型调查研究[J].河北林果研究,2007,22(2):198-202]
Koch RL.The multicolored Asian lady beetle,Harmonia axyridis:A review of its biology,uses in biologica control,and non-target Impacts[J].Insect Science,2003,3:1-16
Le BE,Valenti P,Lucchetta P,et al.Effects of mild heat shocks at young age on aging and longevity in Drosophila melanogaster[J].Biogerontology,2001,2:155-164.
Li B,Xia QY,Teng JB,et al.Phylogenesis and evolution of the small Heat Shock Proteins[J].Science of Sericulture,2004,30(3):260-265.[李斌,夏庆友,藤井博,等.低分子量热激蛋白的进化研究[J].蚕业科学,2004,30(3):260-265]
Li HB,Du YZ.Molecular cloning and characterization of an Hsp90/70 organizing protein gene from Frankliniella occidentalis(Insecta:Thysanoptera,Thripidae)[J].Gene,2013,520:148-155.
Li ZW,Li X,Yu QY,et al.The small heat shock protein(sHSP)genes in the silkworm,Bombyx mori,and comparative analysis with other insect sHSP genes[J].BMC Evolutionary Biology,2009,9:215.
Mansfield MA,Key JL.Synthesis of the low molecular weight heat shock proteins in plants[J].Plant Physiol.,1987,84:1007-1017.
Murphy CT,Mccarroll SA,Barmann CI,et al.Genes that act downstreasm of DAF216 to influence the lifespan of Caenorhabiditis elegans[J].Nature,2003,424:277-283.
Qi X,Qi Z,Zheng HZ,et al.Three heat shock proteins from Spodoptera exigua:Gene cloning,characterization and comparative stress response during heat and cold shocks[J].Comparative Biochemistry and Physiology,2011,159:92-102.
Ritassa FM.Experimental activation of specific puffloci in polytene chromosomes of Drosophila[J].Experimental Cell Research,1964,35:601-607.
Shen Z H,Yang H,Yuan R,et al.Investigation in mating behavior and post-copulatory guarding behavior of Harmonia axyridis Pallas[J].Journal of Mountain Agriculture and Biology,2011,30(1):27-31[申智慧,杨洪,袁瑞,等.异色瓢虫的交配及配后的保护行为研究[J].山地农业生物学报,2011,30(1):27-31]
Staempfli C,Becker-van Slooten K,Tarradellas.HSP70 instability and induction by a pesticide in Folsomia Candida[J].Biomarker J.,2002,7(1):68-79.
Sun XT,Zhang SZ,Liu ZH,et al.Review on heat shock proteins of marine organism[J].Marine Sciences,2002,26(6):24-27.[孙旭彤,张士璀,刘振辉,等.热激蛋白研究概况及其在海洋生物中的研究进展[J].海洋科学,2002,26(6):24-27]
Tang B,Qin Z,Shi ZK,et al.Trehalase in Harmonia axyridis(Coleoptera:Coccinellidae):effects on beetle locomotory activity and the correlation with trehalose metabolism under starvation conditions[J].Appl.Entomol.Zool.,2014.
Theodoros Gk,Dimitris K,Anna K.Differential expression of two small Hsps during diapause in the corn stalk borer Sesamia nonagrioides(Lef.)[J].Journal of Insect Physiology,2008,54:1503-1510.
Tisseres A,Mitchell AK.Some new proteins induced by temperature shock in Drosophila[J].J.Mol.Biol.,1974,84:389-398.
Wang H,Li K,Fang Q,et al.Prokaryotic expression and thermo-protective function of Heat Shock Proteins from Pteromalus puparum(Hymenoptera:Pteromalidae)[J].Acta Entomologica Sinica,2012,55(8):903-910.[王欢,李凯,方琦,等.蝶蛹金小蜂热激蛋白家族基因表达与热保护功能[J].昆虫学报,2012,55(8):903-910]
Wang H,Li K,Zhu JY,et al.Cloning and expression pattern of heat shock protein genes from the endoparasitoid wasp,Pteromalus puparum in response to environmental stresses[J].Archives of Insect Biochemistry and Physiology,2012,79:247-263.
Wang JY,Ci ZL.Advances in study of Heat Shock Protein[J].Shanxi Forestry Science and Techology,2008,1:28-32.[王建义,慈忠玲.热激蛋白的研究进展[J].山西林业科技,2008,1:28-32]
Wang RX,Gao RN,Zhang T,et al.An analysis on tissue expression activities of Bombyx mori small molecule Heat Shock Protein gene HSP19.9 induced by exogenous substances[J].Science of Sericulture,2010,36(5):780-784.[王瑞娴,高瑞娜,张婷,等.外源物质诱导家蚕小分子热激蛋白基因HSP19.9 的组织表达活性分析[J].蚕业科学,2010,36(5):780-784]
Wu B,Li ZY,Yang SC,et al.Regulation of apoptosis signaling pathway by common Heat Shock Proteins[J].Chinese Journal of Biochemistry and Molecular Biol.,2011,27(1):22-31.[武斌,李宗芸,杨素春,等.几种热激蛋白在细胞凋亡信号通路中的调控作用[J].中国生物化学与分子生物学报,2011,27(1):22-31]

