双孢菇深层发酵工艺优化的研究
刘晓鹏,姜 宁,马 琼,杨 洪,余丽琼,张 驰
(1.湖北民族学院生物科学与技术学院,湖北恩施445000;2.生物资源保护与利用湖北省重点实验室,湖北恩施445000)
双孢菇(Agaricus bisporus)属于真菌界、担子菌门、无隔担子菌纲、伞菌目、伞菌科、蘑菇属,又名口蘑、洋蘑菇、白蘑菇、圆蘑菇。双孢菇的野生资源分布于欧洲、北非、北美洲和澳大利亚等地[1]。
双孢菇营养价值高,含有丰富的蛋白质、氨基酸、维生素和矿物质,蛋白质含量可达40%,含有多种氨基酸,其中8种是人体必需氨基酸,赖氨酸和亮氨酸含量丰富,含有丰富的维生素[2-3]。双孢菇为药食同源的食用菌,味甘性平,具有降血压、提神消化的作用。常食用双孢菇,能预防坏血病、肿癌,促进伤口愈合,并对肝炎、肝硬化具有辅助疗效[4-8]。将双孢菇的多糖、活性肽、氨基酸等活性成分提取出来可开发为药物或保健品。
双孢菇菌盖表面没有保护结构,不能阻止外界的物理伤害、微生物侵染,加之双孢菇呼吸速率高及含水量多,使得双孢菇极易腐烂和褐变[9],不利于双孢菇生理活性物质的提取获得,而且子实体的人工栽培周期长,费工费时。利用液体深层培养菌丝体具有培养周期短、标准化操作、规模化生产等优点,通过液体发酵可以快速得到双孢菇的菌丝体和生理活性物质,毛勇等[10]研究了碳源、氮源、无机盐对双孢菇胞外多糖产量的影响,王敏等[11]研究了不同碳氮源对双孢菇深层发酵的影响,目前尚未见有系统研究双孢菇深层发酵工艺的报道。
本研究通过对双孢菇深层发酵工艺的优化,为大规模发酵双孢菇获取菌丝体和生理活性物质提供理论依据。
1 材料与方法
1.1 材料与仪器
菌种 由市售的新鲜双孢菇子实体中分离所得,经姜宁副教授鉴定为双孢菇(Agaricus bisporus)。培养基配方 固体斜面种子培养基:马铃薯20%,蔗糖2%,琼脂2%,pH自然。活化培养基:同斜面培养基。液体种子培养基:马铃薯20%,葡萄糖1%,麦芽糖 1% ,MgSO40.15% ,K2HPO40.1% ,pH7.0。
HZQ-F100全温振荡培养箱 大仓市实验设备厂;SPX-250B生化培养箱 上海新苗医疗器械制造有限公司;SW-CJ-2F洁净工作台 苏州苏洁净化设备有限公司;YXQ-LS-30SII立式压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;电热恒温干燥箱 上海福玛实验设备。
1.2 实验方法
1.2.1 工艺流程 菌种活化→液体种子→液体发酵→过滤发酵液,得菌丝体→清洗菌丝体→干燥→称菌丝干重
1.2.2 操作步骤 在无菌条件下,用接种铲从斜面菌种上切取1cm2的菌块接种至PDA斜面培养基上,26℃恒温培养6d,挑选菌丝洁白、粗壮、浓密、无污染的斜面作为供试菌种。按上述步骤将斜面种子接至液体种子培养基上,26℃恒温振荡培养6d。吸取一定量的液体种子接入发酵培养基,26℃、120r/min培养6d。将发酵醪用4层纱布过滤,并用蒸馏水进行反复冲洗,105℃烘2h,冷却后称重,再放入105℃中烘30min再称重。直至两次称重的重量差不超过2mg即为恒重。
1.2.3 液体培养基优化
1.2.3.1 单因素实验 以可溶性淀粉3%、黄豆粉3%(煮沸30min,4层纱布过滤取滤液,以下黄豆粉处理相同)、KH2PO40.05% 、MgSO40.05% 为基本培养基,调整碳源、氮源、无机盐和维生素进行单因素实验。如碳源单因素实验分别以葡萄糖、蔗糖、麦芽糖、乳糖、可溶性淀粉、玉米淀粉为碳源;氮源则分别以蛋白胨、酵母膏、麸皮、黄豆粉、尿素、(NH4)2SO4、NaNO3为氮源;无机盐单因素实验分别将 KCl、CaCl2、KH2PO4、K2HPO4、MgSO4、FeSO4作为无机盐;而维生素的因素实验分别将 VB1、VB2、VB6、VB1+VB2、VB1+VB6、VB2+VB6和 VB1+VB2+VB6作为生长因子。以获得培养双孢菇菌丝体最佳碳源、氮源、无机盐和维生素。
1.2.3.2 均匀设计实验 根据单因素实验结果选取最佳碳源、氮源、无机盐、生长因子,采用均匀设计表,每一因素取8水平。实验设计见表1。
1.2.4 发酵工艺参数的优化 在预实验的基础上,以接种量、发酵温度、转速为实验因子,以菌丝体干重作为指标,采用中心复合设计,各因子水平及编码表见表2。

表1 均匀设计实验因素及水平Table 1 Factors and levels of U8uniform design

表2 实验因素水平编码表Table 2 Factor and coded levels of experiment
1.3 数据分析
所有实验重复三次,单因素和均匀设计实验的数据用SPSS 16.0统计软件分析,组间多重比较用最小显著差异(Least Significant Difference,LSD)法;中心复合设计实验用Design Expert 8.0进行分析。
2 结果与分析
2.1 培养基优化实验结果
2.1.1 不同碳源对菌丝生长的影响 碳源浓度均为3%,碳源筛选实验的 F 值 =18.927 > F0.01(=4.456),说明不同碳源对菌丝体产量的作用差异是极显著的。LSD法进行多重比较,结果见表3。由表3可知可溶性淀粉作为碳源时,菌丝生长量最大,且和其它碳源作用的差异达极显著水平,麦芽糖、玉米淀粉、乳糖、蔗糖、甘露醇之间差异不显著。这是由于双孢菇为大型真菌,生长周期长,单糖、双糖代谢过快,不适应双孢菇的生长需要,而多糖类碳源需经菌体产生的胞外酶水解成单糖后再被利用,能提供长期营养,所以适合双孢菇的生长需要。
2.1.2 不同氮源对菌丝体生长的影响 氮源浓度均为 3%,对实验数据进行方差分析,F=119.037 > F0.01(=4.46),说明不同氮源对菌丝生长量有极显著差异影响。对数据进行多重比较(LSD法),由表4可以得出:双孢菇对有机氮的利用明显好于无机氮,其中蛋白胨的菌丝体干重明显高于其他氮源,而酵母膏、麸皮和黄豆粉之间差异不显著,(NH4)2SO4、NaNO3和尿素上的菌丝体几乎不长,之间的差异也不显著。说明双孢菇本身不能直接利用无机氮合成某些氨基酸,需从有机氮源中摄取[12]。
2.1.3 不同无机盐对菌丝体生长的影响 所有无机盐加入量均为0.05%,无机盐筛选实验结果的F=6.997 > F0.01(=5.064),表明不同的无机盐会对菌丝体生长量产生极显著影响。采用LSD法进行多重比较(表 5),可以看出:KCl、CaCl2、KH2PO4、K2HPO4对菌丝生物量的影响无显著差异,MgSO4与FeSO4、KCl之间存在显著差异,无机盐为FeSO4时菌丝体干重显著小于其他无机盐。下面实验中选用KCl。

表3 不同碳源对菌丝体干重影响差异显著性比较(LSD法)Table 3 Difference signification of carbon source effect on dry mycelia yield by LSD

表4 不同氮源对菌丝体干重影响差异显著性比较(LSD法)Table 4 Difference signification of nitrogen source effect on dry mycelia yield by LSD

表5 不同无机盐对菌丝体干重影响差异显著性比较(LSD法)Table 5 Difference signification of inorganic salt effect on dry mycelia yield by LSD

表6 不同维生素对菌丝体干重影响差异显著性比较(LSD法)Table 6 Difference signification of vitamin effect on dry mycelia yield by LSD
2.1.4 不同维生素对菌丝体生长的影响 维生素均加入10mg/100mL,计算实验结果的 F值 =6.031>F0.01(=4.46),即不同维生素对菌丝体生长影响差异达极显著水平,采用LSD法对数据进行多重比较(表6),得出VB1对菌丝体生长最有利,它与其他维生素之间作用差异达显著水平,其他维生素之间无显著差异。
2.1.5 均匀设计实验结果与分析 对均匀设计实验结果(表7)利用SPSS软件进行回归处理,得出如下回归方程
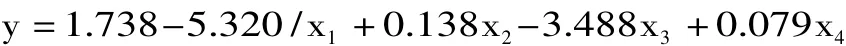
式中 y 表示菌丝体干重(g/100mL),x1、x2、x3、x4分别表示可溶性淀粉、蛋白胨、KCl、VB1的浓度。
R=0.995,R2=0.990,F=72.704 > F0.01(4,3)=28.71,P=0.003,说明建立的回归方程具有显著的线性关系。对各因素的偏回归系数进行t检验(表8),可以得知四个因素对菌丝体产量存在着显著影响,主次顺序为1/x1>x2>x4>x3。
根据回归方程:菌丝体产量与可溶性淀粉的含量倒数呈负相关,与蛋白胨、VB1的浓度呈正相关,与KCl浓度呈负相关,所以,可溶性淀粉的浓度取实验浓度的上限即4.6%,蛋白胨取上限4.6%,KCl取下限0.02%,VB1取上限 18mg/100mL,将上述数据代入方程中,得出理论菌丝体干重为2.561g/100mL。
双孢菇的菌丝体产量与1/x1成一定的比例关系,如设A=x2/x1(即氮碳比),上述线性方程可换算成:

这就直接证明了微生物生长量不仅与氮源、碳源含量有关,而且与它们的比值相关,在研究白灵菇深层发酵也发现了相同的规律[13]。
采用优化的培养基配方进行验证实验,所得菌丝体干重平均达2.602g/100mL,与预测值相符,优于均匀设计实验的所有组合实验值。
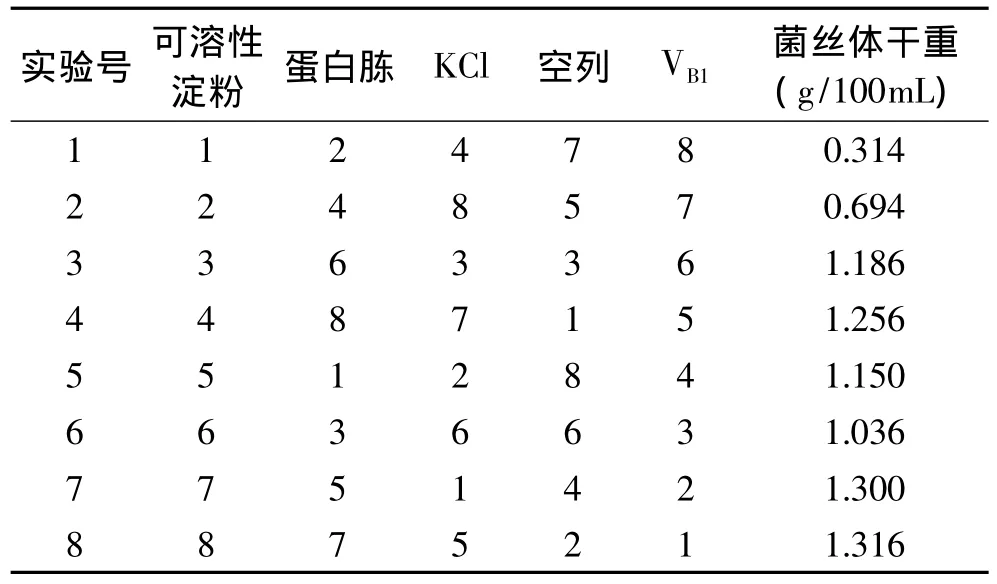
表7 均匀设计实验结果Table 7 Results of uniform design experiment

表8 各偏回归系数的显著性检验Table 8 Significance test of partial regression coefficients
2.2 中心复合设计实验结果与分析
2.2.1 回归模型的建立 运用 Design Expert 8.0对中心复合设计实验结果(表9)进行分析,得出的回归方程如下:
Y=3.052+0.085X1+0.168X2+0.086X3+0.047X1X2+0.036X1X3+0.137X2X3-0.132X12-0.351X22-0.146X32
其中 R2=0.960,F=26.56,p <0.0001,极显著;失拟性实验 F=1.02,p 值为 0.49,不显著,证明所建的回归方程拟合得很好。
2.2.2 各因子主次关系 方差分析结果(表10)表明:除X1X2,X1X3项外其余各项作用均达显著水平,根据回归方程中偏回归系数绝对值大小和F值,可以得到各因子和交互作用的主次顺序为:X22>X2>X32>X2X3>X12>X3>X1>X1X2>X1X3。
由于X1X2,X1X3项作用不显著,所以需将上述回归方程中这二项删除。
2.2.3 各因子组合的优化 根据已删除不显著项的回归方程,计算出 X1=0.32、X2=0.33、X3=0.45,将各因子的编码值换算成自然变量,即接种量11%、发酵温度26℃、转速 143r/min时,Y达最高值 3.113g/100mL。对优化的工艺进行验证,得出菌丝体干重达3.125g/100mL,说明得出的最佳工艺有很好的实用性。
2.2.4 响应面分析 图1为响应面分析图,从中可以直观看出各因子对响应值影响的变化趋势。图1A为当转速为143r/min时,随着接种量的加大和发酵温度的上升,菌丝体产量逐步提高,当达到一定水平时,产量不再上升,反而会下降;当发酵温度为26℃时,接种量和转速对菌丝体干重的影响如图1B所示,在接种量和转速在最优水平以下时,菌丝体干重随因子数值的增加而增加,到达最优水平以后,响应值下降。当接种量为11%时,发酵温度和转速对响应值的影响与以上分析相同(图1C)。

图1 双孢菇液体发酵工艺优化响应面分析Fig.1 Response surface analysis of optimization of liquid fermentation for Agaricus bisporus
3 结论
通过单因素实验筛选出双孢菇的最佳碳源、氮源、无机盐和维生素分别为可溶性淀粉、蛋白胨、KCl和VB1。通过均匀设计实验确定了双孢菇深层发酵的最佳培养基配方为:可溶性淀粉4.6%、蛋白胨4.6%、KCl 0.02%,VB118mg/100mL,理论预计值为2.561g/100mL,这一结论得到验证。中心复合设计实验的结果表明双孢菇溶层发酵的最佳工艺是:接种量11%、发酵温度26℃、转速143r/min时,此时菌丝体干重达3.112g/100mL。验证结果显示菌丝体干重达3.125g/100mL,与未优化的配方和工艺相比,产量提高了202%,说明得出的最佳工艺有很好的实用性。
[1]王贺祥主编.食用菌学[M].北京:中国农业大学出版社,2004:120-121.
[2]吴素玲,孙晓明,王波,等.双孢菇子实体营养成分分析[J].中国野生植物资源,2006,2(2):47-52.
[3]高宏伟,吴华.双孢菇子实体氨基酸和不饱和脂肪酸分析[J].检验检疫科,2003,13(2):15-16.
[4]张强,宫璐婵,孟凡荣,等.双孢菇多糖抗氧化活性的研究[J].中国林副特产,2010,104(1):16-19.
[5]常海兰,殷凤.双孢菇的抗氧化作用及对免疫功能影响的研究[J].山西医科大学学报,2003,34(2):122-123.
[6]Kozarski M,Klaus A,Niksic M,et al.Antioxidative and immunomodulating activities of polysaccharide extracts of the medicinal mushrooms Agaricus bisporus,Agaricus brasiliensis,Ganoderma lucidum and Phellinus linteus[J].Food Chemistry,2011,129(4):1667-1675.
[7]Ruthes A C,Rattmann Y D,Carbonero E R,et al.Structural characterization and protective effect against murine sepsis of fucogalactans from Agaricus bisporus and Lactarius rufus[J].Carbohydrate Polymers,2012,87(2):1620-1627.
[8]Jeong S C,Koyyalamudi S R,Pang G.Dietary intake of Agaricus bisporus white button mushroom accelerates salivary immunoglobulin A secretion in healthy volunteers[J].Nutrition,2012,28(5):527-531.
[9]卞生珍,杨清香.双孢菇采后的生理生化变化[J].新疆师范大学学报:自然科学版,2007,26(2):80-83.
[10]毛勇,毛健,李华钟,等.双孢菇深层发酵培养基的响应面优化[J].食品工业科技,2013,4:193-197.
[11]王敏,刘爱民.不同碳氮源对双孢蘑菇2796深层发酵的影响[J].资源开发与市场,2009,25(2):100-103.
[12]周德庆.微生物学教程[M].北京:高等教育出版社,2011:88-89.
[13]刘晓鹏,姜宁,魏璐,等.白灵菇深层发酵培养基的优化研究[J].中国酿造,2009,3:65-68.

