超声波辅助酶解鲶鱼肉制备抗氧化肽及其活性评定
王 军,王忠合,王晓丽
(韩山师范学院生物系,广东潮州521041)
蛋白质经水解制得的肽类具有更好的溶解性、功能性和营养性,肽类比氨基酸更易通过小肠黏膜被人体吸收利用,且许多肽类具有不同的生物活性,如抗氧化、降血压、抑菌、促进矿物质吸收等[1-2]。一直以来,生物活性肽主要是从植物种子中纯化得到,但随着海洋中丰富的生物资源逐渐为人类所熟知,海洋肽类的开发和活性研究日益受到关注,且由于鱼蛋白量大而质优,有着巨大的开发潜力,是人类蛋白质的良好来源。鲶鱼的肉质细嫩,产量大,含有丰富的蛋白质、脂肪及矿物质等多种营养素,最近的研究[3-4]发现鲶鱼的鱼皮或鱼骨中的胶原蛋白是制备活性肽的优质资源,可大大提高其附加值。目前已有酶解鲶鱼加工副产物制备抗氧化肽和抑菌肽等生物活性肽的报道,但是有关酶解鲶鱼肉制备抗氧化肽方面的报道较少,因而深入开发这一优质的蛋白质资源具有较好的发展前景。
超声波具有波动与能量的双重属性,作为一种新型的非热处理技术,具有提取效率高、时间短、副反应少等优点,广泛用于食品组分的乳化、均质、提取、结晶、杀菌、脱气等领域[5-6]。酶法水解蛋白质可在一定条件下进行定位水解产生特定的肽,易于控制水解进程,且具有高度专一性,一般不会导致营养方面的损失,也不会产生毒理上的问题[7];而且酶作用可在温和条件下进行、能耗低,能较好地满足肽的生产需要。研究表明,超声波处理可强化提取过程和加速反应,并可影响蛋白质的二级结构、疏水性、絮凝性等[8-9]。因此深入分析超声处理对蛋白质酶解过程及酶解产物活性的影响,为活性肽的制备提供一定的依据,同时对于寻找新型高效天然抗氧化剂及深入开发淡水鱼资源也具有重要的理论和实际意义。
1 材料与方法
1.1 材料与仪器
鲜活鲶鱼 购于当地市场,于冰水中运送至实验室,去头、尾、皮、骨及内脏,冲洗去血后于绞肉机中搅成肉糜,装袋后置于-20℃冰箱中冻藏,备用。
2,4,6-三硝基苯磺酸 TNBS,美国Sigma公司;2-硫代巴比妥酸 国药集团化学试剂有限公司;胰蛋白酶4000U/g 广东环凯生物科技有限公司;胃蛋白酶3000~3500NFU/mg 生工生物工程(上海)有限公司;碱性蛋白酶2.4U/g 诺维信公司;三氯乙酸,NaOH等试剂均为国产分析纯。
KQ-500DV型超声细胞破碎仪 昆山市超声仪器有限公司;TU-1901紫外可见分光光度计 北京普析通用仪器有限责任公司;LGJ-18型冷冻干燥箱北京四环科学仪器厂;PHS-3D型精密pH计 上海恒磁电子科技有限公司。
1.2 实验方法
1.2.1 鲶鱼肉蛋白的酶解工艺 超声辅助酶法处理:取5g碎鱼肉,加入100mL去离子水,用0.1mol/L的NaOH溶液调节pH至8.0,于超声功率为300W,温度为40℃下超声处理,超声处理条件为:工作4s、间歇2s、最高温度50℃,采用冰水浴进行控温,处理20min后,再加入0.5%(以鱼肉计)的胰蛋白酶,置于40℃的恒温水浴中酶解2h,所得产物灭酶(90℃、15min),经10000r/min离心5min,取上清液,冷冻干燥,备用。
水浴酶法处理:将超声处理20min用40℃水浴处理代替,其他操作同超声处理,所得产物灭酶(90℃、15min),经 10000r/min离心 5min,取上清液,冷冻干燥,备用。
超声酶解处理:加入0.5%(以鱼肉计)的胰蛋白酶,其他操作同超声处理,经超声波预处理20min后,置于40℃的恒温水浴中酶解2h,所得产物灭酶(90℃、15min),经 10000r/min离心 5min,取上清液,冷冻干燥,备用。
1.2.2 水解度的测定 水解度的测定采用TNBS法[10],取50μL 酶解液加入 0.5mL 0.2125mol/L 的磷酸盐缓冲液(PBS,pH8.2)和0.5mL 0.05%TNBS溶液,混匀,置于50℃下温浴1h。加入1mL 0.1mol/L盐酸终止反应,室温下放置30min后于420nm处测定吸光度值。另取一定量的样品放入水解管中,加入100倍体积的6mol/L盐酸,充氮保护,于120℃下水解24h,冷却后定容测定总氨基酸的量。以L-亮氨酸绘制标准曲线,按照下式计算水解度(DH):
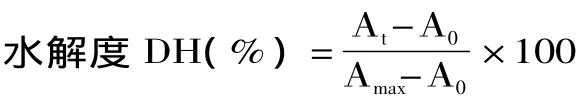
式中:At-酶解后氨基酸的量,mg;A0-酶解前氨基酸的量,mg;Amax-氨基酸的总量,mg。
1.2.3 多肽得率的测定 氨基氮含量采用甲醛电位滴定法[11]测定,按照下式计算多肽得率:

式中,V1和V2分别为样品稀释液及空白组加入甲醛后所消耗氢氧化钠溶液体积(mL);m为样品质量,g;c为氢氧化钠溶液浓度(mol/L);0.014为氮的毫摩尔质量(g/mmol),K为稀释倍数。
1.2.4 单因素实验
1.2.4.1 固液比的影响 选择固液比 1∶10、1∶15、1∶20、1∶25、1∶30、1∶35 和 1∶40(w/v),其他条件同超声辅助法酶解处理,酶解后测定多肽得率。
1.2.4.2 超声波功率的影响 选定固液比为1∶15,选择超声功率分别为 200、250、300、350、400W,其他条件同上,酶解后测定多肽得率。
1.2.4.3 超声处理温度的影响 选定超声波处理功率为300W,其他条件不变,超声处理温度为30、40、50、60、70℃,酶解后测定多肽得率。
1.2.4.4 超声时间的影响 在超声温度为40℃,超声功率为300W的条件下,分别超声波10、20、30、40和50min,酶解后测定多肽得率。
1.2.4.5 酶解时间的影响 选择超声处理的条件后,研究酶解时间为1、2、3、4和5h对肽得率的影响,酶解后测定多肽得率。
1.2.5 响应曲面法优化实验 根据单因素实验的结果,选择显著影响肽得率的4个因素:超声时间、超声功率、超声温度、酶解时间,按表1进行四因素五水平的响应面分析,以肽得率为响应变量,优化鲶鱼肉酶解制备多肽的工艺条件。

表1 响应面实验因素水平表Table 1 Factors and levels of response surface test
1.2.6 抗氧化性评定
1.2.6.1 抗脂质过氧化能力分析 新鲜卵黄用0.1mol/L磷酸盐缓冲液(PBS,pH7.4)按1∶1配成悬液,再稀释25倍,磁力搅拌30min。向试管中加入卵黄悬液0.4mL,再分别加入样品液0.2mL(冷冻干燥后的样品用PBS配制,对照组加入同体积的PBS)、25mmol/L的硫酸亚铁0.4mL,并用0.1mol/L PBS补至4.0mL,置于37℃水浴中,反应50min。取出后加入20%三氯乙酸1mL,静置10min后,以3000r/min离心15min,取上清液4mL加入0.8%硫代巴比妥酸2mL,塞紧试管,于100℃水浴中反应15min,空白管以PBS取代上清液,其余操作相同。最后在532nm处测定吸光度,计算抑制率[12]。
1.2.6.2 清除DPPH自由基能力分析 取不同浓度的多肽样液2mL于10mL比色管中,分别加入2mL DPPH溶液(1mmol/L,溶于无水乙醇),混匀后在室温下避光反应30min,取出在波长517nm处测定吸光值AS;对照组为2mL无水乙醇溶液代替DPPH溶液与2mL样液混合测定吸光值为AS;空白组为2mL DPPH溶液与2mL蒸馏水混合测定吸光值为AB;以无水乙醇作为空白调零。按照下式[13]计算自由基的清除率P:
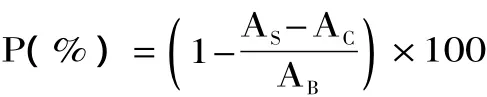
1.3 数据处理
实验结果以平均值±标准偏差SD表示,用SPSS 17.0进行一维方差分析(one-way ANOVA),差异显著性采用Duncan(邓肯)检验,检验水平p<0.05。
2 结果与分析
2.1 制备方法对鲶鱼肉多肽的影响
从图1可以看出,水浴法酶解、超声酶解法和超声辅助酶解3种处理方法显著影响多肽得率(p<0.05),且两种超声波处理法的多肽得率和水解度均大于水浴处理法的,而两种超声波处理间无差异。与水浴酶解处理相比,超声波处理能破坏蛋白的结构,使酶的结合位点增多,进而提高酶解速率[5,14]。超声酶解法处理中可能由于超声波作用破坏部分酶的分子结构,从而降低了酶的活性,进而降低蛋白酶的酶解速率,影响鲶鱼肉蛋白的水解度和多肽得率。因此,后续实验选择超声辅助酶解法处理鲶鱼肉制备抗氧化肽。
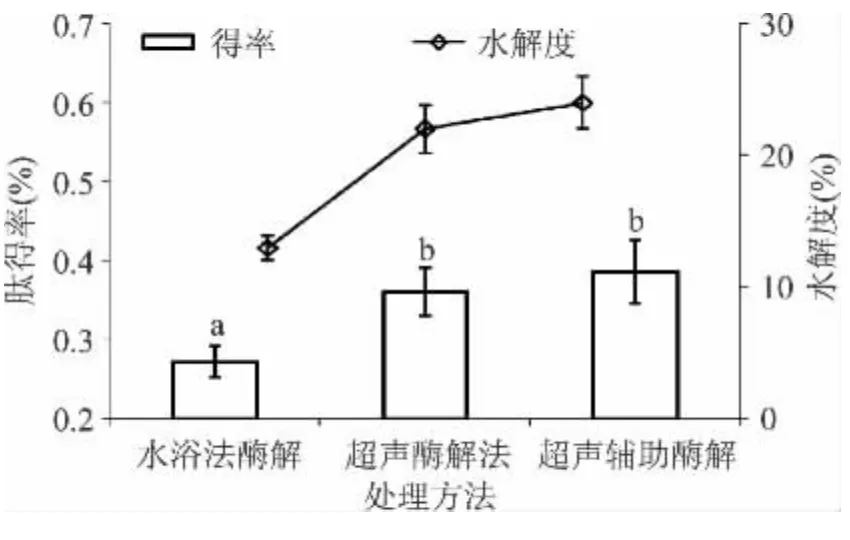
图1 处理方法对多肽得率的影响Fig.1 Effect of treatment methods on yields of peptieds
2.2 单因素实验
2.2.1 固液比的影响 实验结果如图2。
从图2可知,随着固液比的增加,肽得率呈现先增加后下降的趋势,这是因为在反应体系中水分含量升高,鱼肉蛋白充分分散,有利于超声波作用并可扩大蛋白质分子与酶接触的面积,提高水解度,从而提高肽得率;在高固形物含量条件下酶分子与底物分子的扩散性较小,酶分子主要进攻蛋白质分子表面,形成较多的短链肽和长链肽[15]。但随着固液比的继续增加,反应体系中的水分含量增大,酶与蛋白质分子接触面积增加,蛋白质被水解成中等分子量的片段较多,从而影响肽得率,且过多的水分含量也不利于节省能源,因此本文后续实验选取固液比为1∶15。
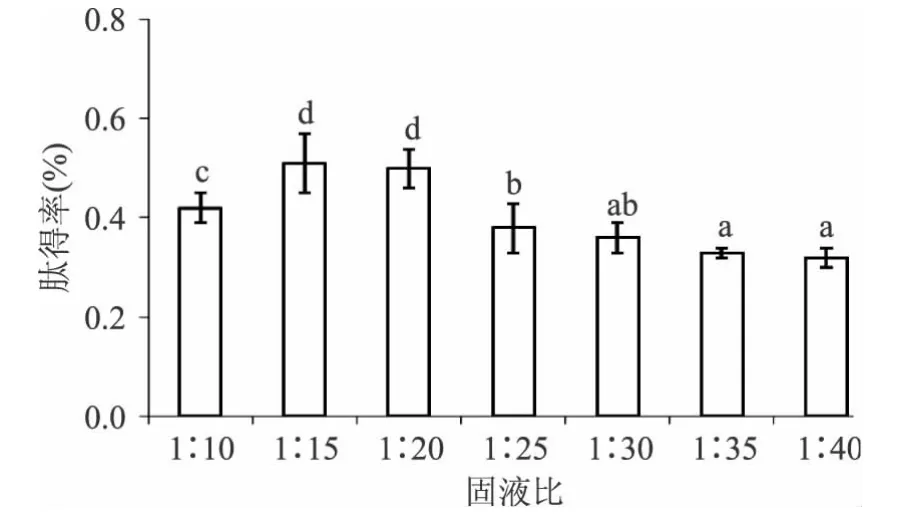
图2 固液比对肽得率的影响Fig.2 Effect of solid-to-liquid ratio on yield of peptides
2.2.2 超声功率的影响 实验结果见图3所示。
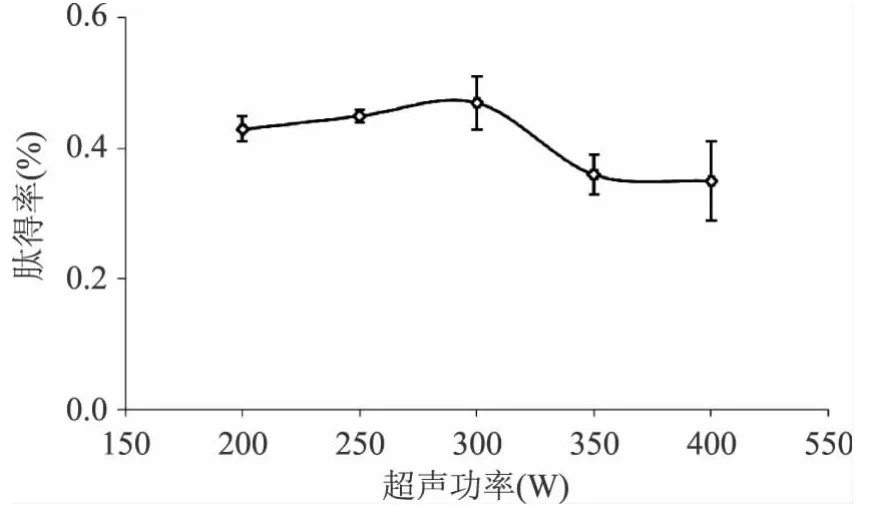
图3 超声功率对肽得率的影响Fig.3 Effect of ultrasonic power on yield of peptides
由图3可以看出,在超声波功率为300W时肽得率最高,而继续增大超声波功率肽得率反而减小,这可能是由于超声功率过大会破坏酶分子构象,使酶活力下降。本实验选取超声处理功率为300W。
2.2.3 超声温度的影响 实验结果如图4所示。

图4 超声温度对肽得率的影响Fig.4 Effect of ultrasonic temperature on yield of peptides
由图4可以看出,随着超声处理温度的升高,肽得率先增大后减小,超声作用的最佳温度为40℃。超声波作为一种能量形式,具有加热作用和空化作用,对酶可产生促进或抑制双重作用。当温度较低时,与空化作用相比,加热作用占主导,体系吸收超声波能量,从而加速酶促水解的反应,从而提高肽得率。随着温度的升高,空化作用所产生的自由基进入酶活性中心,破坏酶分子的构象。因此,当温度进一步升高时,一方面酶蛋白热变性,另一方面可能是自由基的破坏作用,导致肽得率下降。因此,本实验选取超声处理温度为40℃。
2.2.4 超声时间的影响 实验结果如图5所示。
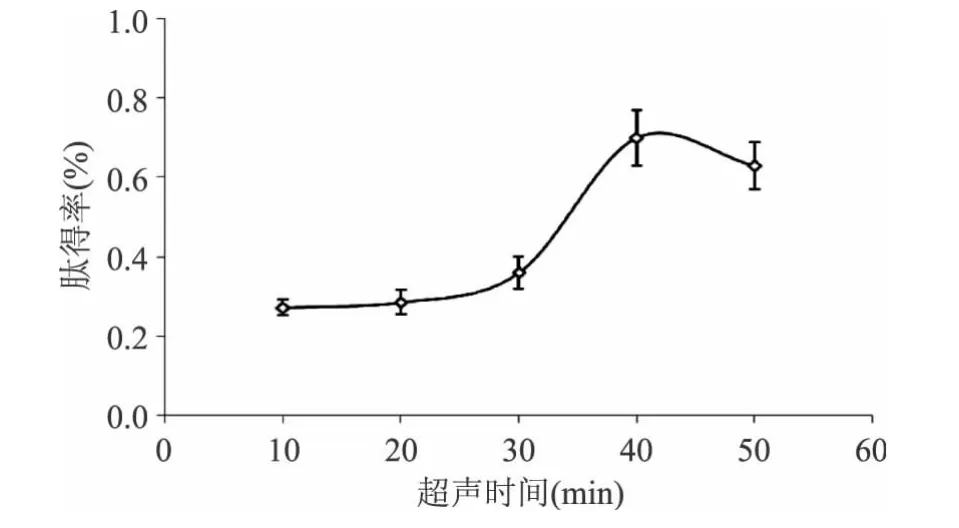
图5 超声时间对肽得率的影响Fig.5 Effect of ultrasonic time on yield of peptides
从图5可以看出,随着超声处理时间的延长,肽得率逐渐提高,当处理时间增加到40min时,肽得率达到最大值(0.7%),而继续延长处理时间肽得率下降。这是因为在处理时间较短的条件下,样品受超声波的空化作用,击碎鱼肉组织细胞使蛋白质游离出来,而且能够使蛋白质的空间结构发生变化,埋藏在蛋白质内部的活性部位暴露出来,更好的与酶作用[9],从而提高了肽得率。因此,选取超声波处理的最佳时间为40min。
2.2.5 酶解时间的影响 实验结果如图6。

图6 酶解时间对肽得率的影响Fig.6 Effect of holding time on yield of peptides
从图6可以看出,肽得率随着酶解时间的延长呈现逐渐增加的趋势,超过4h后增加的趋势趋于平缓,这可能是由于随着酶解时间的延长,鱼肉蛋白被酶解成多肽和氨基酸等分子量更小的物质,长时间的深度水解可能影响多肽的活性[16],因此,后续实验选取最佳的酶解时间为2h。
2.3 工艺条件优化
表2列出了回归正交旋转设计实验结果。
利用Statistica 8.0软件,对表2中的实验数据进行二次多项拟合,获得鲶鱼多肽得率对超声时间、超声温度、超声功率和酶解时间的多元回归方程:

式中:y为多肽的得率,z1~z4分别为上述四个自变量的编码值。
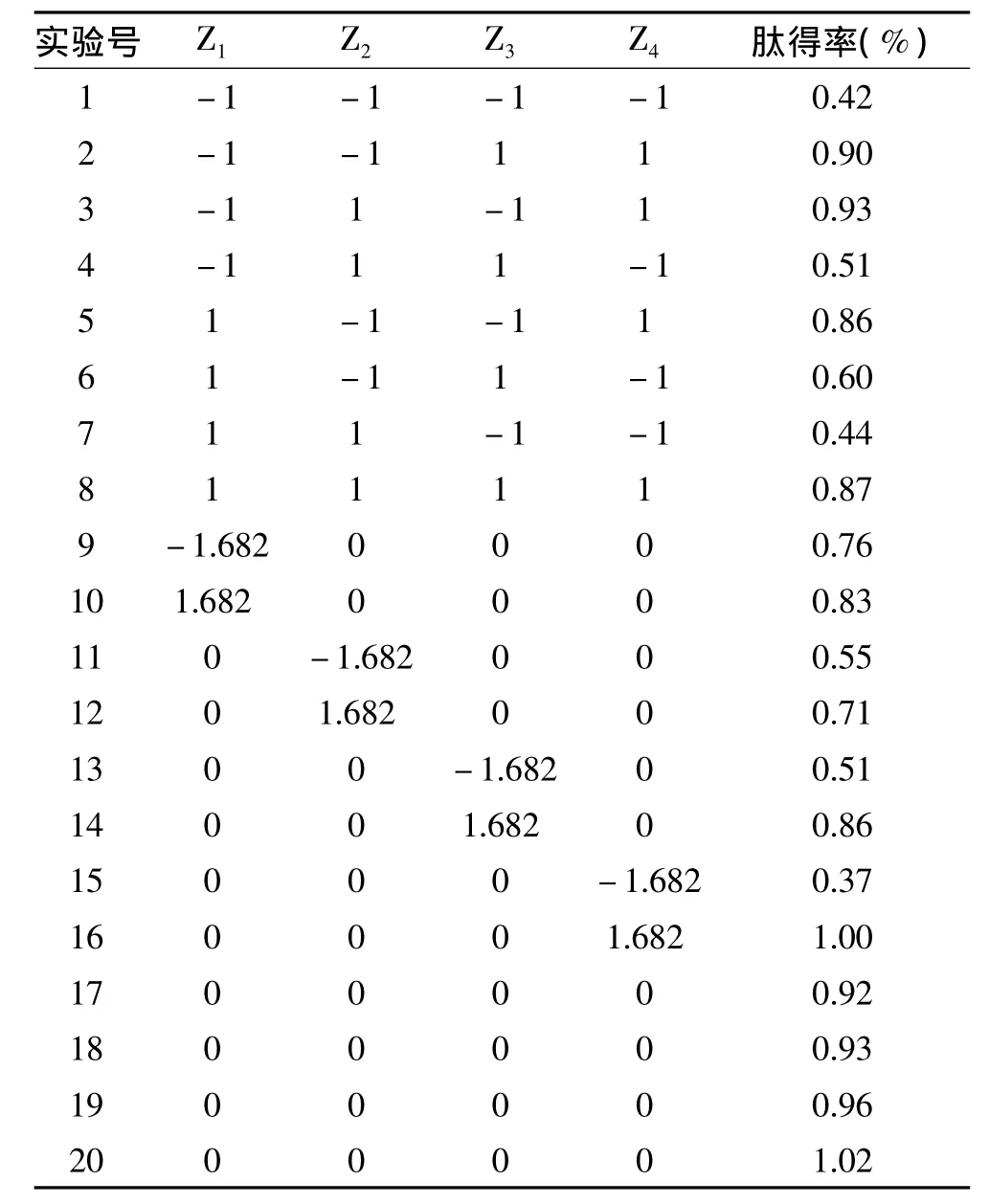
表2 响应面实验结果Table 2 Results of response surface test
从该方程的方差分析表3可以看出,本实验所选用模型极显著(p<0.01),线性相关系数R2=0.97,具有较好的相关性,且失拟项不显著(p>0.05),拟合度较好,在实验范围内可以用方程对实验结果进行分析和预测。
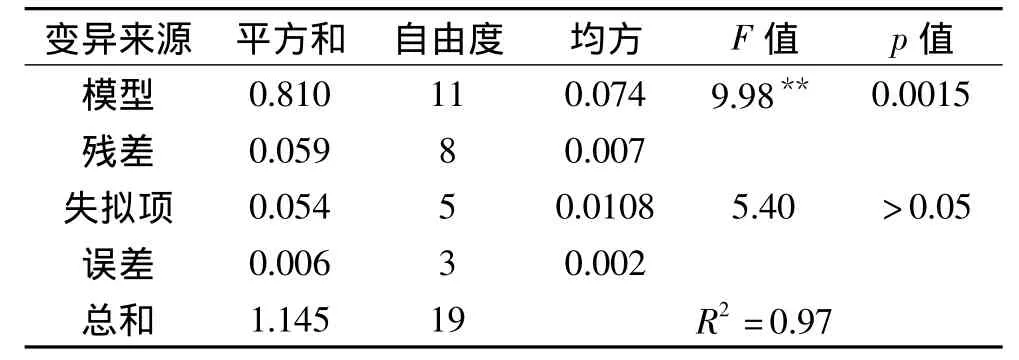
表3 二次回归正交旋转组合设计模型方差分析表Table 3 Analysis of variance table of results
上述方程的回归系数显著性检验表明:因素z3、z4对鲶鱼肉酶解液中多肽得率的线性效应显著,而z1、z2对其影响不显著;z22、z32、z42对鲶鱼肉酶解液中多肽得率的曲面效应显著,z12对其曲面效应不显著;而交互效应影响不显著,如表4所示。
利用正则分析[17],可求得稳定点 Z0=[0.2316,-0.0095,0.4358,1.3341],即:在 X1为 42.32、X2为39.91、X3为321.79、X4为3.33时,酶解液中多肽得率达到最大值1.08。根据实际生产情况,可将超声时间(X1)42min、超声温度(X2)40℃、超声功率(X3)320W、酶解时间(X4)3.3h作为制备的最佳工艺参数,经实验验证酶解液中多肽得率为1.13%。

表4 回归方程系数显著性检验Table 4 Significant test of regression equation
2.4 抗氧化活性分析
2.4.1 抗脂质过氧化能力 脂质过氧化物是生物膜和亚细胞膜中磷脂质所含多元不饱和脂肪酸被自由基氧化形成的过氧化产物,它可引起膜损伤、蛋白质交联、DNA和RNA结构破坏等生化毒性反应,造成机体衰老和多种疾病[18]。通过对卵黄脂质过氧化产物的二级分解产物丙二醛(MDA)的抑制以达到延缓衰老和防止疾病的作用,结果如图7所示。

图7 活性肽的抗脂质过氧化能力Fig.7 Anti-lipid peroxidation ability of biopeptide
由图7可知,在实验浓度范围内,随着肽浓度的增加,其抗脂质过氧化能力逐渐增强,IC50值为0.55mg/mL,由此证明上述酶解法制备的多肽对脂质过氧化产生的丙二醛具有较好的抑制作用。
2.4.2 清除DPPH自由基能力 DPPH是一种有机自由基,清除DPPH自由基目前被作为评价物质是否具有抗氧化能力的指标之一,不同浓度的活性肽对DPPH自由基清除能力的实验结果如图8所示。
从图8可以看出,随着活性肽浓度的增加,其清除DPPH自由基的能力增强,两者呈正相关关系,其IC50值为 0.69mg/mL。
3 结论
3.1 通过响应面法得到鱼肉蛋白超声辅助酶法制备抗氧化肽的最佳工艺参数为:超声时间42min、超声

图8 活性肽清除DPPH自由基能力Fig.8 DPPH-scavenging capacity of peptides
3.2 活性肽的抗脂质过氧化和清除自由基实验结果表明,鲶鱼肉蛋白酶解物具有较好的抗脂质过氧化和清除自由基能力。
[1]Foegeding EA,Davis J P.Food protein functionality:A comprehensive approach[J].Food Hydrocolloids,2011,25(8):1853-1864.
[2]Zheng L,Su G,Ren J,et al.Isolation and characterization of an oxygen radical absorbance activity peptide from defatted peanut meal hydrolysate and its antioxidant properties[J].Journal of Agricultural and Food Chemistry,2012,60(21):5431-5437.
[3]Ren X,Ma L,Chu J,et al.Optimization of enzymatic hydrolysis of channel catfish bones for preparing antimicrobial agents[J].Journal of Aquatic Food Product Technology,2012,21(2):99-110.
[4]Yarnpakdee S,Benjakul S,Penjamras P,et al.Chemical compositions and muddy flavour/odour of protein hydrolysate from Nile tilapia and broadhead catfish mince and protein isolate[J].Food Chemistry,2014,142(1):210-216.
[5]Kwiatkowska B,Bennett J,Akunna J,et al.Stimulation of bioprocesses by ultrasound[J].Biotechnology Advances,2011,29(6):768-780.
[6]Delgado-Povedano M,Luque de Castro M.Ultrasoundassisted analytical emulsification-extraction[J].TrAC Trends in Analytical Chemistry,2013,45(4):1-13.
[7]王忠合,王军,陈瑞英.烘烤和酶解处理对花生蛋白功能性及抗氧化性的影响[J].食品与发酵工业,2013,39(11):151-156.
[8]Arzeni C,Pérez OE,Pilosof AM.Functionality of egg white proteins as affected by high intensity ultrasound[J].Food Hydrocolloids,2012,29(2):308-316.
[9]Arzeni C,Martinez K,Zema P,et al.Comparative study of high intensity ultrasound effects on food proteins functionality[J].Journal of Food Engineering,2012,108(3):463-472.
[10]Jamdar S,Rajalakshmi V,Pednekar M,et al.Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J].Food Chemistry,2010,121(1):178-184.
[11]吴姣,郑为完,赵伟学,等.有限酶解米渣蛋白的乳化功能特性表征[J].食品与发酵工业,2007,33(10):23-26.
[12]Ohkawa H,Ohishi N,Yagi K.Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction[J].Analytical Biochemistry,1979,95(2):351-358.
[13]王军,王忠合,薛晓丽,等.不同温度热解酸化蔗糖制备低聚焦糖[J].华南理工大学学报:自然科学版,2012,40(5):133-138.
[14]刘振家,朱科学,周惠明,等.超声波辅助酶解脱脂小麦胚芽制备抗氧化肽的研究[J].中国油脂,2009,34(5):38-41.[15]Hardt N,van der Goot A,Boom R.Influence of high solid concentrations on enzymatic wheat gluten hydrolysis and resulting functional properties[J].Journal of Cereal Science,2013,57(3):531-536.
[16]Cheung IW,Cheung LK,Tan NY,et al.The role of molecular size in antioxidant activity of peptide fractions from Pacific hake(Merluccius productus)hydrolysates[J].Food Chemistry,2012,134(3):1297-1306.
[17]王忠合,钟丽娴.麦麸活性多糖的提取,组成及其抗氧化性研究[J].食品工业科技,2009,30(7):115-119.
[18]王华,姚亚平,王毕妮,等.高粱籽粒提取物抗氧化活性的研究[J].食品与发酵工业,2007,33(10):123-127.

