两株弱后酸化保加利亚乳杆菌发酵性能的研究
曹凤波,王晓明,周 晶,李媛媛,刘 宾,霍贵成
(东北农业大学,乳品科学教育部重点实验室,黑龙江哈尔滨150030)
发酵乳制品中的益生菌不仅可以改善食品的品质,其自身也为人体提供改善肠道功能、促进物质吸收等有益作用。酸奶是最为普遍的一种利用乳酸菌发酵的乳制品,其主要以德氏乳杆菌保加利亚亚种和嗜热链球菌为发酵剂,在42℃下发酵至pH4.5,低温下储存、运输和销售[1]。在发酵后和食用前的过程中,乳酸菌仍能继续繁殖和发酵乳糖产生乳酸,使pH进一步下降,产生人们无法接受的过酸味,同时因为酸度过高使菌体大量死亡,活菌数目较少,降低益生作用,这就是后酸化。
保加利亚乳杆菌是引起后酸化的主要菌株,因为其产酸和适应酸的能力较嗜热链球菌更强[2]。为了解决酸奶后酸化问题,人们曾尝试改善生产工艺和储藏等方法,或通过基因诱变得到后酸化能力弱的突变株,但都存在着一定的弊端且无法根本解决这一问题。作为物产大国,我国微生物资源同样十分丰富,通过筛选得到发酵性能好,低温下产酸能力低的野生型菌株显得尤为重要。本实验通过对乳品重点实验室保存的保加利亚乳杆菌进行筛选,得到两株后酸化能力最弱的菌株,在已清楚其后酸化弱的机理的情况下,就产酸特性、后酸化特性、产香特性、质构特性等能决定酸奶品质高低的重要发酵性能指标进行测定[3],以验证其是否能够作为潜在的发酵剂进行深入的研究,为大规模投入生产做准备。
1 材料与方法
1.1 材料与仪器
菌种:从乳品科学教育部重点实验室菌种保藏中心(KLDS-DICC)筛选出的两株弱后酸化保加利亚乳杆菌 KLDS1.1011、KLDS1.1006[3]和具有优良发酵性能的对照菌 KLDS1.9201[4]。
培养基:MRS培养基;11%(w/v)脱脂乳培养基。
主 要 试 剂:1% NaHSO3,1mol/LNaHCO3,0.01mol/L(1/2 I2),邻苯二胺,4mol/L HCl,浓硫酸,苯酚,三氯乙酸,0.1mol/L NaOH,酚酞等,所有试剂均为分析纯。
主要仪器:Delta320精密pH计 Mettler Toledo公司;DU-800紫外分光光度计 Beckman公司;GL-21M高速冷冻离心机、BCN1360型生物洁净工作台、SPX-150B生化培养箱、HIRAYAMA HVE-50形高压灭菌器、TA.XT-2i型质构仪等。
1.2 实验方法
1.2.1 菌株产酸性能的测定 将培养16h的菌株按5.0×106cfu/mL的接种量转接到11%(w/v)的脱脂乳中,42℃发酵至 pH4.5左右,分别在 4、20℃储藏,以供后面实验使用。
1.2.1.1 发酵期间产酸能力测定 自发酵开始,每隔2h测定乳样的pH,共测定到第12h。
1.2.1.2 储藏期间后酸化程度的测定 分别测定4℃和20℃条件下储藏1、2、7、14和21d发酵乳的滴定酸度和pH。滴定酸度的测定方法参照GB5413.34-2010,pH测定方法采用 Delta320精密 pH计直接测定。
1.2.2 菌株产香性能的测定 取发酵 0、6、12、18、24、48h 及7、14、21d 的待测乳样 60mL,加等体积的16%三氯乙酸溶液,混匀,8000r/min离心10min,取上清液用滤纸过滤,以保证澄清,得到的滤液备用。以未接菌的脱脂乳作为对照。
1.2.2.1 乙醛含量的测定 酸奶中的乙醛在酸性条件下与1%的亚硫酸氢钠发生加成反应,剩余的亚硫酸氢钠被碘氧化;在碱性条件下乙醛亚硫酸氢钠与0.01mol/L的碘标准溶液反应,根据反应的当量关系计算乙醛含量[5]。每组样品至少测定 3次,取平均值。
1.2.2.2 双乙酰含量的测定 邻苯二胺和双乙酰可以反应生成2,3-二甲基并吡嗪,其盐酸盐在335nm下有最大吸收值,可对双乙酰进行定量测定[5]。每组样品至少测定3次,取平均值。
1.2.3 菌株发酵酸乳的物性特性的测定
1.2.3.1 发酵乳质构的测定 采用TPA质地剖面分析法,利用TA.XT-2i型质构仪将4℃储存7d的发酵乳进行质构的测定,每个样品重复测定3次。质构仪参数设定:探头类型P/35mm,下降速度2.0mm/s,测试速度 5.0mm/s,回程速度 5.0mm/s,间隔时间10s,下压变形距离10mm,感应力Auto-5g。
1.2.3.2 脱水收缩能力的测定 将4℃ 储存7d的酸乳在凝固状态下轻轻地收集表面析出的所有乳清,与酸奶的总体积比的百分数就是脱水收缩程度[6]。每个样品做3个平行样。
1.2.4 统计分析 采用SPSS19.0软件对实验数据进行差异显著性分析(p<0.05),每组重复3次,最终结果表示方式为平均值±标准差。相同字母代表差异性不显著,不同字母代表差异性显著。
2 结果与讨论
2.1 菌株发酵过程中的产酸特性
在工业生产中,产酸能力是筛选乳酸菌发酵剂的一个重要指标,但是前期产酸能力高也意味着在低温条件同样会较快的繁殖和发酵产酸,导致严重的后酸化,所以在筛选弱后酸化发酵剂时产酸并不是一个决定性指标。在42℃下发酵脱脂乳的过程中,KLDS1.1011 和 KLDS1.1006 的产酸量始终都显著低于对照菌 KLDS1.9201(p<0.05),并且在 pH 达到4.5 后没有过多的下降,而 KLDS1.9201 在到达 pH4.5以后仍快速产酸,在42℃条件下发酵到12h时,pH已降至3.89。乳酸菌的产酸曲线和生长曲线趋势相一致,在发酵初期,乳酸菌处于延滞期,生长较为缓慢,因而产酸速率也很低,当进入对数生长期时,乳酸菌生长加快,同时产酸速率也加快,处于稳定期后,虽然乳酸菌仍在生长,但由于受到自身代谢产物的影响,尤其是酸度的影响,菌株产酸速率逐渐下降,达到一个较恒定的值[7]。针对 KLDS1.9201 本实验室已经对其做过大量研究,分批发酵取得较好的成果[4]。通过与其对比,可以更好的评价两株实验菌的性能。本实验中KLDS1.1011和KLDS1.1006这两株菌在达到稳定后产酸量仍然很低,在低pH环境下适应能力较差,表明其对酸比对照菌要敏感,且KLDS1.1011更为敏感,这一特性正是酸奶低温储藏时降低后酸化程度的一个前提。
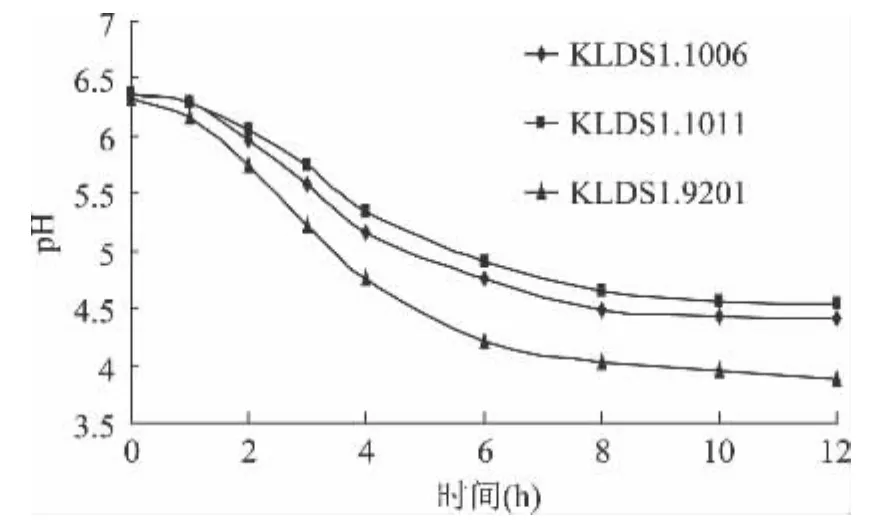
图1 单菌株发酵的pH变化Fig.1 Acid-producing activities of the strains
2.2 菌株在储藏期间的后酸化特性
实验菌和对照菌分别在4℃和20℃下储藏21d,测定发酵乳的滴定酸度和pH,以评价其后酸化程度(如表 1、表 2)。实验发现,在 4℃ 下第 2d时,KLDS1.9201已明显的产酸,酸度升高了 18.57%,pH 下降到 4.24,而 KLDS1.1006 和 KLDS1.1011 发酵的酸乳酸度分别升高了9.59%和5.56%。到第21d,KLDS1.9201 的酸度已经升高了 51.95%,pH 下降到 3.67。KLDS1.011 和 KLDS1.1006 也有不同程度的产酸,但显著弱于对照菌(p<0.05),在第21d,两株菌的pH为4.25和4.17。因此,该两株实验菌在货架期间有较低的产酸速率,有效延缓了后酸化的发生。
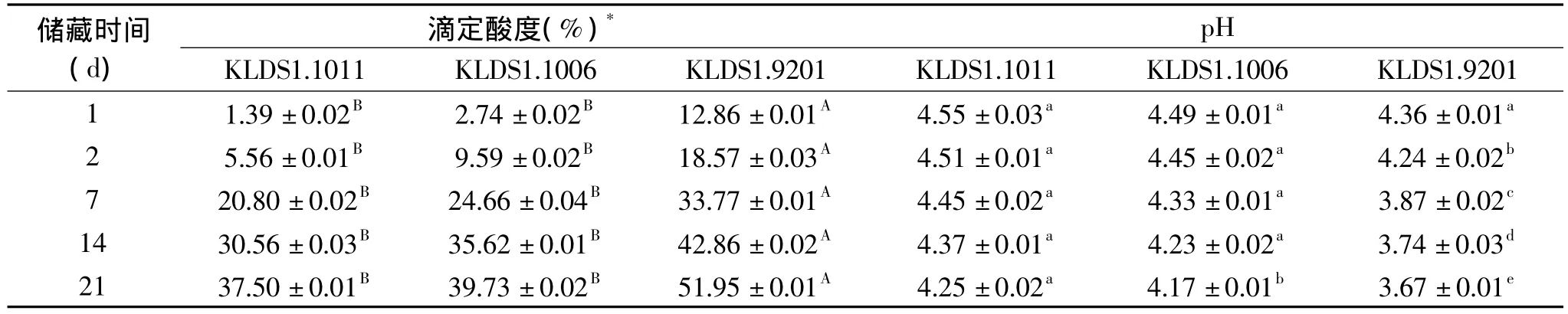
表1 酸奶在4℃下储存的pH和酸度变化Table 1 Changes in acidity and pH of yogurt during storage at 4℃
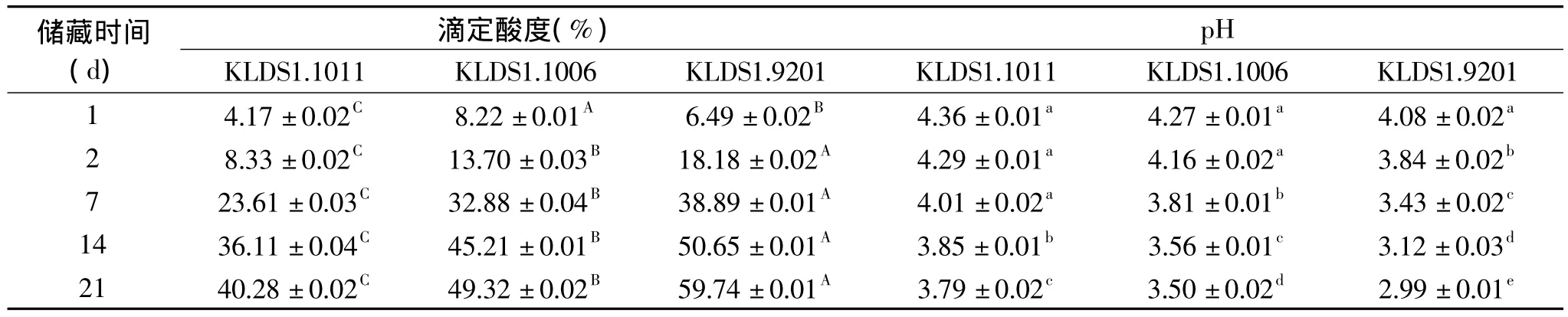
表2 酸奶在20℃下储存的pH和酸度变化Table 2 Changes in acidity and pH of yogurt during storage at 20℃
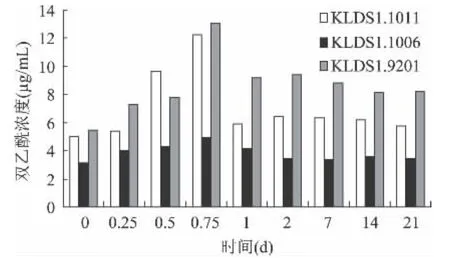
图2 储存期间双乙酰含量的变化Fig.2 The changes in diacetyl contents during storage
在20℃条件下储存,保加利亚乳杆菌的代谢速率较高,产酸能力显著高于4℃下的产酸情况(p<0.05)。在储藏第 7d,KLDS1.9201 的滴定酸度已经增加了 38.89%,到第 21d,其 pH 下降到 2.99,发生严重的后酸化。虽然 KLDS1.1011和 KLDS1.1006两株菌随冷藏时间延长产酸程度有所加强,但仍显著低于对照菌(p < 0.05),在第 21d,酸度分别增加了40.28%和49.32%。我国多数消费者习惯于在常温下储藏酸奶,20℃下,酸奶发生后酸化的程度直接影响了食用时的品质[8]。KLDS1.1006受温度的影响较大,后 酸 化 程度 强 于 KLDS1.1011(p < 0.05),故KLDS1.1011的后酸化能力更弱,适合作为弱后酸化的发酵剂进行进一步的研究。
导致 KLDS1.1011 和 KLDS1.1006 后酸化能力较低的原因是在乳酸菌发酵乳糖产生乳酸过程中有几种重要的酶参与其中,其中对后酸化程度起到关键性作用的酶是H+-ATPase和乳酸脱氢酶,通过实验证明,这两株菌的H+-ATPase和乳酸脱氢酶的活性较低,决定了其较弱的后酸化能力[9]。
2.3 菌株在冷藏期间的产香特性
乳酸菌在糖的代谢过程中可以产生多种挥发性芳香化合物,如乙醛、丙酮、乙偶姻、双乙酰、乙醇等,它们与有机酸相互作用,形成酸乳的独特风味,其中乙醛和双乙酰是风味物质的主要成分[10],所以在筛选优良发酵菌种时,往往把这两个指标作为测定的项目。如图2所示,在4℃冷藏过程中,三株菌产双乙酰的能力强弱分别是KLDS1.9201>KLDS1.1011>KLDS1.1006,并且 KLDS1.1006 较其他两株菌的产量差距较大(p<0.05)。在第18h时,三株菌都达到了最大量,KLDS1.9201 的双乙酰浓度是 13.05μg/mL,KLDS1.1011 和 KLDS1.1006 分别是 12.23μg/mL 和5.00μg/mL。有报道称[11],双乙酰的最佳收获时间是12~24h,本实验结果与其结论相一致。然而三株菌达到产乙醛最大量的时间却不同,KLDS1.9201和KLDS1.1011在 24h时达到最大量,浓度分别是31.18μg/mL 和25.12μg/mL,KLDS1.1006 在18h 达到26.86μg/mL的最大产量(图3)。酸奶发酵剂的菌种对乙醛产量有很大的影响[12],李勇等人[13]的实验证明乙醛的产生与酸度有显著的正相关,在本实验中,KLDS1.9201、KLDS1.1006 和 KLDS1.1011 的产酸能力依次递减,乙醛的产量也呈显著下降趋势(r=0.992,p<0.05),这同样证明了他们的观点。在前24h内,乙醛的产生基本是逐渐增加的,达到最大量后又较缓的下降。乙醛浓度的降低一方面是由于发酵剂菌种产生了乙醇脱氢酶,将乙醛降解成乙醇,另一方面是由于储藏过程中挥发了一部分[14]。在此处,仍然是 KLDS1.9201 产 乙 醛 的 能 力 最 大,KLDS1.1011虽然比KLDS1.1006的产量低,但是差异不显著(p >0.05)。
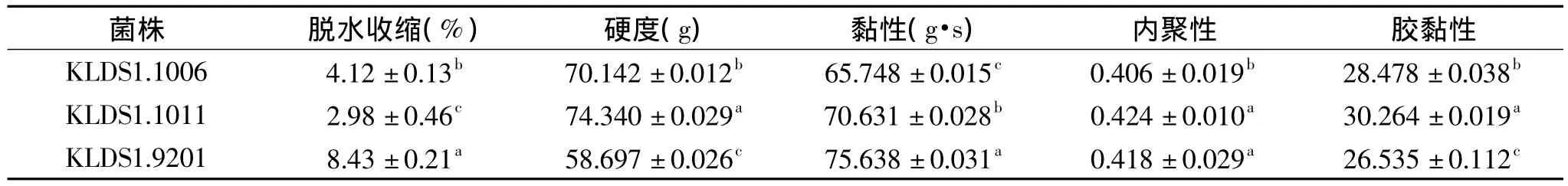
表3 三株保加利亚乳杆菌所得酸乳的TPA质构分析Table 3 TPA analysis of yogurt fermented by 3 strains of Lactobacillus Bulgaricus
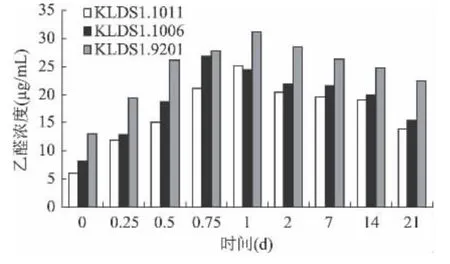
图3 储存期间乙醛含量的变化Fig.3 The changes of acetaldehyde contents during storage
2.4 冷藏过程中不同菌株发酵酸乳的物性特性
酸乳由于脱水收缩而在其表面形成乳清,导致外观和口感品质下降[15]。在表 3 中,KLDS1.1011 发酵酸乳析出的乳清体积只占总体积的2.98%,凝乳状态较好,KLDS1.1006 和 KLDS1.9201 的脱水收缩率分别是 4.12% 和 8.43%,析出乳清较多(p < 0.05)。乳清的析出是由于在凝乳过程中构成胶体网络结构的颗粒进行重新排列,它受不同流变学参数的影响[16]。Folkenberg 等人[17]发现脱水收缩与酸奶的硬度呈负相关,与黏度呈正相关。在本实验中,KLDS1.1011 的 硬 度 大 于 KLDS1.1006 和 对 照 菌KLDS1.9201,呈现明显的负相关(r=-0.998,p <0.05),但是黏性相关性不显著(r=0.754,p > 0.05)。内聚性最小的是KLDS1.1006,与其他指标不具相关性,但是 KLDS1.1011 的内聚性是0.424,依然是最高。搅拌前,酸奶的硬度大小是其凝胶结构的一个特征,是酸奶中多种化学键的结合及可溶性微粒聚合的结果。不同发酵剂生产的酸奶硬度有时会有较大差别,酸奶质地较软,不利于储存及运输,对品质有较大影响。黏度也是酸奶品质的重要参数,大量实验表明复合发酵酸奶的黏度要大于单菌株发酵,并且嗜热链球菌可明显增强产品的黏性。综合各物性指标发现,实验菌株KLDS1.1011的性能更好。
3 结论
KLDS1.9201是生长速度快、代谢强、产酸速率快的优良发酵酸乳菌株,通过将实验菌株与此菌各项发酵性能对比发现,KLDS1.1011 和 KLDS1.1006 虽然产酸能力略低,但根据GB19302-2010对酸乳制品的酸度大于70°T的要求,这两株菌满足了发酵剂菌种的基本要求,而且在酸奶批量生产时可以与嗜热链球菌搭配,提高前期产酸速率。另外,在4℃冷藏期间两株菌后酸化程度很弱,发酵的酸奶质构较好,具有开发成乳制品发酵剂的潜力。但是,在20℃储藏期间,KLDS1.1006发生的后酸化程度较大,发酵的酸乳硬度偏低,性能不及 KLDS1.1011,故 KLDS1.1011的综合性能更好,对此菌进行深入研究的价值更大。
[1]Ongol M P,Sawatari Y,Ebina Y,et al.Yoghurt fermented by Lactobacillus delbrueckii subsp.Bulgaricus H+-ATPase-defective mutants exhibits enhanced viability of Bifidobacterium breve during storage[J].International Journal of Food Microbiology,2007,116(3):358-366.
[2]郭清泉,张兰威,夏秀芳.酸奶制品发生后酸化主要发酵剂菌确定及性质研究[J].食品与发酵工业,2002,28(4):24-27.
[3]孙懿琳.后酸化保加利亚乳杆菌菌株的筛选及其后酸化机理[D].哈尔滨:东北农业大学,2013.
[4]李艾黎,都立辉,霍贵成.保加利亚乳杆菌分批发酵工艺研究[J].食品工业科技,2006,26(12):57-59.
[5]康欢,郑遂,王伟,等.4株嗜热链球菌产酸和产香力的比较与分析[J].食品科技,2013(1):13-17.
[6]Chammas G I,Saliba R,Corrieu G,et al.Characterisation of lactic acid bacteria isolated from fermented milk“laban”[J].International Journal of Food Microbiology,2006,110(1):52-61.
[7]魏冉冉,方伟,霍贵成.内蒙古优质传统酸牛奶中乳球菌的发酵特性研究[J].现代食品科技,2012,28(11):1459-1462.
[8]Han X,Zhang L,Yu P,et al.Potential of LAB starter culture isolated from Chinese traditional fermented foods for yoghurt production[J].International Dairy Journal,2014,34(2):247-251.
[9]孙懿琳,方伟,田辉,等.保加利亚乳杆菌产酸关键酶的研究[J].食品工业科技,2013,34(10):187-191.
[10]丹彤,包秋华,孟和毕力格,等.发酵乳风味物质乙醛,双乙酰的合成途径及其调控机制[J].食品科技,2012(7):75-79.
[11]邵亚东.传统发酵乳制品中乳酸菌产双乙酰特性的研究[D].呼和浩特:内蒙古农业大学,2007.
[12]Güler Z,Gürsoy-Balcı A C.Evaluation of volatile compounds and free fatty acids in set types yogurts made of ewes’,goats’milk and their mixture using two different commercial starter cultures during refrigerated storage[J].Food Chemistry,2011,127(3):1065-1071.
[13]李勇,欧国兵,田翠芳.优良乳酸菌发酵剂选择的初步探讨[J].实验报告与理论研究,2008,11(5):26-29.
[14]Sahan N,Yasar K,Hayaloglu A A.Physical,chemical and flavour quality of non-fat yogurt as affected by aβ-glucan hydrocolloidal composite during storage[J].Food Hydrocolloids,2008,22:1291-1297.
[15]Lucey J A,Munro P A,Singh H.Whey separation in acid skim milk gels made with glucono-delta-lactone:effects of heat treatment and gelation temperature[J].Journal of Texture Studies,1998,29:413-426.
[16]Casarotti S N,Monteiro D A,Moretti M,et al.Influence of the combination of probiotic cultures during fermentation and storage of fermented milk[J].Food Research International,2014,59:67-75.
[17]Folkenberg D M,Dejmek P,Skriver A,et al.Sensory and rheological screening of exopolysaccharide producing strains of bacterial yoghurt cultures[J].International Dairy Journal,2006,16(2):111-118.

