桑葚酒不同发酵阶段品质及抗氧化物质的变化
黄晓杰,刘禺嘉,田雪瑛,孙 硕,闫 娣
(1.辽宁医学院食品科学与工程学院,辽宁锦州121001;2.辽宁省肉类加工与质量安全控制工程研究中心,辽宁锦州121001)
桑葚(mulberry fruit),又称桑果、桑枣,为桑科落叶乔木桑树的成熟果穗,每年约4~6月份果实成熟[1]。桑葚味甘性寒,酸甜汁多,营养丰富,富含鞣酸、苹果酸、多种维生素和人体必需的氨基酸及锌、钾、镁、磷等微量矿质元素,成熟桑葚含有丰富的花色苷化合物,具有良好的保健功能[2]。桑葚最大弱点是不耐储存,采收后极易失水、变质,进行桑葚深加工研究有利于缓解该产业发展的瓶颈。
桑葚中糖、酸、花色苷等含量均适于酿酒[1],且出汁率高,以桑葚作为原料发酵酿酒,既保存了桑葚中丰富的营养成分和功能性成分,增加了市场上果酒的种类,又可以克服其不耐贮藏性,增加桑葚的附加值,为桑葚的发展提供了广阔的前景。本实验主要研究桑葚酒主发酵、后发酵中品质及抗氧化物质的变化规律,探索桑葚酒发酵过程中品质和抗氧化物质的变化规律。
1 材料与方法
1.1 材料与仪器
桑葚 辽宁锦州产地;酿酒酵母 安琪果酒专用酵母;其它分析试剂均为分析纯。
紫外可见分光光度计 上海精密科学仪器有限公司;5810R冷冻离心机 Eppendorf(中国)公司;电子天平 上海恒平有限公司。
1.2 实验方法
1.2.1 桑葚酒发酵工艺 参照葡萄酒酿造工艺[3]制定了桑葚酒发酵的基本工艺。
桑葚→挑选→清洗→破碎、压榨→加蔗糖调糖度→按照8%接种活化好的活性干酵母(酵母活细胞数量0.4×107cfu/mL)→酒精发酵(发酵温度控制在20~25℃)→分离、澄清→桑葚原酒→成分测定
桑葚酒主发酵期间(前6d)隔天测定理化指标,后发酵期间(6d后)每周测定一次理化指标。
1.2.2 酵母活细胞数 采用梯度稀释法测定酿酒酵母在发酵过程中的酵母活细胞数量的变化。取5mL桑葚果酒酒样,用无菌水梯度稀释后(稀释倍数为100~108),涂布于酵母膏胨葡萄糖琼脂培养基(YPD),在25℃好氧条件下培养72h后计数。
1.2.3 桑葚酒酒精度和糖度测定 酒精度采用酒精计法测定,参照GB/T 15038-2006;糖度计直接测定可溶性固形物含量,参照GB/T 15038-2006。
1.2.4 桑葚酒pH测定 取10mL桑葚酒液,pH计直接测定。
1.2.5 桑葚酒色度和色调的测定 采用梁冬梅[4]等的方法,略有改动,10mL酒样于4℃,10000×g冷冻离心30s,过滤,测其 pH,用相同 pH的磷酸氢二钠-柠檬酸缓冲液稀释n(n的数值由样品吸光度值在准确范围内决定)倍,然后用1cm比色皿在420、520、620nm分别测得其吸光度值。将三波长下吸光度相加即为酒的色度。

1.2.6 桑葚酒总酚和总花色苷的测定 采用Folin-Ciocalteu’s[5]法测定。结果以等价没食子酸表示(g gallic acid/L)。采用Lako等[6]的pH差异法测定果实总花色苷含量,结果以等价矢车菊素-3-葡萄糖苷表示(mg C3G/100mL)表示。
1.2.7 桑葚酒抗氧化活性测定
1.2.7.1 DPPH(1,1-diphenyl-2-picrylhydrazyl)自由基清除力 参照 Larrauri等[7]方法进行测定,测定517nm吸光度,结果按照下式计算,以清除百分率表示。
DPPH自由基清除率(%)=[1-(A1-A3)/A2]×100
式中,A1是4mL DPPH溶液加1mL酒液混合后样液的吸光度;A2是4mL DPPH溶液加1mL乙醇混合后样液的吸光度;A3是4mL乙醇加1mL酒液混合后样液的吸光度。
1.2.7.2 还原力测定 准确量取上清液0.1mL,以蒸馏水为空白,分别加2.5mL磷酸钠缓冲溶液,2.5mL 1%铁氰化钾溶液,混合均匀后,置于50℃水浴中20min后急速冷却。加2.5mL 10%三氯乙酸溶液,混合均匀。取5mL反应液,加5mL蒸馏水和5mL 0.1%氯化铁溶液,混合均匀。于700nm处测量其吸光度A。吸光度值越高表明抗氧化性越强。
1.2.8 光谱分析 检测分析酿造过程中桑葚酒的透射光谱。检测条件:0.1cm石英玻璃杯,连续扫描200~700nm UV-visible谱段,扫描间隔1nm,1600ms取样,双蒸水为空白。
1.3 统计分析
实验结果均为3次平行实验的平均值。采用Excel数据处理软件进行数据分析、绘图。
2 结果与分析
2.1 桑葚酒发酵过程酵母活细胞数量的变化
发酵初期,酿酒酵母对桑葚汁液适应较快,迅速进入繁殖阶段,表现出较强的发酵动力[8]。如图1所示,主发酵结束,酵母细胞数量达到峰值。随着酒精度的升高和可利用的营养素的减少,酵母活力受到抑制,发酵速度减缓,后发酵阶段酵母活细胞数趋于平衡,略有减少。
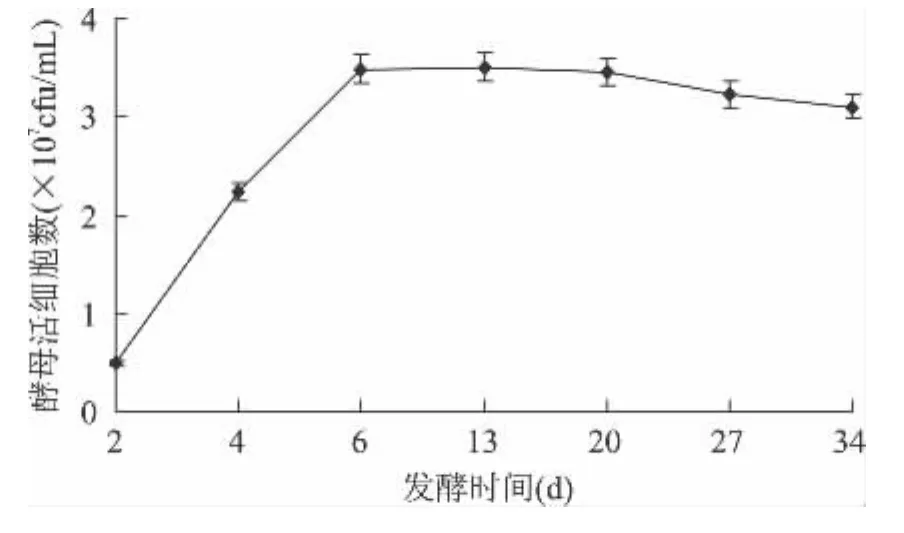
图1 桑葚酒发酵过程中酵母活细胞数量的变化Fig.1 The change of yeast cell number during the fermentation of mulberry wine
2.2 桑葚酒发酵过程酒精度和糖度值的变化
酵母菌将糖发酵生成乙醇、多元醇、乙醛、乙酸和乳酸等风味物质。主发酵阶段,由于酵母代谢旺盛,消耗大量基质,糖度值迅速下降,酒精度持续增加。桑葚酒酒精度在发酵第6d时迅速增加达到10.65%vol(图2),而糖度在发酵第6d时迅速减少到6.87Brix;6d后进入后发酵,由于产生的酒精在一定程度上影响了酵母菌的代谢动力,桑葚酒糖度值趋于稳定而酒精度略有增加,这主要由于酵母菌将糖发酵生成乙醇的过程需要经过诸多中间环节,在糖消耗完后,酵母菌还可以将一些中间产物继续转化为乙醇。
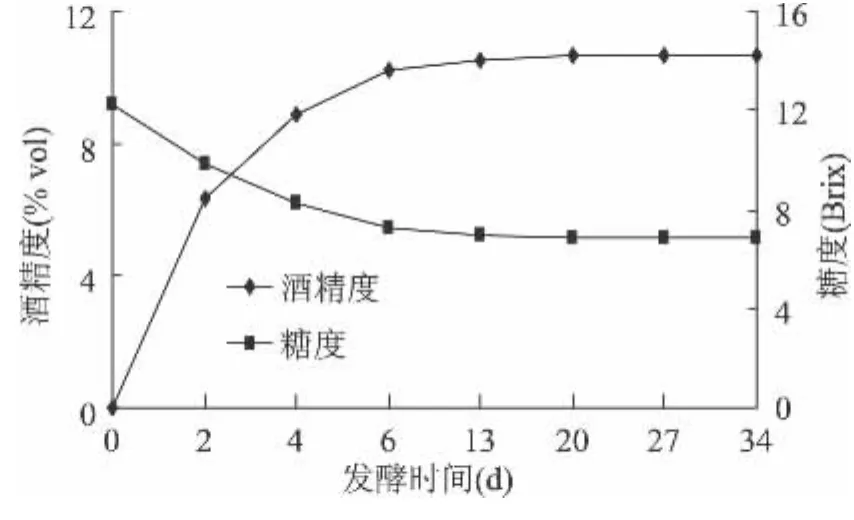
图2 桑葚酒发酵过程中酒精度和糖度值的变化Fig.2 The change of alcohol content and TSS during the fermentation of mulberry wine
2.3 桑葚酒发酵过程pH的变化
图3是桑葚酒发酵过程中pH的变化情况,主发酵阶段桑葚酒pH显著下降,而后趋于稳定,略有波动。发酵初期,碳源供应充分,酵母菌产酸量增加,桑葚酒pH下降;进入后发酵,由于可发酵糖类含量的下降和酵母本身可吸附、絮凝一部分酸性物质[9],pH呈小幅波动。
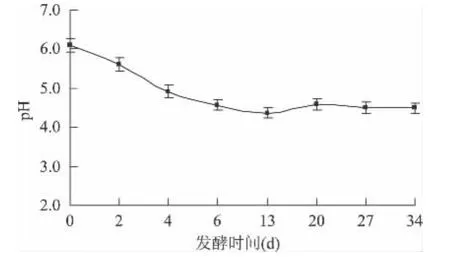
图3 桑葚酒发酵过程中pH的变化Fig.3 The change of pH during the fermentation of mulberry wine
2.4 桑葚酒发酵过程总酚和总花色苷的变化
桑葚酒发酵过程中总酚和总花色苷含量的变化均呈现先上升后下降的趋势。酒精发酵产生的乙醇有利于果肉中酚类和花色苷的溶出[1],主发酵初期(2d)随着酒液酒精度的增加,总酚和总花色苷含量均显著增加,随后由于酵母在生长发酵期间对花色苷进行了降解转化[8],总酚和总花色苷含量逐渐减少,花色苷的降解还与酵母在发酵过程中所产生的β 葡萄糖苷酶[10]和发酵后期酚类物质氧化[11]有关。酚类物质和花色苷赋予桑葚酒特殊的营养价值和色泽,缩短发酵时间有利于桑葚酒中花色苷的保留。

图4 桑葚酒发酵过程中总酚和总花色苷的变化Fig.4 The change of total phenolic and total anthocyanin content during the fermentation of mulberry wine
2.5 桑葚酒发酵过程色度和色调的变化
色度的变化与酒样中花色苷、单宁等酚类物质的变化有关[10],同时,受酒液 pH 等的影响[12]。主发酵初期,桑葚酒色度呈逐渐下降趋势,这与酒液中花色苷等酚类物质的积累有关,而后色度趋于稳定,色度的损失情况与pH变化情况有关,后发酵期间pH(图3)比较稳定,对色度影响小。色调反映各颜色间的变化、转移情况,发酵过程中色调值逐渐减小,色调变化与色度具有一致性,这与发酵石榴酒的变化一致[13]。
2.6 桑葚酒发酵过程抗氧化活性的变化

图5 桑葚酒发酵过程中色度和色调的变化Fig.5 The change of color during the fermentation of mulberry wine
图6是桑葚酒酿造过程中DPPH自由基清除率和还原力的变化情况,DPPH自由基清除率和还原力较为一致地描述了抗氧化活性的变化情况。两指标主发酵阶段均呈现先升高后降低,这与主发酵期间酚类物质和花色苷的变化一致。后发酵阶段,DPPH自由基清除率和还原力逐渐增加,这与后发酵期间酚类物质和花色苷的变化不同,这是因为主发酵阶段产生了大量的乙醇,乙醇的存在增加了酒中酚类物质的生物活性,也提高了酚类物质的抗氧化能力[14]。

图6 桑葚酒发酵过程中总酚和总花色苷抗氧化活性的变化Fig.6 The change of antioxidant activity during the fermentation of mulberry wine
2.7 桑葚酒酿造过程中紫外可见扫描光谱的变化
图7是桑葚酒发酵过程中紫外-可见吸收光谱图,桑葚酒在280、300、360、400nm处有特征吸收峰。酚类物质在300~400nm和240~280nm有两个主要吸收带,而花色苷是酚类成分,其在280nm和520nm左右有两个特征吸收峰,花色苷的紫外吸收光谱在紫外光区有相似的吸收,但是在可见光区的差异较为明显[15]。因此,判定280nm处是酚类和花色苷的吸收峰,300nm处的肩峰说明酒液中的花色苷具有酰基[16],360nm处是各种酚类物质的吸收峰。本实验中桑葚酒的紫外可见光谱520nm处未见明显吸收峰,500~400nm之间逐渐形成一个吸收峰,这可能是因为酒液pH较低,使糖基化的花色苷可见区的吸收波长出现了蓝移[15],与酚类、聚合色素等的吸收峰合并所致。
280~300nm处吸收峰峰值在主发酵阶段没有变化,进入后发酵阶段,由于果渣的分离,峰值显著下降,整个后发酵阶段,峰值维持不变。360、400nm处的吸收峰峰值在整个发酵期间均呈先增大后减小的趋势,发酵第2d吸收峰峰值显著增加,主发酵期间维持较高水平,进入后发酵,吸收峰峰值逐渐降低,这与总酚和总花色苷含量的变化基本一致。

图7 桑葚酒发酵过程中紫外可见扫描光谱的变化Fig.7 The change of UV-visible spectra during the fermentation of mulberry wine
3 结论
桑葚酒主发酵期间,酵母活细胞数量逐渐增大,酒精发酵迅速启动,酒液糖度、pH逐渐下降,酒精度逐渐增加,酒液色度、色调呈下降趋势。由于主发酵期采用“浸渣”方式,果渣中抗氧化物质被浸提出来,总酚、总花色苷含量和抗氧化能力均呈先增加后降低。
后发酵期间,酒精发酵结束,进入苹果酸-乳酸发酵,桑葚酒大部分理化指标趋于稳定。由于酚类物质的氧化和花色苷的聚合作用,后发酵期间,总酚和总花色苷含量持续减少,由此可见,缩短发酵时间,有利于酚类物质的保留。但是,桑葚酒中乙醇的增加,提高了酚类物质的抗氧化能力,后发酵期间,桑葚酒抗氧化活力逐渐增大,因此,发酵34d时,桑葚酒的抗氧化活力最高。
本文描述了整个发酵期间桑葚酒的紫外可见图谱,图谱中特征峰的变化与总酚和总花色苷含量的变化大体一致,接下来,我们拟进一步研究利用紫外可见扫描来判断酒样中抗氧化物质的变化的可能性。
[1]陈莹.桑葚酒的发酵工艺及酚酸抗氧化研究[D].西安:西北大学,2011.
[2]霍宪起.正己醇处理对桑葚采后生理与抗氧化酶的影响[J].食品科学,2012,33(6):252-255.
[3]吴志明,陈亮,李双石.赤霞珠葡萄酒发酵过程中总酚和花色苷的含量变化[J].酿酒科技,2011,233(11):18-20.
[4]梁冬梅,李记明,林玉华.分光光度法测葡萄酒的色度[J].中外葡萄与葡萄酒,2002,3:10-13.
[5]Cheng GW,Breen PJ.Activity of phenylalanine ammonialyase(PAL)and concentration of anthocyanins and phenolics in developing strawberry fruit[J].J Am Soc Hort Sci,1991,116:865-869.
[6]Lako J,Trenerry VC,Wahlqvist M,et al.Phytochemical flavonols,carotenoids and the antioxidant properties of a wide selection of Fijian fruit,vegetables and other readily available foods[J].Food Chemistry,2007,101(4):1727-1741.
[7]Larrauri JA,Sanchez-Moreno C,Saura-Calixto F.Effect of temperature on the free radical scavenging capacity ofextracts from red and white grape pomace peels[J].J Agric Food Chem,1998,46:2694-2697.
[8]赖剑峰.桑椹酒发酵过程中花青素的生物转化研究[D].南昌:江西农业大学,2013.
[9]李国薇.苹果品种及酵母菌种对苹果酒品质特性影响的研究[D].杨凌:西北农林科技大学,2013.
[10]范龚健,龚小峰,杨振东,等.紫玉米醋酸发酵过程中色泽变化及其花色苷组分分析[J].南京农业大学学报,2009,32(4):176-179.
[11]王胜利,李国薇,樊明涛.猕猴桃酒酿造过程中多酚及抗氧化性的研究[J].酿酒科技,2010(10):55-58.
[12]胡冀太.不同工艺及酵母对山楂酒发酵过程及成品酒品质的影响[D].泰安:山东农业大学,2012.
[13]庄惠婷,杜金华,郭春宝,等.发酵石榴酒的色泽变化[J].食品与发酵工业,2011,37(3):113-117.
[14]李光宇,彭丽萍.葡萄酒中主要的多酚类化合物及其作用[J].酿酒,2007,34(4):60-61.
[15]徐渊金.杨梅和桑椹花色苷的提取分离、结构鉴定及其生物活性研究[D].杭州:浙江工商大学,2007.
[16]刘玉芹.六种紫色蔬菜中花色苷的定性定量分析及抗氧化活性研究[D].济南:山东农业大学,2011.

