miR-148a对肝癌细胞株侵袭和迁移的抑制作用及机制
贾筱琴 缪俊俊 雍军 张子兰 花晨 李国利
扬州大学医学院病理学教研室,江苏 扬州225009
原发性肝癌是肝细胞或肝内胆管上皮发生的恶性肿瘤。尽管其治疗方法有了很大进步,但其复发和转移仍十分常见[1]。因此,探索肝癌侵袭转移机制,寻找新的临床治疗靶点,在肝癌的治疗中具有重要意义。
有研究证实,肝癌组织中E-cadherin表达降低、vimentin表达增高和肝癌的转移具有明显的相关性[2]。microRNA表达谱芯片结果表明miRNA-148a在肝癌伴转移组中表达显著下 调[1]。本实验通过构建稳定表达miR-148a的肝癌细胞株,探讨其对SMMC-7721侵袭和迁移能力的影响。
1 材料和方法
1.1 试剂
RPMI-1640购自美国Gibco公司;胎牛血清购自杭州四季青公司;反转录试剂盒、PCR试剂盒购自TaKaRa公司;蛋白提取试剂盒、ECL检测试剂盒、BCA蛋白含量检测试剂盒、MMP-2抗体、MMP-9抗体购自南京凯基公司;E-cadherin抗体、vimentin抗体购自Santa Cruz公司; Transwell小室购自Millipore公司;GV-254-LV购自上海吉凯公司。
1.2 方法
1.2.1 慢病毒的构建
制备编码慢病毒颗粒的GV-254-LVmiR-148重组载体、对照载体及两种辅助包装原件载体质粒,分别进行高纯度无内毒素抽提,进行共转染293T细胞,转染后8 h更换为完全培养基,培养48 h后,收集富含慢病毒颗粒的细胞上清液,对其浓缩后得到高滴度的慢病毒浓缩液,在293T细胞中测定并标定病毒滴度。
1.2.2 慢病毒感染及半定量RT-PCR检测感染效率
miR-148a病毒上清液和对照组(5 μL)分别加入处于对数生长期的SMMC-7721肝癌细胞,感染48 h后,荧光显微镜观察细胞状态和GFP表达情况。收集生长状态良好的目的细胞,应用TRIzol等提取RNA,并反转录成cDNA采用半定量RT-PCR法检测miR-148a的表达情况。反应条件:95 ℃ 5 min变性后,共进行40个循环扩增,每1个循环包括95 ℃ 5 s、60 ℃ 30 s。
1.2.3 Transwell小室法检测细胞侵袭能力
在冰上向无血清培养基中加入人工基底膜混匀,加入上室,放入37 ℃培养箱中温育 4~5 h,然后消化细胞配成105/mL悬液,用无血清培养基洗人工基底膜,把制好的细胞悬浮液加入上室,下室中加入含10%血清的培养基,37 ℃温育20~24 h,取出Transwell小室用PBS洗2遍,5%戊二醛固定,加入苏木素染色,PBS洗后拭去上室细胞,显微镜观察计数。
1.2.4 细胞划痕实验检测细胞迁移能力
将肝癌细胞接种于6孔板中,待细胞达到80%~90%融合时,吸掉培养基并用PBS洗3次,用10 μL枪头沿着培养板中央划一横线,加入无血清培养基继续培养,分别在0、6、24、 36 h时于倒置显微镜下观察细胞运动情况并拍照 记录。
1.2.5 明胶酶谱法检测细胞MMP-2、MMP-9的活性
提取对数期SMMC-7721肝癌细胞的蛋白,经浓缩胶、分离胶100 V 1.5 h电泳,洗脱,漂洗,37 ℃温育42 h,考马斯亮蓝染色、脱色,出现蓝色背景的透明带,通过分析条带面积、宽度和灰度值得出结果。
1.2.6 蛋白质印迹法(Western blot)检测细胞MMP-2、MMP-9、E-cadherin和vimentin的 表达
采用全蛋白提取试剂盒提取各组细胞蛋白,并进行定量。按照每孔50 μg总蛋白进行SDS-PAGE电泳,然后将蛋白转印到PVDF膜上,用含5%脱脂奶粉的PBST封闭1 h,加入1∶400稀释一抗4 ℃过夜,二抗37 ℃温育1 h,Bio-Rad凝胶成像系统采集图像,Quantity one软件进行灰度值分析,每组实验重复3次。
1.3 统计学处理
2 结 果
2.1 表达miR-148a慢病毒稳定细胞株的建立
慢病毒颗粒的GV-254-LV-miR-148重组载体、对照载体及两种辅助包装原件载体质粒共同转染293FT病毒包装细胞,48 h后收集富含慢病毒颗粒的细胞上清液,对其浓缩后得到高滴度的慢病毒浓缩液,进一步感染7721肝癌细胞,经过嘌呤霉素筛选后获得7721稳定株,为LV-miR-148a组和LV-miR-control组(图1、2)。
2.2 慢病毒感染后的肝癌细胞表达miR-148a明显增高
肝癌细胞慢病毒感染组中miR-148a与U6条带密度比值明显高于对照组中miR-148a与U6条带密度比值,表明感染组中miR-148a表达明显升高,说明感染后肝癌细胞miR-148a表达明显增高,差异有统计学意义(P<0.01,图3)。
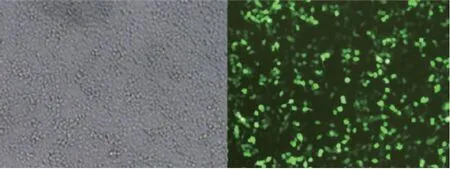
图1 目的质粒转染293T细胞图片Fig. 1 The pictures of 293T cells infected with target plasmid
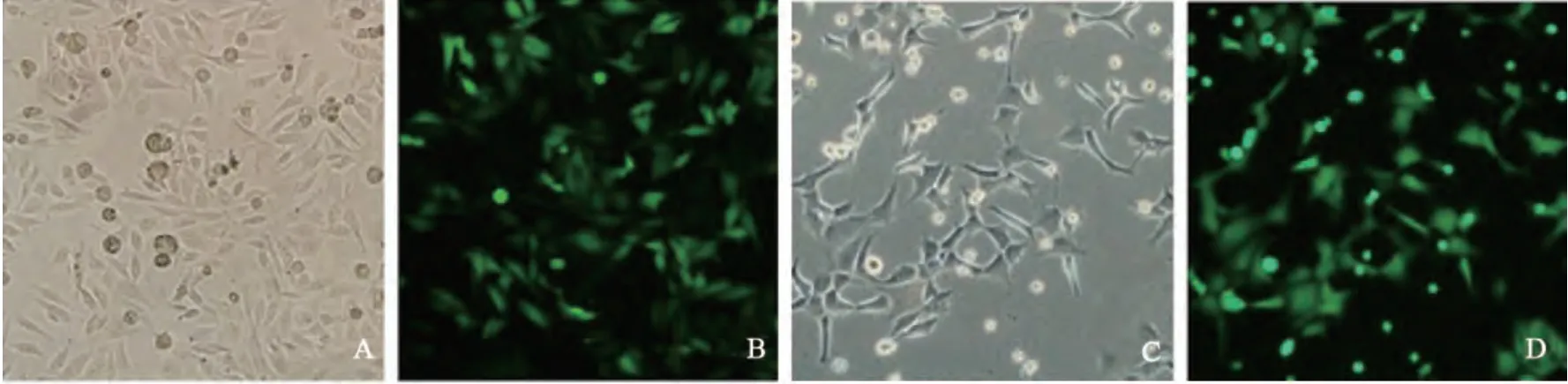
图2 表达miR-148a慢病毒稳定细胞株的建立Fig. 2 The pictures of SMMC-7721 infected with lentivirus
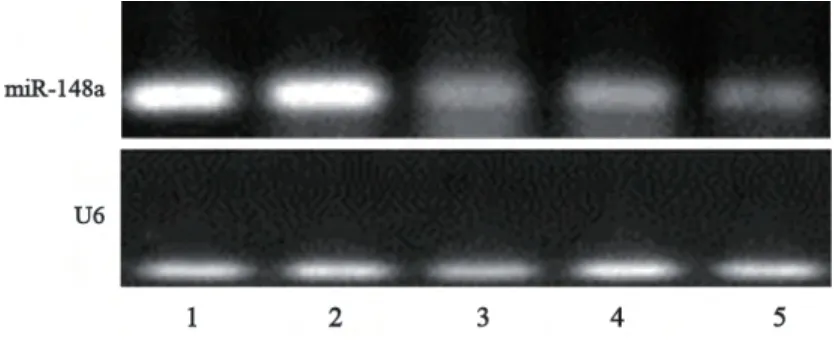
图3 RT-PCR法检测miR-148a的表达Fig. 3 The expression of U6 and miR-148a in LV-miR-control group and LV-miR-148a group
2.3 肝癌细胞过表达miR-148a后,其迁移能力明显下降
细胞划痕实验结果显示,在划痕6、24、 3 6 h 后感染组划痕区域相对宽度分别为85.78%、78.26%、68.12%,对照组划痕区域相对宽度分别为80.23%、73.68%、40.05%。划痕后36 h感染组细胞的两端距离与对照组相比明显较宽,且差异有统计学意义(P<0.05,图4)。表明肝癌细胞过表达miR-148a后,导致其迁移能力明显下降。
2.4 肝癌细胞过表达miR-148a后,其侵袭能力明显下降
侵袭实验结果显示,过表达miR-148a的肝癌细胞侵袭能力明显低于对照组。穿越滤膜的细胞的多少反映了细胞侵袭能力的高低。慢病毒感染肝癌细胞组穿膜细胞数(18.30±2.10)个,较LV-miR-control对照组(62.40±2.5)个明显减少,差异有统计学意义(P<0.05,图5),表明稳定表达的miR-148a能够抑制7721细胞的侵袭 能力。
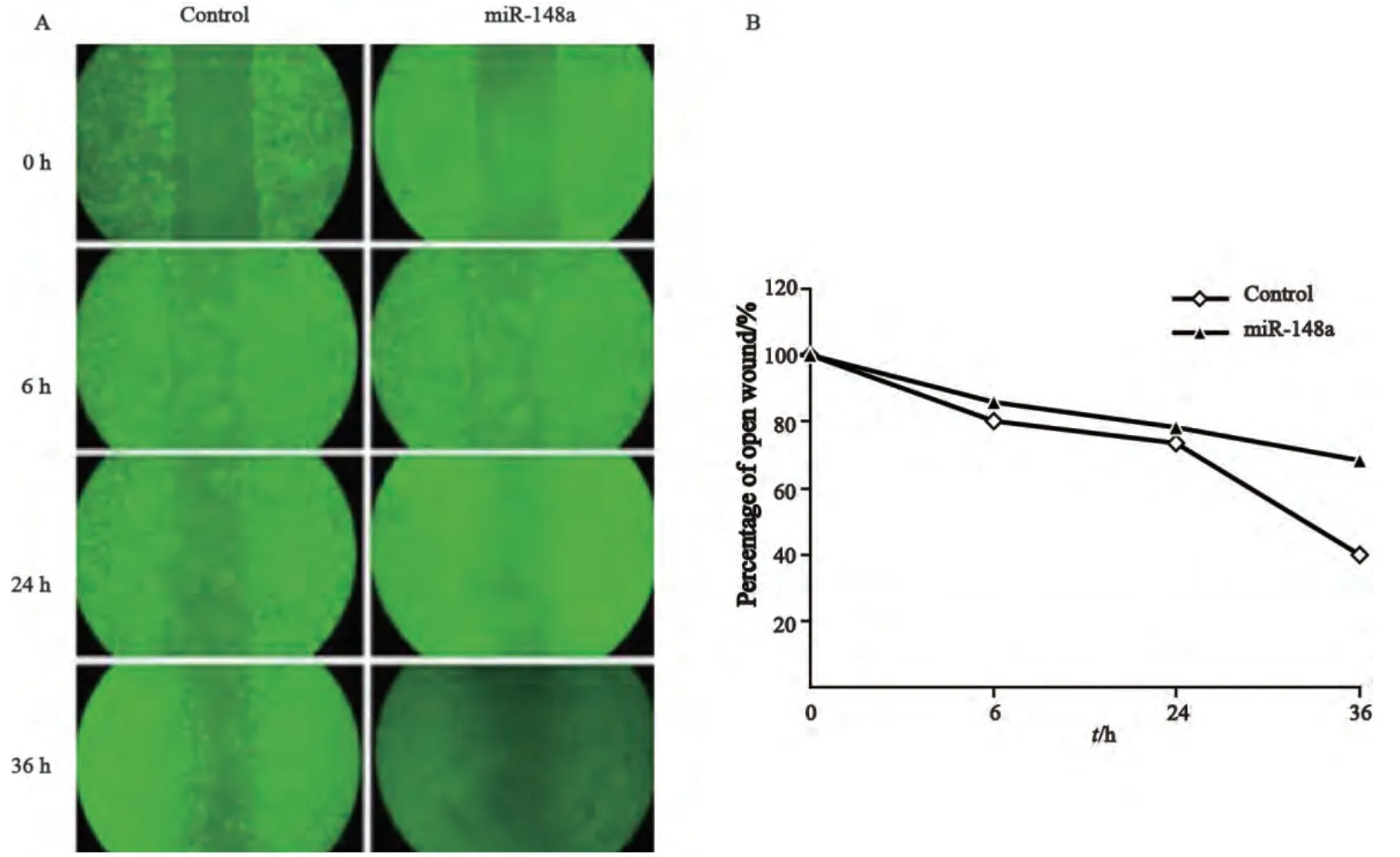
图4 过表达miR-148a对7721肝癌细胞迁移能力的影响Fig. 4 The effects of miR-148a on the migration capicity of 7721 cells
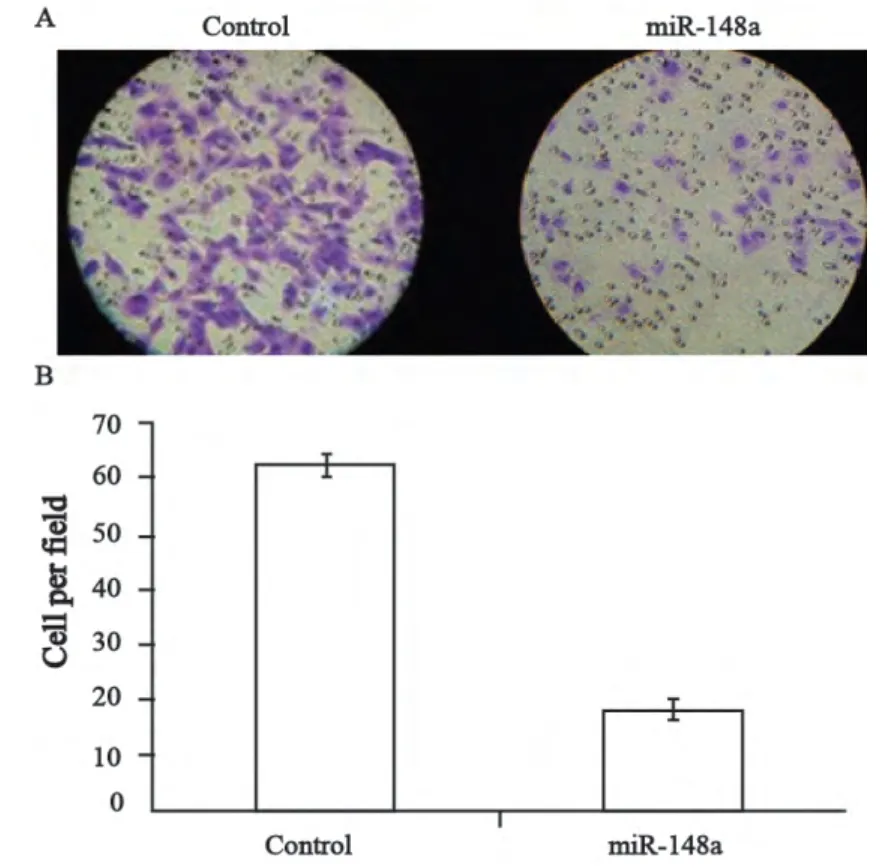
图5 过表达miR-148a对7721肝癌细胞侵袭能力的影响Fig. 5 The effects of miR-148a on the invasion ability of 7721 cells
2.5 肝癌细胞过表达miR-148a后,MMP-2和MMP-9降解明胶的能力下降
明胶酶谱结果显示,和LV-miR-control对照组相比,MMP-2和MMP-9降解明胶的能力下降 (图6)。

图6 过表达miR-148a对7721肝癌细胞MMP-2和MMP-9活性的影响Fig. 6 The effects of miR-148a on the activity of MMP-2 and MMP-9 of 7721 cells
2.6 肝癌细胞过表达miR-148a后,其vimentin、MMP-2和MMP-9的蛋白表达降低,但并未影响E-Cadherin的表达
WB结果显示过表达miR-148a的肝癌细胞vimentin、MMP-2和MMP-9的蛋白表达明显低于对照组,但并未影响E-cadherin的表达 (图7、8)。
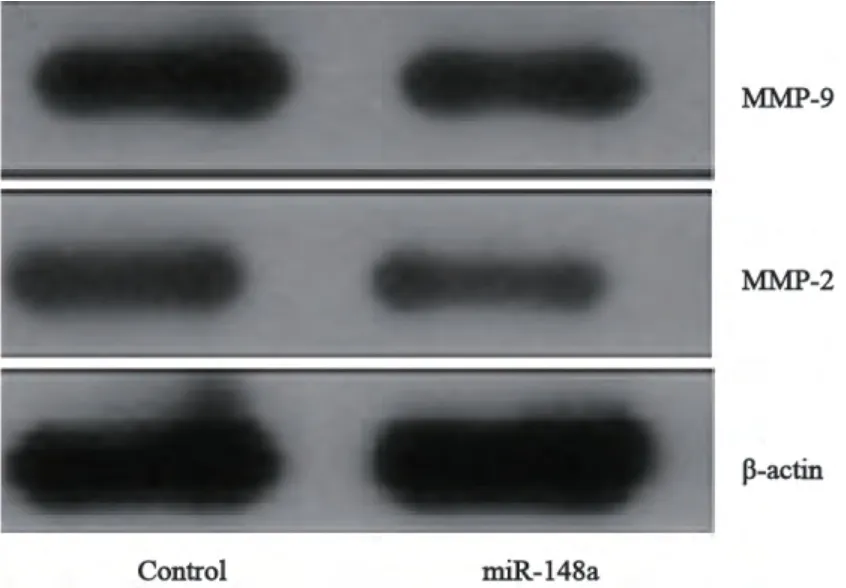
图7 Western blot检测过表达miR-148a 后MMP-2、MMP-9蛋白表达量的变化Fig. 7 The expression of MMP-2, MMP-9 proteins detected by Western blot
3 讨 论
MiR-148a是近年来新发现的一种高度保守的miRNA,前体序列位于人类第七号染色体短臂1区5带,Budhu等[3]报道miR-148a在HCC下调表达并且与HCC转移及生存率相关。Suzuki等[4]也报道miR-148a在肝癌转移细胞系下调表达。国内复旦大学肝癌研究所microRNA表达谱芯片结果也证实miR-148a在肝癌组织低表达,并且在高低转移潜能细胞系MHCC97H和MHCC97L间表达差异有统计学意义[5]。miR-148a与肝癌的发生、发展、预后密切相关,但其在肝癌侵袭转移中的作用及分子机制尚不清楚。本研究结果显示,过表达miR-148a能够明显抑制SMMC-7721肝癌细胞的侵袭和迁移.
肿瘤细胞释放蛋白溶解酶、降解细胞外基质是肿瘤侵袭和转移的重要环节。肿瘤细胞分泌产生的基质金属蛋白酶以无活性的酶原形式而存在,经锌离子参与的激活过程后能降解细胞外基质中的各种蛋白成分,能够水解基底膜和基质成分,在肿瘤侵袭转移中起关键性作用。MMP-2、MMP-9是金属蛋白酶家族的成员,其表达的增加有利于肿瘤细胞的生长、浸润和转移[6-7]。本研究结果显示,过表达miR-148a肝癌细胞SMMC-7721的MMP-2、MMP-9的活性降低,表明miR-148a可能通过调节MMP-2、MMP-9的表达,从而降低其活性,改变肿瘤细胞体外侵袭能力。
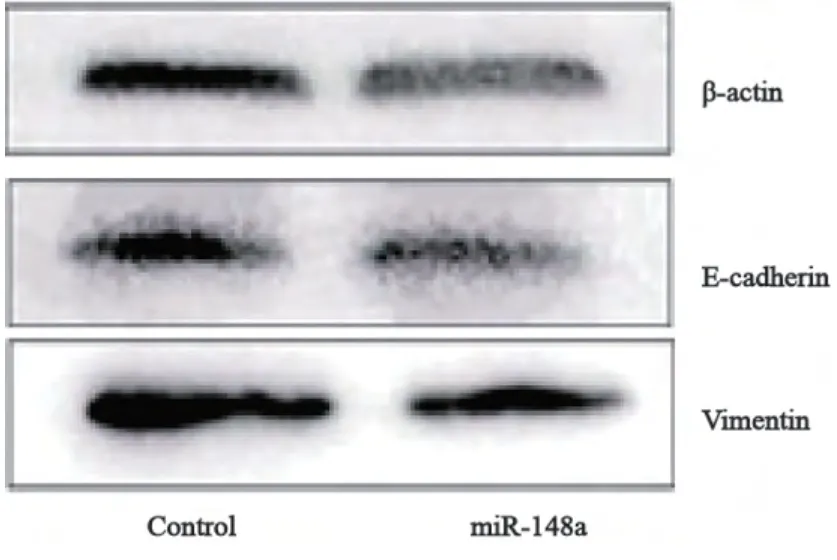
图8 Western blot检测过表达miR-148a 后E-cadherin和vimentin蛋白表达量的变化Fig. 8 The expression of E-cadherin, vimentin proteins detected by Western blot
肿瘤转移涉及多种调控机制,其中促进肿瘤转移的重要机制之一就是上皮间质转化(epithelial-mesenchymal transition,EMT),EMT在肿瘤的侵袭转移中具有重要的作用。EMT是指上皮细胞在特定的情况下向间质细胞转分化的现象,其主要的特征为上皮细胞黏附分子 (如E-cadherin)表达的丧失,并获得间质细胞的特性(成纤维细胞样的外形,vimentin的重新表 达)。在肿瘤转移过程中,这种表型的转换允许肿瘤细胞摆脱细胞-细胞间连接,使肿瘤细胞更易于侵袭和转移[8-9]。Vimentin是细胞中间丝的一种蛋白,多表达于间叶肿瘤中,研究证实vimentin表达的增加有助于肿瘤的侵袭和转 移[10]。本实验研究结果显示,过表达miR-148a能降低SMMC-7721肝癌细胞中vimentin的表达,但并未影响E-cadherin的表达。Brabletz 等[10]研究发现,EMT在肿瘤的发展过程中可能是一个瞬时的、可以被微环境调节逆转的现象,在肿瘤发展的某个阶段并不一定能捕捉到完全EMT现象。Shintani等[11]和Voulgari 等[12]也分别报道培养中的肿瘤细胞发生不完全EMT,发生不完全EMT的肿瘤细胞,其分子标志物和细胞特征可发生不同程度的改变。实验结果表明miR-148a抑制SMMC-7721肝癌细胞侵袭和迁移的功能,部分可能是通过调控vimentin的表达来完成。
综上所述,miR-148a的表达与肿瘤的侵袭和迁移密切相关,可能通过调节vimentin、MMP-2和MMP-9的表达,降低MMP-2和MMP-9的活性,改变了肿瘤细胞体外侵袭和迁移能力。另一方面,miR-148a可能通过调控转移相关靶基因的表达而抑制肿瘤细胞的侵袭和迁移能力,关于此方面机制,还有待深入研究。进一步明确miR-148a在肝癌侵袭转移中的分子机制,从而为肝癌的治疗提供实验依据。
[1]RAMPONE B, SCHIAVONE B, MARTINO A, et al. Current management strategy of hepatocellular carcinoma [J]. World J Gastroenterol, 2009, 15(26): 3210-3216.
[2]周顺, 贾筱琴, 喻春钊, 等. 上皮间质转化相关蛋白在肝细胞肝癌组织中的表达鉴定及其小分子RNA表达谱的研究 [J]. 中华实验外科杂志, 2011, 28(1): 68-71.
[3]BUDHU A, JIA H L, FORGUES M, et al. Identification of metastasis-related microRNAs in hepatocellular carcinoma [J]. Hepatology, 2008, 47(3): 897-907.
[4]SUZUKI M, YOSHINO I. Identification of microRNAs caused by DNA methylation that induce metastasis [J]. Future Oncol, 2008, 4(6): 775-777.
[5]赵越, 贾户亮, 周海军, 等. 肝癌转移相关的微小RNAs在不同转移潜能肝癌细胞系的定量研究 [J]. 中华肝脏病杂志, 2009, 17(7): 526-530.
[6]GAO J, DING F, LIU Q, et al. Knockdown of MACC1 expression suppressed hepatocellular carcinoma cell migration and invasion and inhibited expression of MMP-2 and MMP-9 [J]. Mol Cell Biochem, 2013, 376(1-2): 21-32.
[7]HAGEMANN C, ANACKER J, ERNESTUS R I, et al. A complete compilation of matrix metalloproteinase expression in human malignant gliomas [J]. World J Clin Oncol, 2012, 3(5): 67-79.
[8]THOMPSON E W, NEWGREEN D F, TARIN D. Carcinoma invasion and metastasis: a role for epithelial-mesenchymal transition [J]. Cancer Res, 2005, 65(14): 5991-5995.
[9]THIERY J P, ACLOQUE H, HUANG R Y, et al. Epithelialmesenchymal transitions in development and disease [J]. Cell, 2009, 139(5): 871-890.
[10]BRABLETZ T, HLUBEK F, SPADERNA S, et al. Invasion and metastasis in colorectal cancer: epithelial-mesenchymal transition, mesenchymal-epithelial transition, stem cells and beta-catenin [J]. Cells Tissues Organs, 2005, 179(1-2): 56-65.
[11]SHINTANI Y, MAEDA M, CHAIKA N, et al. Collagen Ⅰ promotes epithelial-to-mesenchymal transition in lung cancer cells via transforming growth factor-beta signaling [J]. Am J Respir Cell Mol Biol, 2008, 38(1): 95-104.
[12]VOULGARI A, PINTZAS A. Epithelial-mesenchymal transition in cancer metastasis: mechanisms, markers and strategies to overcome drug resistance in the clinic[J]. Biochim Biophys Acta, 2009, 1796(2): 75-90.

