EBV阳性淋巴瘤组织中EBNA1基因多态性研究
车奎 王笑峰 王云 邢晓明 罗兵
1.青岛大学医学院微生物教研室,山东 青岛266021;
2.青岛大学医学院附属医院病理科,山东 青岛 266003
EBV与多种人类肿瘤的发生有关,如伯基特淋巴瘤(Burkitt's lymphoma,BL)、霍奇金病(Hodgkin's disease,HD)、鼻咽癌(nasopharyngeal carcinoma,NPC)以及胃癌 等[1]。EBV潜伏感染和细胞转化能力被广泛认为是其致癌的基础,目前已知EBV多种潜伏期基因编码产物可引起细胞转化,其中核抗原家族基因(EBNAs)编码产物中的EBNA1是唯一在所有EBV相关肿瘤中均表达的蛋白,当病毒潜伏感染时,其在基因组的维持、复制和转录过程中发挥重要作用[2]。EBNA1重复序列可通过顺式作用方式抑制抗原递呈细胞对自身的加工处理,使CTL不能识别自身免疫表位从而逃避机体免疫应答[3]。EBNA1由N端(AA 1-89)、甘氨酸和丙氨酸重复序列(AA 90-327)以及C端(AA 328-641)组成,对EBNA1基因变异的分析多集中在C端。Bhatia等[4]和Gutiérrez等[5]根据突变热点AA487的变化及AA466-527之间的变异,将EBNA1基因分为P-ala、P-thr、V-val、V-leu和V-pro 5种亚型。本研究对EBV阳性淋巴瘤组织中EBNA1编码基因多态性进行了检测和分析,旨在探讨EBNA1多态性在EBV阳性淋巴瘤发生中的意义。
1 材料和方法
1.1 研究对象
332例淋巴瘤石蜡包埋组织标本取自2009年1月—2012年12月间在青岛大学医学院附属医院就诊的患者,所有病例均经病理检查确诊,其中包括结外NK/T细胞(鼻型)淋巴瘤、弥漫性大B细胞淋巴瘤、外周T细胞淋巴瘤以及混合细胞型淋巴瘤等。
采用原位杂交技术检测淋巴瘤组织中EBV编码小RNA1(EBV-encoded small RNA1,EBER1),EBER1特异性寡核苷酸anti-sense和sense探针按参考文献[6]设计,EBER1阳性者确定为EBV阳性淋巴瘤标本。从332例淋巴瘤标本中共鉴定选择出EBV阳性淋巴瘤60例用于EBNA1编码基因多态性的检测。
1.2 DNA提取及聚合酶链式反应
采用酚、氯仿-异戊醇法常规提取EBV阳性细胞系B95-8和EBV阴性细胞系Ramos细胞DNA,QIAamp FFPE(formalin-fixation and paraffin-embedding)DNA提取试剂盒(QIAGEN GmbH,Hilden,Germany)提取石蜡包埋组织DNA。
依据B95-8序列(基因序列号:V01555.1),应用Primer premier 5软件设计扩增EBNA1基因的引物(表1)。EBNA1-1和EBNA1-2为第1轮外侧扩增引物,扩增片段为843 bp,EBNA1-3和EBNA1-4为第2轮扩增引物,扩增片段为 745 bp。第1轮PCR反应体系为25 μL,包括10×Buffer 2.5 μL,MgCl21.5 mmol/L,dNTPs 0.2 mmol/L,上下游引物各0.5 μmol/L,高保真Taq DNA聚合酶[购自宝生物工程 (大连)有限公司]1.0 U,DNA模板100 ng。循环条件为 94 ℃预变性5 min;然后94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共扩增35个循环;最后72 ℃延伸10 min。第1轮PCR产物经1∶20~1∶100稀释后取2 µL为第2轮内侧PCR模板,反应体积为50 μL,各试剂终浓度及循环条件同第1轮扩增,取3 μL PCR产物于2%琼脂糖凝胶中电泳检测。
每次PCR反应均设水对照、阴性对照和阳性对照,阳性对照为EBV阳性细胞系B95-8 DNA,阴性对照为EBV阴性细胞系Ramos DNA。
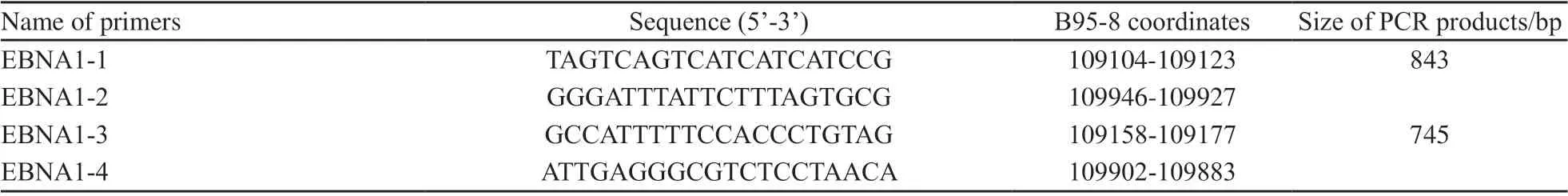
表1 EBV潜伏期基因EBNA1序列多态性所用引物序列Tab. 1 List of primers for latent gene EBNA1
1.3 DNA序列分析
取上述第2轮PCR产物45 μL送北京华大基因有限公司进行双向测序,测序所用引物为第2轮PCR循环引物。采用Chromas软件查看所获序列峰图文件,DNAStar软件(Larsergene,version 7.0)进行序列剪接和对比分析,并与B95-8原型株(GenBank登录号V01555)序列及基因库中相关序列共同进行对比分析。
1.4 统计学处理
应用SAS 6.12软件,采用行×列表χ2检验及精确概率法分析淋巴瘤标本间EBNA1变异型,P<0.05为差异有统计学意义。
2 结 果
本研究中有51例EBV阳性淋巴瘤标本EBNA1编码基因C-端序列(核苷酸109159-109875)多态性分析成功,其编码产物为AA404-641,该段序列包含了几乎所有以往研究中发现的突变位点[5,7-8]。综合以往大多数研究,根据突变热点AA487及AA 466-527之间的变异,并与B95-8毒株比较,将EBNA1基因分为2种原型(Prototype,包括P-ala和P-thr,P-ala即B95-8)和3种变异型(Variant,包括V-val、V-leu和V-pro),5种亚型487位点的AA分别为丙氨酸、苏氨酸、缬氨酸、亮氨酸和脯氨酸[4-5]。
与标准株B95-8相比,全部51例EBV阳性淋巴瘤组织标本中EBNA1 C端均出现序列变异。除P-thr变异型在其109834碱基序列后有9个核苷酸插入,其余所有突变均为单核苷酸突变(图1)。
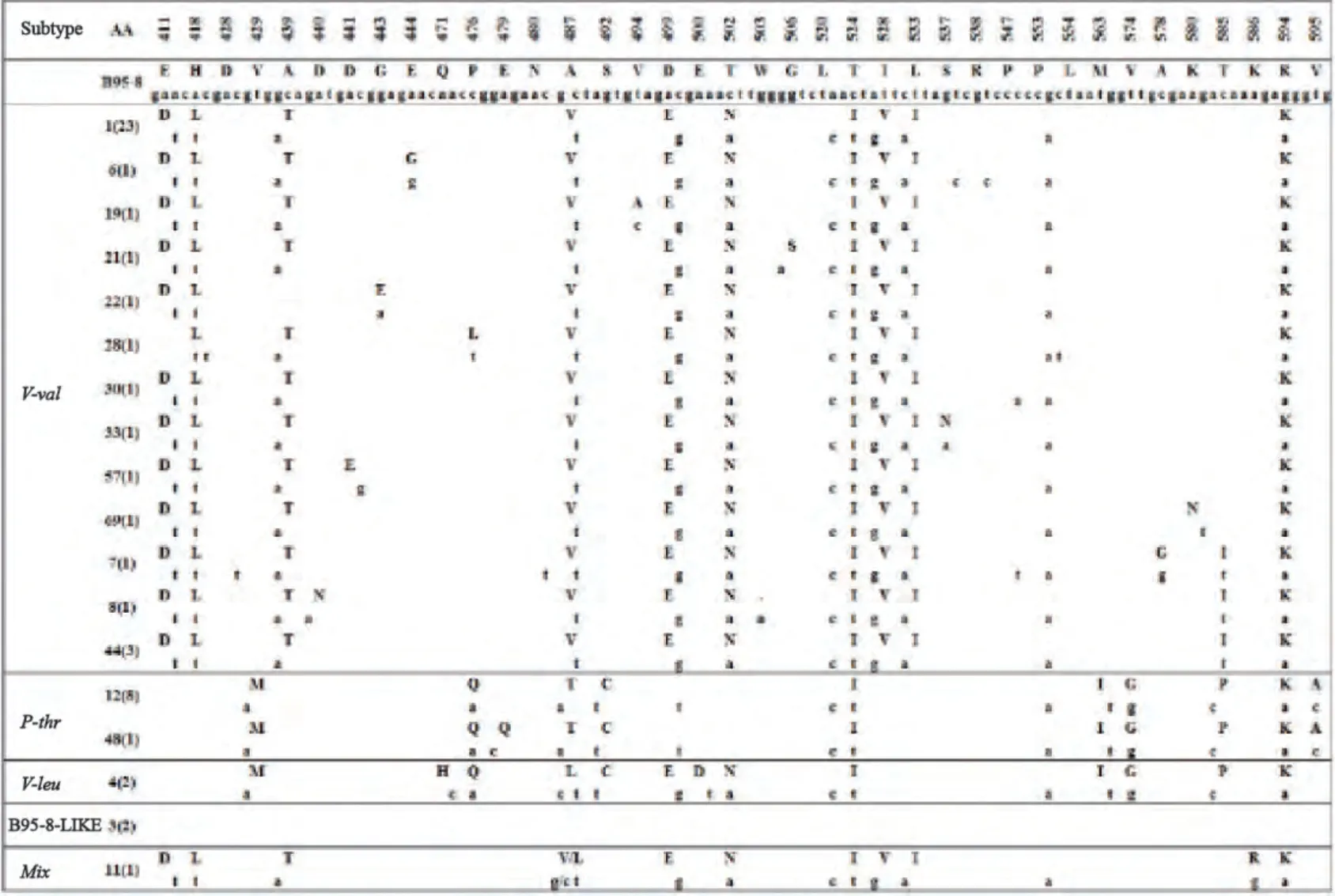
图1 EBNA1 C末端基因变异Fig. 1 EBNA1 sequence variations in lymphoma
72.6%(37/51)的EBV阳性淋巴瘤属于V-val变异类型,该变异类型包含12个共有突变,包括10个错义突变和2个无义突变,错义突变包括AA 411 E→D、418 H→L、439 A→T、487 A→V、499 D→E、502 T→N、524 T→I、528 I→V、533 L→I和594 R→K,无义突变为AA 520密码子CAT→CTC和553密码子CCG→CCA。有2例EBV阳性淋巴瘤组织在共有突变位点存在不同突变,其中1例AA411位点未发生突变(L28),另1例未检测到AA439位点突变(L22)。除上述12个共有突变外,40.5%(15/37)的病例组织中还检测到其他散在的突变位点。
17.7%(9/51)变异类型为P-thr型,该变异类型有13处共有突变和9个碱基插入,包括10个错义突变和3个无义突变,10个错义突变包括AA 429 V→M、476 P→Q、487 A→T、492 S→C、524 T→I、563 M→I、574 V→G、585 T→P、594 R→K和595 V→A,3个无义突变包括AA 499密码子GAC→GAT、520 CTA→CTC和553 CCG→CCA。在其109834碱基序列后有9个碱基(ACGGAGATG)的插入是P-thr变异型的另一特征。此外病例L48在AA 479发生不同的突变,由E突变为Q。
第3种变异类型为V-leu型,3.9%(2/51)的EBV阳性淋巴瘤组织中可以检测到该变异类型。其含有15个共有突变,3处突变(AA 471 Q→H、487 A→L和500 E→D)仅见于该变异类型,6处突变(AA 429、476、492、563、574和585)与P-thr相同,2处突变(AA 499和502)与V-val相同,另外4处突变(AA520、524、553和594)与P-thr和V-val均 相同。
3.9%(2/51)变异类型和B95-8一致,即为P-ala型。
有1例淋巴瘤组织标本的测序峰图在共有突变位点出现2种亚型的特征性突变,经过反复测试,最后鉴定为混合感染。L11在突变位点AA 487位点(A→V和A→L)及其他多个共有突变位点存在套峰(图2),其是V-val和V-leu的混合型。
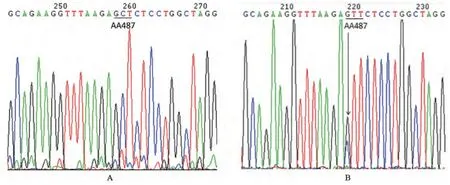
图2 EBNA1不同亚型混合感染测序图Fig. 2 Sequence analysis for multiple infection of different EBNA1 subtypes
3 讨 论
本研究我们在青岛地区EBV相关淋巴瘤中检测到V-val、P-thr、V-leu和P-ala等4种EBNA1亚型,其中V-val是该地区最常见的变异类型。通过对比我们前期检测鼻咽癌、EBV相关胃癌(EBV-associated gastric carcinoma,EBVaGC)和健康人咽漱液中EBNA1基因亚型的分布情况结果显示,V-val既是EBV阳性淋巴瘤组织中的主 要亚型,也是鼻咽癌、EBVaGC、健康人咽漱液中的主要亚 型[8]。3种EBV相关肿瘤组织中均可检测到P-thr和V-leu亚型;且不同EBV相关肿瘤组织中EBNA1基因亚型的分布差异无统计学意义。研究结果证实,与我们在EBVaGC或NPC检测到的EBNA1亚型相似,EBV阳性淋巴瘤组织中EBNA1亚型分布也与该地区健康人群中的亚型一致,提示在EBV阳性淋巴瘤等EBV相关肿瘤发生过程中不存在对某一特定EBNA1亚型毒株的选择倾向性,即EBNA1变异亚型与EBV相关肿瘤发生无明显相关性。值得注意的是,本组病例中有3.9%淋巴瘤(2/51)组织检测到P-ala亚型,而我们前期未在鼻咽癌和EBVaGC患者组织中检测到该亚型,57例健康人中有1例该亚型阳性(1.8%),其在淋巴瘤发生中的意义有待进一步研究[8]。
该结果与亚洲地区的相关研究结果一致,而在非洲,美洲和欧洲,EBV相关肿瘤中很少检测到V-val亚型,P-thr、V-leu和P-ala则是常见的亚型[6-7,9-16]。P-thr和P-ala在欧洲和北美检出率较高,而P-thr和V-leu则在非洲和南美洲检出率较高[14]。Sandvej等[7]对中国地区3例鼻咽癌、3例霍奇金病、2例T细胞淋巴瘤以及5例健康人咽漱液标本中EBNA1基因多态性进行了检测,发现V-val和P-thr亚型的检出率分别为76.9%(10/13)和23.1%(3/13);而来自丹麦的11例鼻咽癌、10例霍奇金病和8例健康人咽漱液中并未检测到V-leu亚型。Chen等[16]检测了日本地区25例EBVaGC标本,发现全部标本均为V-val型,而来自美国的17例EBVaGC标本中,有3例为P-ala型,9例为P-thr型,4例为V-leu型,仅有1例为V-val型。Habeshaw等[9]检测了12例来自非洲的Burkitt淋巴瘤标本,发现有5例为P-thr亚型,7例为V-leu亚型,未检测到亚洲地区最为常见的V-val亚型。上述研究结果提示,EBNA1基因变异可能受地域限制,而非疾病相关。Nie等[17]对来自同一NPC患者配对癌组织和咽漱液EBV分离毒株EBNA1序列进行了检测分析,结果表明,同一患者不同部位(咽漱液和癌组织)EBV毒株EBNA1亚型一致,即由同一种EBV毒株感染,支持上述结论,提示EBV相关肿瘤患者咽漱液中EBNA1亚型分析对明确其癌组织中EBV毒株具有指导 意义。
尽管EBNA1基因变异表现为地域相关性,但并不能排除EBNA1氨基酸变异可能对其功能产生的影响。EBNA1蛋白的主要功能区域均已确定,如DNA结合-二聚化部位(AA 459-607)和转录激活区域(AA 450-641) 等[15]。V-val、P-thr和V-leu亚型中大多数突变位点位于其功能区域。功能区域氨基酸的改变可影响二聚体EBNA1的形成,进而影响其与DNA的结合[15,18-19],有研究推测EBNA1序列变异可能影响病毒DNA复制、转录及EBV的致癌性和免疫逃逸[20-22]。V-val亚型AA502、524、528和594位点变异,P-thr亚型AA524、563、574、585、594和595位点变异以及V-leu亚型AA502、524、563、574、585和594位点变异均集中在AA501-532和AA554-598之间。鉴于EBNA1在维持病毒潜伏感染中的重要作用,深入研究EBNA1各亚型的功能对阐释EBNA1基因变异与EBV相关疾病的关系有重要意义。
[1]THOMPSON M P, KURZROCK R. Epstein-Barr virus and cancer [J]. Clin Cancer Res, 2004, 10: 803-821.
[2]LEIGHT E R, SUGDEN B. EBNA-1: a protein pivotal to latent infection by Epstein-Barr virus[J]. Rev Med Virol, 2000, 10: 83-100.
[3]LEVITSKAYA J, CORAM M, LEVITSKY V, et al. Inhibition of antigen processing by the internal repeat region of the Epstein-Barr virus nuclear antigen-1[J]. Nature, 1995, 375(6533): 685-688.
[4]BHATIA K, RAJ A, GUTIERREZ M I, et al. Variation in the sequence of Epstein Barr virus nuclear antigen 1 in normal peripheral blood lymphocytes and in Burkitt[J]. Oncogene, 1996, 13: 177-181.
[5]GUTIERREZ M I, RAJ A, SPANGLER G, et al. Sequence variations in EBNA-1 may dictate restriction of tissue distribution of Epstein-Barr virus in normal and tumour cells [J]. J Gen Virol, 1997, 78: 1663-1670.
[6]KHAN G, COATES P J, KANGRO H O, et al. Epstein Barr virus (EBV) encoded small RNAs: targets for detection by in situ hybridisation with oligonucleotide probes[J]. J Clin Pathol, 1992, 45(7): 616-620.
[7]SANDVEJ K, ZHOU X G, HAMILTON-DUTOIT S. EBNA-1 sequence variation in Danish and Chinese EBV-associated tumours: evidence for geographical polymorphism but not for tumour-specific subtype restriction[J]. J Pathol, 2000, 191(2): 127-131.
[8]WANG Y, LIU X, XING X, et al. Variations of Epstein-Barr virus nuclear antigen 1 gene in gastric carcinomas and nasopharyngeal carcinomas from Northern China[J]. Virus Res, 2010, 147(2): 258-264.
[9]HABESHAW G, YAO Q Y, BELL A I, et al. Epstein-Barr virus nuclear antigen1 sequences in endemic and sporadic Burkitt’s lymphoma reflect virus strain prevalent in different geographic areas[J]. J Virol, 1999, 73(2): 965-975.
[10]CHANG K L, CHEN Y Y, CHEN W G, et al. EBNA-1 gene sequences in Brazilian and American patients with Hodgkin’s disease[J]. Blood, 1999, 94: 244-250.
[11]GREINER T C, ABOU-ELELL A A, SMIR B N, et al. Molecular epidemiology of EBNA-1 substrains of Epstein-Barr virus in posttransplant lymphoproliferative disorders which have infrequent p53 mutations[J]. Leuk Lymphoma, 2000, 38: 563-576.
[12]FASSONE L, CINGOLANI A, MARTINI M, et al. Characterization of Epstein-Barr virus genotype in AIDSrelated non-Hodgkin’s lymphoma[J]. AIDS Res Hum Retroviruses, 2002, 18: 19-26.
[13]MACKENZIE J, GRAY D, PINTO-PAES R, et al. Analysis of Epstein-Barr virus (EBV) nuclear antigen 1 subtypes in EBVassociated lymphomas from Brazil and the United Kingdom [J]. J Gen Virol, 1999, 80(Pt 10): 2741-2745.
[14]CHANG C M, YU K J, MBULAITEYE S M, et al. The extent of genetic diversity of Epstein-Barr virus and its geographic and disease patterns: a need for reappraisal[J]. Virus Res, 2009, 143: 209-221.
[15]ADLDINGER H K, DELIUS H, FREESE U K, et al. A putative transforming gene of Jijoye virus differs from that of Epstein-Barr virus prototypes [J]. Virology, 1985, 141: 221-234.
[16]CHEN Y Y, CHANG K L, CHEN W G, et al. Epstein-Barr virus-associated nuclear antigen-1 carboxy-terminal gene sequences in Japanese and American patients with gastric carcinoma[J]. Lab Invest, 1998, 78(7): 877-882.
[17]NIE Y H, SUN Y J, WANG Y, et al. Epstein-Barr virus gene polymorphism in different parts of the same nasopharyngeal carcinoma patient[J]. Arch Virol, 2013, 158(5): 1031-1037.
[18]CHEN M R, MIDDELDORP J M, HAYWARD S D. Separation of the complex DNA binding domain of EBNA-1 into DNA recognition and dimerization subdomains of novel structure[J]. J Virol, 1993, 67: 4875-4885.
[19]WYSOKENSKI D A, YATES J L. Multiple EBNA1-binding sites are required to form an EBNA1-dependent enhancer and to activate a minimal replicative origin within oriP of Epstein-Barr virus[J]. J Virol, 1989, 63: 2657-2666.
[20]SNUDDEN D K, SMITH P R, LAI D, et al. Alterations in the structure of the EBV nuclear antigen, EBNA1, in epithelial cell tumours[J]. Oncogene, 1995, 10: 1545-1552.
[21]ZHANG X S, WANG H H, HU L F, et al. V-val subtype of Epstein-Barr virus nuclear antigen 1 preferentially exists in biopsies of nasopharyngeal carcinoma[J]. Cancer Lett, 2004, 211: 11-18.
[22]JONES K, NOURSE J P, MORRISON L, et al. Expansion of EBNA1-specific effector T cells in posttransplantation lymphoproliferative disorders [J]. Blood, 2010, 116(13): 2245-2252.

