MRI鉴别乳腺导管原位癌与其他导管内病变的价值
尤超 顾雅佳 彭卫军 毛健 姜婷婷
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
近年来,随着乳腺癌筛查的广泛开展、筛查设备的不断更新以及乳腺影像报告的逐步规范,乳腺导管原位癌(ductal carcinoma in situ,DCIS)检出率明显上升,DCIS已占新诊断乳腺癌的20%~30%[1]。鉴于DCIS是一种局限于乳腺导管的上皮细胞异常增生,未超出周围基底膜,可逐渐发展为浸润性导管癌[2]。因此,DCIS的早期诊断已成为临床和影像医师关注的重点。
本研究旨在探讨乳腺MRI鉴别诊断DCIS导管原位癌伴微浸润(ductal carcinoma in situ with microinvasion,DCIS-MI)以及导管内乳头状瘤(breast intraductal papilloma,BIDP)的价值。以期进一步提高对DCIS磁共振诊断的认识,有助于临床及时采取有效治疗。
1 资料和方法
1.1 临床资料
回顾性分析2011年7月—2012年2月于复旦大学附属肿瘤医院行乳腺MRI检查并经手术病理证实的DCIS患者24例、DCIS-MI 9例、BIDP 20例临床资料。所有患者均为女性,年龄46~76岁,平均58岁。
1.2 MRI检查方法
采用Aurora1.5T专用乳腺磁共振机(Aurora Dedicated Breast MRI Systems, USA,Aurora)及乳腺专用线圈。患者取俯卧位,使双乳自然下垂,扫描范围包括双侧乳腺及腋窝区。MRI增强对比剂采用Gd-DTPA,剂量为 0.2 mmol/kg,采用高压注射器经手背静脉注入,流率为2.0 mL/s,其后以同样流率注入 15 mL0.9%NaCl溶液冲洗管内残留的Gd-DTPA。扫描序列包括:①横断面平扫,扫描参数TE 5 ms,TR 29 ms,层厚1.1 mm,间隔0 mm;②动态增强扫描4回合,扫描参数TE 5 ms,TR 29 ms,FOV 360 mm,矩阵360×360×128,层厚1.1 mm,间隔0 mm。注入对比剂后连续无间隔采集4个时相,每个时相扫描时间约为3 min,单期扫描层数为160层。平扫和动态增强扫描采用脂肪抑制技术,对双侧乳腺进行匀场,以达到脂肪抑制最佳效果。增强后总扫描时间约为12 min。
1.3 MRI图像后处理及分析
由2名专门从事乳腺研究的放射科医师,主要从病灶的MRI表现、时间-信号强度曲线(Time intensity curve,TIC)及伪彩图像3方面分析。
按照美国放射学院提出的乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)标准,病灶依据强化形态(包括导管样强化、段样强化、局灶样强化、区域性强化及肿块样强化)及强化方式(包括均匀及不均匀强化)两方面分析。由于样本量的局限性,强化方式并未将不均匀强化进一步加以细分。
在AuroraCAD工作站上使用Aurora V4.21软件,绘制病灶的TIC(Ⅰ型:上升型,Ⅱ型:平台型,Ⅲ型:流出型),并计算早期强化率(signal enhancement ratio,SIR),统计强化峰值出现的时间。
在AuroraCAD工作站上使用Aurora V4.21软件,测量病灶伪彩图像,伪彩定义为:红色提示流出型强化,粉红提示平台型强化,黄色提示上升型强化,蓝色提示液体,绿色提示水肿,灰色提示无强化。
1.4 病理学检查
由2名有经验的病理学医师依据WHO2012版乳腺肿瘤病理学标准对DCIS、DCIS-MI及BIDP病变进行描述及诊断。本院对DCIS-MI的定义为:浸润灶最大径不超过1 mm,若有多处浸润,每处浸润最大径不超过1 mm。
1.5 统计学处理
用Excel 2003进行数据录入和整理,DCIS与DCIS-MI、BIDP在MRI表现(强化形态、方式、伪彩及曲线类型)上的差别采用χ2检验和Fisher确切概率法分析,DCIS与DCIS-MI、BIDP的SIR差别采用独立样本t检验,用SPSS 17.0统计软件进行分析,P<0.05为差异有统计学意义。
2 结 果
2.1 MRI上DCIS、DCIS-MI和BIDP的动态增强表现
在强化形态上, DCIS患者以导管样及段样强化为主(14/24);DCIS-MI患者以局灶性及区域性强化为主(6/9);BIDP患者以局灶性强化为主(13/20)。强化方式均以不均匀强化为主。
2.2 MRI上DCIS、DCIS-MI和BIDP的TIC表现
DCIS和DCIS-MI患者TIC以Ⅱ型及Ⅲ型为主(21/24,8/9),BIDP患者以Ⅰ型及Ⅱ型为主(17/20)。DCIS、DCIS-MI和BIDP患者的早期强化率分别为61.64%、68.20%和52.30%,差异无统计学意义(P>0.05)。
2.3 MRI上DCIS、DCIS-MI和BIDP伪彩图像表现
DCIS和DCIS-MI患者均以乳头后导管伪彩图像红色为主要表现(22/24,7/9),提示血供丰富;BIDP患者仅有少数乳头后导管伪彩图像表现为红色(6/20)。
DCIS与DCIS-MI的病灶强化形态、强化方式、病灶伪彩图像、TIC及早期强化率间差异均无统计学意义(P>0.05)。DCIS与BIDP的病灶强化形态(导管样、节段样、局灶性)、病灶伪彩图像、Ⅲ型TIC类型间差异有统计学意义(表1,图1~3)。

表1 DCIS、DCIS-MI与BIDP的MRI表现比较Tab. 1 The difference between DCIS、DCIS-MI and BIDP on MRI(n)
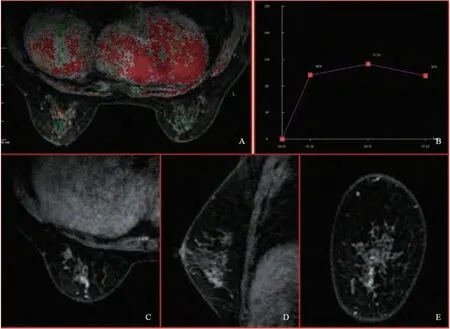
图1 右乳导管内原位癌 Fig. 1 DCIS of right breast

图2 右乳导管内原位癌伴微浸润Fig. 2 DCIS-MI of right breast
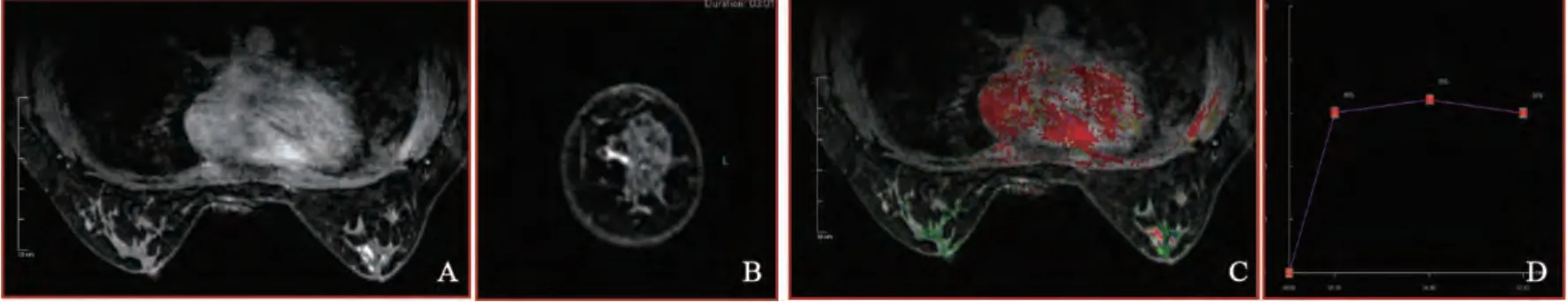
图3 左乳导管内乳头状瘤Fig. 3 BIDP of left breast
3 讨 论
DCIS主要发生在终末导管小叶单位内的小导管或腺泡化的小导管,可沿导管系统扩散的播散型病变,可位于近乳头的大导管或远离乳头的小导管,起源于一个导管束[3]。是指乳腺癌细胞突破基底膜进入邻近组织,同时最大直径不超过1 mm,DCIS-MI是乳腺癌中一类少见的具有转移潜能的肿瘤[4]。BIDP是乳腺中小导管及末梢小导管上皮呈乳头状增生而形成的一种良性病变,其特征是多个导管腔同时发生导管上皮乳头增生[5]。DCIS与DCIS-MI、BIDP临床均可表现为导管溢液、伴或不伴有乳房肿块;临床上DCIS以局部治疗为主,目的是降低局部复发率,DCIS-MI转移潜能较DCIS高,临床以个体化治疗策略为主,而BIDP为导管内良性病变,治疗原则与恶性肿瘤完全不同。因而,影像学上如能够正确鉴别3种疾病的差异,术前给予提示性的诊断,有助于指导临床制定合理的手术方式及后续治疗方案。
DCIS是一种异质性疾病,在MRI上形态学表现多样。Morakkabati-Spitz等[6]报道DCIS的MRI增强中70%~83%可强化,表现为线状、短分枝状、片状均匀强化等。Neubauer等[7]分析了39例DCIS的动态增强MRI表现,发现病灶强化形态多样,有斑点状强化、节段性强化和线状强化等,其中80%以上表现为早期明显强化。近年来,国内顾雅佳等[8]和许玲辉等[9]的研究也表明,DCIS以节段性及沿导管走行线状或轨道状等非肿块型强化为主。本研究与上述研究一致。
本研究结果发现,DCIS与BIDP在病灶强化形态上具有差异,DCIS以导管样及段样强化为主,而BIDP以乳头后局灶性强化为主。大多数文献将BIDP的MRI表现描述为:位于乳头附近的明显强化的结节样病灶[10];呈边界较光整的均匀强化病灶[11];沿导管分布多发小结节样及环形强化[12],这与恶性肿瘤的MRI表现明显不同。同时病灶强化均匀与否也可以成为鉴别两种病变的参考,Tozaki等[13]和王丽君等[14]研究认为,成簇小环样强化反映DCIS导管周围基质和导管壁强化的病理特征,是DCIS特征性MRI征象,可与BIDP相鉴别。虽然本研究中DCIS-MI更易表现局灶性、区域性及肿块样强化方式,DCIS更易表现为导管样及段样强化,但两者在形态上还是难以区分。Schouten等[15]报道,MRI诊断DCIS-MI的特异性为83%,然而DCIS和DCIS-MI在MRI上的表现有时很难区分,但以肿块样强化表现为主的病变,一般以浸润性癌为首要考虑。
DCIS的病灶会有强化的表现[7],动态增强检查对于DCIS的诊断有较高价值。因为乳腺恶性肿瘤内毛细血管内皮通透性高于正常血管内皮,且肿瘤血管存在不同程度的动-静脉短路分流,所以TIC表现为流出型或平台型。而本研究DCIS以流出型为主,与Jansen等[16]报道DCIS的TIC以平台型为主有差异,原因与不同MR机型动态增强扫描所选用的时间分辨率不同有关,Aurora乳腺MRI专用机以提高空间分辨率为优先,时间分辨率相对降低,故动态增强扫描每个时相采集时间较长(约3 min)、采集频率低(4个时相)、总采集时间较长(约12 min)。
但由于DCIS-MI具有转移潜能的生物学行为,其恶性程度较单纯DCIS更甚,在本研究中TIC亦多表现为Ⅲ型(流出型),与DCIS比较难鉴别,但与既往文献报道相一致。而BIDP作为乳腺良性病变,本研究多为Ⅱ型(平台型)。对DCIS进行MRI诊断时应更注重形态学分析,不能仅根据病灶有无强化、TIC类型判断其良恶性,特别是多数DCIS的肿瘤血管数量不一,TIC不一定表现为流出型。Kuhl等[17]也认为,形态特征评价的权重要大于TIC的评价。虽然本研究显示TIC对于DCIS与BIDP的鉴别是有帮助的,但在临床诊断工作中,仍因依据形态学表现完成DCIS的定性诊断。
伪彩图像显示原理类似于TIC,不同颜色提示病灶内不同的物质成分。在本研究中,DCIS与DCIS-MI患者病灶均以红色为主,在一定程度提示其内含血供较丰富的肿瘤成分,而BIDP患者病灶以非红色为主,与其良性病变的生物学特征相吻合。
本研究的局限性在于样本数有限,亦未对3种病变的不均匀强化方式进一步分组研究,且Aurora乳腺专用磁共振无法行DWI功能序列扫描,这些都有待于今后积累样本数并结合其他MRI机型再做深入研究。
综上所述,DCIS以导管样及段样强化为主、病灶伪彩图像为红色、TIC为Ⅲ型为主要特征性表现;BIDP以乳头后局灶性强化为主、病灶伪彩图像为非红色、TIC为Ⅱ型为主要特征性表现。
[1]TANG P, HAJDU S I, LYMAN G H. Ductal carcinoma in situ:a review of recent advance[J]. Curr Opin Obstet Gynecol, 2007, 19(1): 63-67.
[2]DESANTIS C, MA J, BRYAN L, et al. Breast cancer statistics, 2013[J]. CA Cancer J Clin, 2013, doi: 10.3322/caac.21203. [Epub ahead of print]
[3]VIRNIG B A, TUTTLE T M, SHAMLIYAN T, et al. Ductal carcinoma in situ of the breast: asystematic review of incidence, treatment, and outcomes[Review]. Natl Cancer Inst, 2010, 102(3): 170-178.
[4]ADAMOVICH T L, SIMMONS R M. Ductal carcinoma in situ with microinvastion[J]. Am J Surg, 2003, 186(2): 112-116.
[5]KUHL C K. MRI of breast tumor[J]. Eur Radiol, 2000, 10(1): 46-58.
[6]MORAKKABATI-SPITZ N, LEUTNER C, SCHILD H, et al. Diagnostic usefulness of segmental and linear enhancement in dynamic breast MRI[J]. Eur Radiol, 2005, 15(9): 2010-2017.
[7]NEUBAUER H, LI M, KUEHNE-HEID R, et al. High grade and non-high grade ductal carcinoma in situ on dynamic MR mammography: characteristic findings for signal increase and morphological pattern of enhancement[J]. Br J Radiol, 2003, 76(901): 3-12.
[8]顾雅佳, 汪晓红, 肖勤, 等. 乳腺导管原位癌及其微浸润的磁共振成像评价[J]. 中华放射学杂志, 2007, 41(3): 248-253.
[9]许玲辉, 彭卫军, 顾雅佳, 等. 乳腺导管原位癌的MRI表现[J]. 中华放射学杂志, 2011, 45(2): 159-163.
[10]EIADA R, CHONG J, KULKARNI S, et al. Papillary lesions of the breast: MRI, ultrasound and mammographic appearances[J]. Am J Roentgenol, 2012, 198(2): 264-271.
[11]KRAMER S C, RIEHER A, GORICH J, et a1. Diagnosis of papillomas of the breast: value of magnetic resonance mammography in comparison with galactography[J]. European Radiology, 2000, 10(11): 1733-1736.
[12]展颖, 柴维敏, 谭令, 等. 1.5T乳腺专用磁共振诊断乳腺导管内乳头状瘤的应用价值[J]. 外科理论与实践, 2012, 17(4): 366-369.
[13]TOZAKI M, IGARASHI T, FUKUDA K, et al. Breast MRI using the VIBE sequence: clustered ring enhancement in the differential diagnosis of lesions showing non-masslike enhancement[J]. AJR Am J Roentgenol, 2006, 187(2): 313-321.
[14]王丽君, 汪登斌, 李志, 等. MRI 非肿块样强化对乳腺导管原位癌与导管内乳头状瘤的鉴别诊断[J]. 实用放射学杂志, 2013, 29(2): 215-219.
[15]SCHOUTEN VAN DER VELDEN A P, BOETES C, WOBBES T, et al. The value of magnetic resonance imaging in diagnosis and size assessment of in situ and small invasive breast carcinoma[J]. Am J Surg, 2006, 192(2) :172-178.
[16]JANSEN S A, NEWSTRAD G M, ABE H, et al. Pure ductal carcinoma in situ:kinetic and morphologie MR characteristics compared with mammographie appearance and nuclear grade[J]. Radiology, 2007, 245(3): 684-691.
[17]KUHL C K, SCHRADING S, BIELING H B, et al. MRI for diagnosis of pure ductal carcinoma in situ: a prospective observational study[J]. Lancet, 2007, 370(9586): 485-492.

