精氨酸酶-1在肝细胞癌中的低表达及其临床意义
顾春燕 肖锋 钱铮 邵建国 秦刚 陈莉
1.南通大学附属南通第三医院病理科,江苏 南通 226006;
2.南通大学附属南通第三医院消化内科,江苏 南通 226006;
3.南通大学附属南通第三医院传染科,江苏 南通 226006;
4.南通大学医学院病理学教研室,江苏 南通 226001
肝细胞癌(hepatocellular carcinoma,HCC)是世界范围内最常见的恶性肿瘤之一,而我国HCC的发病率明显高于世界平均水平。深入研究HCC患者蛋白质谱的变化对揭示其发生、发展规律和致病机制具有重要意义。精氨酸酶(arginase,Arg)是肝脏鸟氨酸循环中的一个催化酶,Arg有两个同工酶,分别为Arg-1和Arg-2。Arg-1在肝脏中有较高的活性,也称为“肝型Arg”[1-2]。本研究应用逆转录-聚合酶链式反应(reverse transcriptase-polymerase chain reaction,RT-PCR)、蛋白印迹法(Western blot)和免疫组织化学技术检测Arg-1在HCC及癌旁肝组织中的表达情况,探讨其与HCC临床病理学特征间的关系,以进一步认识其临床意义。
1 资料和方法
1.1 临床资料
选取南通大学附属南通第三医院2005年1月—2011年12月经手术切除的HCC患者158例;均经患者知情同意,并通过医院伦理委员会批准。所有患者术前均未接受放疗、化疗或生物等治疗,手术标本诊断均经病理检查证实。同时切取距肿瘤2~3 cm的癌旁肝组织。正常对照组为肝移植供体标本19例,肝血管瘤10例、肝外伤2例,共31例正常肝标本。组织常规4%甲醛溶液固定、石蜡包埋以及4 μm切片、HE染色用于组织学观察,确定HCC分级。取上述158例HCC患者中31例的癌组织及相应癌旁肝组织新鲜标本,和10例肝血管瘤及2例肝外伤患者手术切除的正常肝组织,液氮冻存备用。本组HCC病例年龄19~81岁,平均年龄52.9岁;其中男性133例,女性25例。有详细的临床资料,包括血清AFP水平、HBsAg检测结果和病理检查相关结果。术后随访本组HCC患者至2012年10月,158例患者中共132例成功随访,随访时间为10个月~6年,随访频率1次/2~3个月,其中67例术后复发,65例无复发;随访方法采用门诊复诊和电话随访;随访内容包括一般情况、AFP、肝脏B超或CT等。HCC复发的诊断标准为:B超或CT发现肝脏实性占位,并参考同期AFP检测 水平。
1.2 主要试剂
TRIzol试剂盒购自美国Invitrogen公司,逆转录试剂盒、RT-PCR试剂盒购自日本TaKaRa公司,Arg-1、3-磷酸甘油醛脱氢酶(GAPDH)引物由美国Invitrogen公司合成,兔抗人Arg-1多克隆抗体购自Santa Cruz公司,小鼠β-actin单克隆抗体购自美国Sigma公司,辣根过氧化物酶标记二抗及免疫组化试剂盒购自丹麦Dako公司。
1.3 方法
1.3.1 总RNA制备及逆转录
按TRIzol说明书抽提肝组织总RNA。按每50 mg组织加入1 mL TRIzol进行抽提。紫外分光光度仪测定RNA浓度并将所有样本浓度调整为 1 μg/μL,立即进行逆转录反应。每个样本取 1 μL作逆转录模板合成cDNA。逆转录反应条件:37 ℃ 15 min,85 ℃ 5 s。合成好的cDNA置于-20 ℃保存备用。
1.3.2 RT-PCR
Arg-1上、下游引物5’-AGGGTCCACCC T G AT C T T G G A G T-3’和5’-G G A G A ATCCTGGCACATCGGGA-3’,产物长度 1 5 3 b p;G A P D H 上下游引物5’-C C A TTTGCAGTGGCAAAG-3’,5’-CACCC CATTTGATGTTAGTG-3’,产物长度202 bp,按TaKaRa试剂盒说明进行,反应条件:94 ℃ 5 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃ 45 s,共30个循环;72 ℃ 10 min。每个样本设3复孔。对反应产物进行2%琼脂糖凝胶电泳。取5 μL PCR 扩增产物加入2.5%核酸染料琼脂糖凝胶中,以80 V/cm电压电泳50 min,在紫外线下可见相应长度的目的基因和内参的扩增条带,将电泳结果直接置于凝胶分析系统中对条带进行分析。
1.3.3 Western blot分析检测
在新鲜HCC组织及相应癌旁肝组织和正常肝组织中加入蛋白裂解液,冰浴匀浆,4 ℃离心,12 000×g离心20 min,取上清液,测定蛋白含量。分别取蛋白样品各40 μg,加入4×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,于沸水中加热5 min,行SDS-聚丙烯酰胺凝胶电泳,电泳结束后,进行湿式电转移。转移后的聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,用含10%脱脂奶粉的三羟甲基胺基甲烷-盐酸盐缓冲液(trisaminomethanehydrochloric acid buffer saline and Tween,TBST)室温包被2 h,第一抗体室温温育1 h后,4 ℃过夜。TBST漂洗5 min×5次,第二抗体室温温育2 h,TBST漂洗5 min×5次,化学发光试剂(electrochemiluminescence,ECL)发光,显影,定影。吸光度(A)值测定用密度扫描仪(ZEISS全自动图像分析仪)测定目的条带及β-actin的A值,以(A×S)/(a×s) (S和s分别表示条带的面积)定义为Arg-1的A相对值。本实验重复3次。
1.3.4 组织芯片的制备
组织芯片由南通大学医学院病理学系制作,主要步骤为:复阅所有HCC病例的HE切片,并在HE切片及原蜡块上标记所需组织的正确部位。将莱卡石蜡与蜂蜡按照2∶1比例混合,制成3.5 cm×2.2 cm×1.0 cm大小的空白蜡块。在该蜡块1.8 cm×1.2 cm范围内设计10×8点组织列阵,用组织芯片仪打孔制成模块。用组织芯片仪直径1.6 mm的吸针从供体蜡块取组织,按照预先设计的排列顺序定位装载在受体蜡块中,并设置复点。
1.3.5 免疫组织化学检测及结果判定
所有标本经10%中性甲醛溶液固定后常规组织处理,4 μm厚连续切片,分别行HE和免疫组化染色。其中免疫组化染色参照试剂盒说明书进行。PBS 液代替一抗作阴性对照,已知阳性的组织作阳性对照。免疫组化染色结果由两位病理科医师在不参考临床病理资料的情况下进行评定,实验均设阳性和阴性对照。每例随机观察5个高倍视野(×400),每个高倍视野计数200个瘤细胞。综合阳性细胞染色强度和阳性细胞所占百分比进行评分。将染色强度分为4级:无色0分,淡黄色1分,棕黄色2分,棕褐色3分;阳性细胞所占的百分比:<5% 0分,5%~25% 1分,25%~50% 2分,50%~75% 3分,>75% 4分;同时,两者相乘再相加后取平均值,分为4个等级:阴性(-):0~1;弱阳性(+):2~4;中度阳性(++):5~8;强阳性(+++):9~12。
1.4 统计学处理
应用SPSS 15.0统计软件分析处理数据,计量资料用±s 表示,组间比较采用t检验。采用χ2检验分析免疫组织化学结果,各组之间比较采用Spearman秩相关分析,率的比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
2 结 果
2.1 Arg-1 mRNA在正常肝组织、癌旁组织及HCC组织中的表达水平
Arg-1 mRNA在正常肝组织、癌旁组织、HCC中均有一定的表达。在正常肝组织、癌旁组织中Arg-1 mRNA表达水平较高,在HCC组织中表达较弱,且随HCC的分化程度的降低,其表达量随之降低(图1)。统计学分析显示,正常肝组织中Arg-1的相对表达量为1.52±0.35;癌旁肝组织中相对表达量为1.03±0.34,HCC组织中相对表达量(高、中、低分化3组的平均 值)为0.41±0.31,HCC组织中Arg-1 mRNA表达水平明显低于正常肝组织和癌旁组织,差异有统计学意义(P均<0.01)。HCC组织中Arg-1 mRNA的表达水平分别为:高分化HCC组织中的相对表达量0.70±0.25,中分化HCC中的相对表达量为0.41±0.30,低分化HCC中的相对表达量为0.18±0.15,不同分化程度的HCC中Arg-1 mRNA表达水平差异有统计学意义(P<0.01)。

图1 RT-PCR分析Arg-1 mRNA在正常肝组织、癌旁组织及HCC中的表达Fig. 1 RT-PCR analysis of Arg-1 mRNA expression in normal liver tissues, paracancerous liver tissues and HCC tissues
2.2 Arg-1蛋白在正常肝组织、癌旁组织及HCC组织中的表达水平
Arg-1蛋白在正常肝组织、癌旁组织及HCC组织中均有表达(图2)。Arg-1蛋白在正常肝组织中表达量为2.11±0.26;HCC组织(高、中、低分化3组的平均值)为0.61±0.31,癌旁组织为1.61±0.26。HCC组织中Arg-1蛋白表达水平明显低于正常肝组织和癌旁组织,差异有统计学意义(P均<0.01)。HCC组织中Arg-1蛋白的表达水平分别为:高分化HCC为0.97±0.21;中分化HCC为0.64±0.21;低分化HCC为0.33±0.11,不同分化程度的HCC中Arg-1蛋白表达水平差异有统计学意义(P<0.01)。

图2 Westen blot分析Arg-1蛋白在正常肝组织、癌旁组织及HCC中的表达Fig. 2 Western blot analysis of Arg-1 protein expression in normal liver tissues, paracancerous liver tissues and HCC tissues
2.3 免疫组织化学检测Arg-1蛋白在正常肝组织、癌旁组织及HCC组织中的表达
运用免疫组化法进一步检测了Arg-1蛋白在158对HCC及其癌旁组织、31例正常肝组织中的表达情况,显示Arg-1蛋白在各组中均有表达,定位于细胞质及部分细胞核。Arg-1在正常肝组织和癌旁肝组织中普遍表达(图3),在HCC组织中表达低下或缺失(图4)。Arg-1蛋白在158例HCC中弱阳性表达63例,中度阳性表达55例,强阳性表达21例,阳性表达率为88%;158例癌旁组织中弱阳性表达28例,中度阳性表达68例,强阳性表达60例,阳性表达率为98.7%;31例正常肝组织中中度阳性表达7例,强阳性表达24例,阳性表达率为100%。Arg-1蛋白在HCC组织中的表达显著低于癌旁组织(χ2=14.7416,P<0.01)和正常肝组织(χ2=4.1415,P<0.05),癌旁组织和正常组织表达差异无统计学意义(χ2=0.3966,P>0.05,表1)。
2.4 Arg-1蛋白表达与临床病理特征的关系
Arg-1蛋白表达水平随HCC分化程度降低、脉管侵犯和术后复发而下降(P均<0.05)。Arg-1表达与HCC患者年龄、性别、HBsAg感染、血清AFP水平、有无肝硬化、肿瘤结节直径、瘤结节数均无显著相关性(表2)。
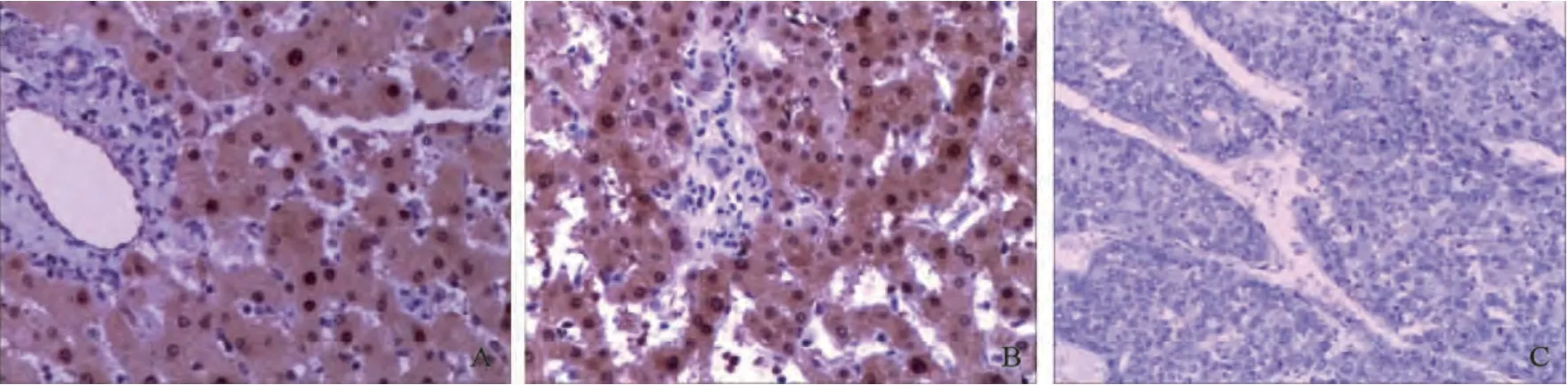
图3 免疫组化检测Arg-1蛋白在正常肝、癌旁肝组织及肝癌组织中的表达Fig. 3 Expression of Arg-1 protein in normal liver tissues, paracancerous liver tissues and HCC tissues by immunochemistry(EnVision, ×100)
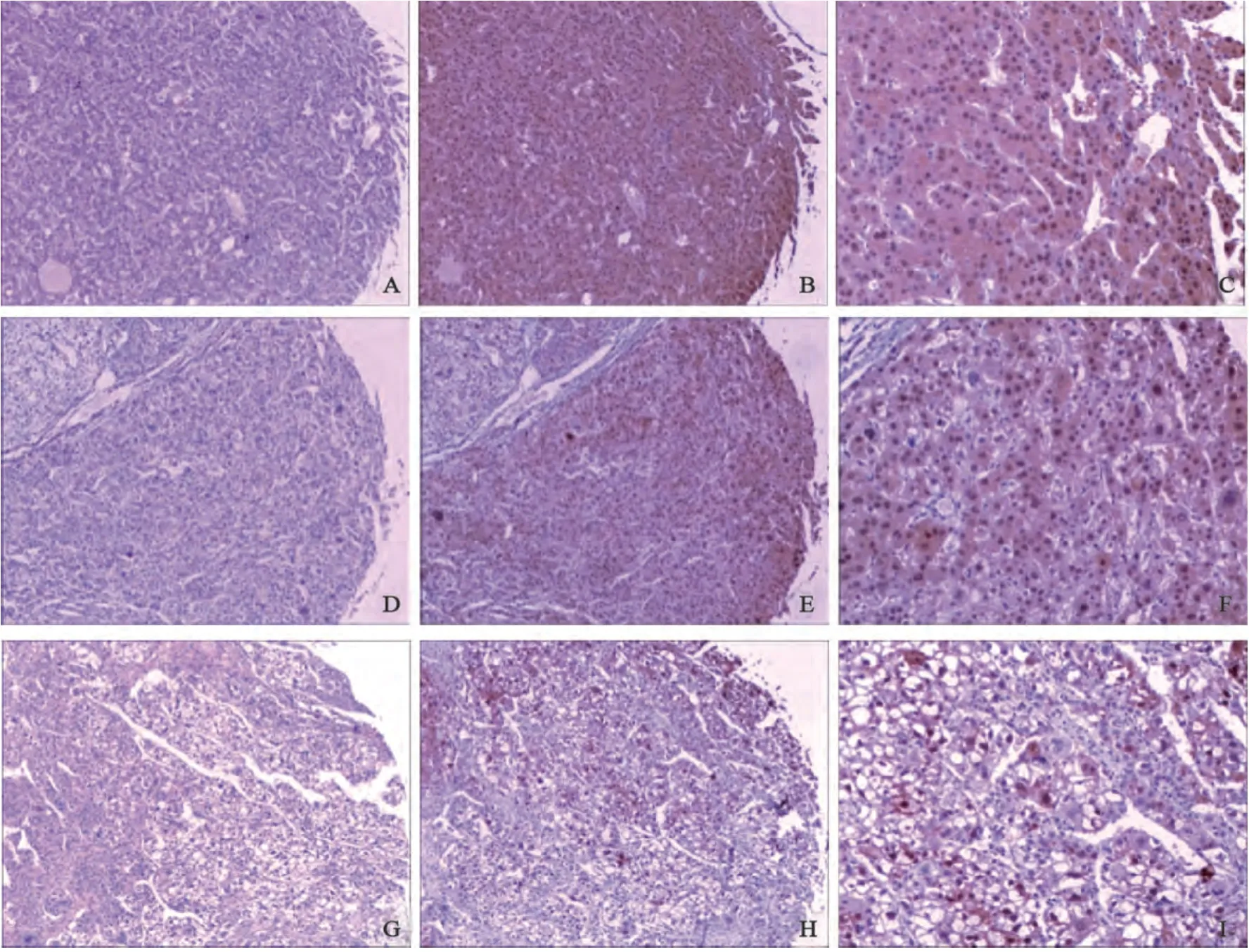
图4 HCC组织芯片中Arg-1的表达Fig. 4 Expression of Arg-1 protein in HCC tissue microarray
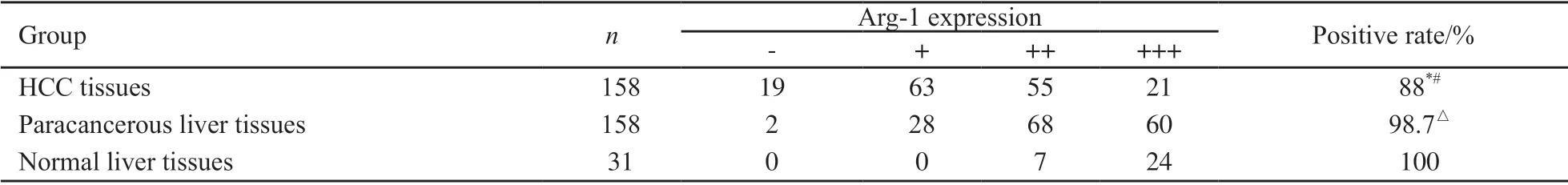
表1 Arg-1蛋白在HCC组织、癌旁组织及正常肝组织中的表达Tab. 1 Expression of Arg-1 protein in HCC tissues, paracancerous liver tissues and normal liver tissues

表2 Arg-1表达与HCC患者临床病理因素的关系Tab. 2 Correlation of Arg-1 expression with clinicopathological features of patients with hepatocellular carcinoma(n)
3 讨 论
Arg是一种双核锰金属蛋白酶,含有332个氨基酸,它是三聚体结构。内源性的Arg从肝中生成并释放。研究表明人和哺乳动物体内存在两种形式的Arg同工酶,分别为Arg-1和Arg-2,两者的氨基酸序列大约有60%的同源相似性,主要的区别在于各自的组织分布、亚细胞定位以及免疫反应性不同[1]。Arg-1其基因定位于6q23染色体,在肝脏中有较高的活性,也称为“肝型Arg”,主要存在于门管区周围的肝细胞中。它能水解L-精氨酸,生成尿素和L-鸟氨酸,除参与尿素循环外,还参与催化合成精胺和精脒等多种细胞生长必需的代谢分子,因此,Arg-1的表达改变可能会导致肝组织代谢紊乱从而引发肿瘤,对细胞代谢水平和生长状态产生显著影响。Arg-2也称为“肝外Arg”,其基因定位于染色体14q24.1-24.3,主要在肝外组织中表达,如脑、肾、骨骼肌、小肠的线粒体,在肝脏内也有微量的表达,它不参与尿素循环,主要调控细胞内精氨酸的浓度,从而控制生物体内一氧化氮(nitric oxide,NO)、脯氨酸、多胺等物质的生物合成[2-4]。
本研究应用RT-PCR和Western blot方法,对Arg-1在HCC组织、癌旁肝组织及正常肝组织中的表达情况进行了检测,结果显示Arg-1在HCC组织中的表达水平均明显低于相应癌旁肝组织及正常肝组织,这与先前的报道是一致 的[5]。提示Arg-1可能参与HCC的发生、发展,在HCC的发生、发展过程中可能起到负性调控作用。进一步研究发现,Arg-1在HCC中的表达较正常肝组织有明显的降低和缺失,其阳性表达率为88%,且与HCC的分化程度密切相关,随着HCC的分化程度的降低,Arg-1表达率有下降的趋势。并且,Arg-1的表达水平与血管侵犯和术后复发有关,而与HCC患者年龄、性别、HBsAg感染、血清AFP水平、有无肝硬化、肿瘤直径、肿瘤个数均无关。这些结果提示,Arg-1可能在HCC的恶性转化过程中有着重要作用,Arg-1表达下降或缺失可能促进HCC转移。
先前的研究显示,精氨酸对于肝癌、黑色素瘤和骨肉瘤等精氨酸营养缺陷型恶性肿瘤细胞而言是必需氨基酸,在缺乏精氨酸的环境下,肿瘤细胞生长受到抑制[6-7],一旦体外的精氨酸缺乏,或存在精氨酸降解酶以及消耗精氨酸的培养基的情况下,会导致多种癌细胞迅速出现摧毁结构[8-9]。在精氨酸代谢过程中,Arg-1和诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)是两个极其关键的酶,精氨酸可被Arg-1催化转变为鸟氨酸而自身耗竭掉,另外Arg-1也可代谢精氨酸,参与尿酸、多氨的合成,后者是细胞增殖的必需物质之一。Arg-1的最终结果是抑制精氨酸向NO的衍生,Arg-1表达下降可使精氨酸蓄积,从而间接导致iNOS底物相对增多,生成NO增加,其对肿瘤生长有直接作用[10]。其机制可能包括:①NO可引起DNA链的断裂,抑制DNA修复酶的修复作用[11-12];②NO可使部分抑癌基因,如p53基因产生不可逆的损伤,使抑癌基因失活[11-12];③NO促进Bcl-2的表达,抑制细胞凋亡而有利于生长停止的肿瘤细胞的存活[13];④NO具有促进肿瘤血管形成的作用,还介导肿瘤血管的舒张作用,维持肿瘤的血流量,使肿瘤的微血管通透性增加[14],作为内源性血管舒张因子的NO,对血管及肿瘤微循环的确立起直接作用,同时,NO通过上调其介导的血管生成因子—血管内皮细胞生长因子、纤维细胞生长因子的活性来促进新血管的生成[15];⑤促进肿瘤细胞的侵袭和转移。NO可以通过影响基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)的表达而增强肿瘤的侵袭力[16]。结合本研究结果,我们考虑Arg-1在HCC的发生、发展过程中起到负性调控作用,Arg-1表达下降可能导致精氨酸在HCC中的聚集,从而促进肿瘤细胞的增殖;或者导致iNOS底物相对增多,生成NO增加,进而促进HCC复发或转移。
另外,还有研究表明,精氨酸是调节T细胞活化和增殖的必需氨基酸之一,细胞外的精氨酸被Arg-1水解后,T细胞CD3ζ链表达受到影响,进而抑制T细胞增殖,最终影响对肿瘤细胞的免疫抑制功能[17-18]。Arg-1还能够激活肿瘤诱导的骨髓源性抑制细胞(myeloid-derive suppressor cells,MDSCs),MDSCs存在于几乎所有癌症患者的外周血中,主要发挥免疫抑制作用,介导癌症患者系统性免疫功能障碍和局部的肿瘤免疫逃避[19]。Arg-1在HCC中的异常表达是否通过介导机体免疫抑制而影响HCC的发生、发展,这需要进一步的实验研究证实。总之,Arg-1能通过多种途径影响肿瘤的进展,但具体通过何种机制参与HCC还有待进一步 研究。
本研究应用RT-PCR和Western blot以及免疫组织化学技术等,从mRNA和蛋白水平初步探讨了Arg-1在HCC中的表达和意义以及可能的作用机制。明确Arg-1在HCC中的作用及具体机制,将有助于更深入认识HCC,也为临床寻找有效的治疗靶点提供新的依据。
[1]MUNDER M. Arginase: an emerging key player in the mammalian immune system [J]. Br J Pharmacol, 2009, 158(3): 638-651.
[2]JENKINSON C P, GRODY W W, CEDERBAUM S D. Comparative properties of arginases [J]. Comp Biochem Physiol B Biochem Mol Biol, 1996, 114(1): 107-132.
[3]SPECTOR E B, JENKINSON C P, GRIGOR M R, et al. Subcellular location and differential antibody specificity of arginase in tissue culture and whole animals [J]. Int J Dev Neurosci, 1994, 12(4): 337-342.
[4]CHOI S, PARK C, AHN M, et al. Immunohistochemical study of arginase 1 and 2 in various tissues of rats [J]. Acta Histochem, 2012, 114(5): 487-494.
[5]CHRZANOWSKA A, KRAWCZYK M, BARANCZYKKUZMA A. Changes in arginase isoenzymes pattern in human hepatocellular carcinoma [J]. Biochem Biophys Res Commun, 2008, 377(2): 337-340.
[6]ENSOR C M, HOLTSBERG F W, BOMALASKI J S, et al. Pegylated arginine deiminase (ADI-SS PEG20, 000 mw) inhibits human melanomas and hepatocellular carcinomas in vitro and in vivo [J]. Cancer Res, 2002, 62 (19): 5443-5450.
[7]WHEATLEY D N, CAMPBELL E. Arginine deprivation, growth inhibition and tumour cell death: Deficient utilisation of citrulline by malignant cells [J]. Br J Cancer, 2003, 89(3): 573-576.
[8]SCOTT L, LAMB J, SMITH S, et al. Single amino acid (arginine) deprivation: rapid and selective death of cultured transformed and malignant cells [J]. Br J Cancer, 2000, 83(6): 800-810.
[9]LAM T L, WONG G K, CHONG H C, et al. Recombinant human arginase inhibits proliferation of human hepatocellular carcinoma by inducing cell cycle arrest [J]. Cancer Lett, 2009, 277(1): 91-100.
[10]GALLO O, MASINI E, MORBIDELLI L, et al. Role of nitric oxide in angiogenesis and tumor progression in head and neck cancer [J]. J Natl Cancer Inst, 1998, 90(8): 587-596.
[11]KOIDE N, SUGIYAMA T, MU M M, et al. Gamma interferoninduced nitric oxide production in mouse CD5+ B1-like cell line and its association with apoptotic cell death [J]. Microbiol Immunol, 2003, 47(9): 669-679.
[12]PENG J P, ZHENG S, XIAO Z X, et al. Inducible nitric oxide synthase expression is related to angiogenesis, Bcl-2 and cell proliferation in hepatocellular carcinoma [J]. J Zhejiang Univ Sic, 2003, 4(2): 221-227.
[13]DODD F, LIMOGES M, BOUDREAU R T, et al. L-arginine inhibits apoptosis via a NO-dependent mechanism in Nb2 lymphoma cells [J]. J Cell Biochem, 2000, 77(4): 624-634.
[14]HOFSETH L J, HUSSAIN S P, WOGAN G N, et al. Nitric oxide in cancer and chemoprevention [J]. Free Radic Biol Med, 2003, 34(8): 955-968.
[15]刘阳云, 刘庚勋, 李正贤, 等. 诱导型一氧化氮合酶与β-链接素在鼻咽癌中的表达及其意义[J]. 中国癌症杂志, 2009, 19(12): 899-903.
[16]SUN M H, HAN X C, JIA M K, et al. Expressions of inducible nitric oxide synthase and matrix metalloproteinase-9 and their effects on angiogenesis and progression of hepatocellular carcinoma [J]. World J Gastroenterol, 2005, 11(38): 5931-5937.
[17]RODRIGUEZ P C, ZEA A H, CULOTTA K S, et al. Regulation of T cell receptor CD3zeta chain expression by L-arginine [J]. J Biol Chem, 2002, 277(24): 21123-21129.
[18]RODRIGUEZ P C, ZEA A H, DESALVO J, et al. L-arginine consumption by macrophages modulates the expression of CD3 zeta chain in T lymphocytes [J]. J Immunol, 2003, 171(3): 1232-1239.
[19]ZEA A H, RODRIGUEZ P C, ATKINS M B, et al. Arginaseproducing myeloid suppressor cells in renal cell carcinoma patients: a mechanism of tumor evasion [J]. Cancer Res, 2005, 65(8): 3044-3048.

