人参皂甙20(R)-Rg3对人胶质瘤U87细胞凋亡的影响
柳云恩,刘欣伟,施琳,张玉彪,徐婷婷,高燕,侯明晓*
(1.沈阳军区总医院急诊医学部,全军重症(战)创伤救治中心实验室,沈阳 110840;2.沈阳军区总医院骨科,全军重症(战)创伤救治中心,沈阳 110840)
胶质瘤在神经系统肿瘤中高居首位,其术后极易复发,化疗药物因耐药性及血脑屏障的限制,治疗效果受到很大制约[1]。人参皂甙Rg3是一种人参二醇类四环三萜皂苷,根据其第20位碳的构型可分20(R)与20(S)-人参皂甙 Rg3,尽管两者互为同型异构体,但功能却不尽相同。Sin等[2]发现20(S)-人参皂甙Rg3通过Akt和p53/p21依赖性信号传导途径,使人胶质瘤细胞生长停滞。20(R)-人参皂甙Rg3研究历史较短,但其具有抑制肿瘤生长、抗肿瘤转移和浸润、提高机体免疫力等作用,将可以作为肿瘤治疗中的一种重要方法。人参皂甙20(R)-Rg3对人胶质瘤U87凋亡的影响及机制尚不清楚。本研究旨在研究不同浓度Rg3对人胶质瘤U87细胞凋亡的影响,并深入探讨凋亡发生的分子机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞培养 人胶质瘤细胞株U87购自中国科学院上海细胞研究所,细胞培养采用10%小牛血清的高糖DMEM培养液(Corning公司)。细胞在37℃,5%CO2饱和湿度下传代,取用对数生长期的细胞进行研究。
1.1.2 药物 人参皂甙Rg3由大连富生生物技术公司惠赠,纯度99.69%,用二甲基亚砜(DMSO)助溶,然后用RPMI1640细胞培养液稀释成以下6个浓度:200、100、50、25、12.5和6.25μg/mL,-20℃保存备用。
1.2 实验方法
1.2.1 四唑盐(MTT)比色法 对数生长期细胞经0.25%胰酶消化,制成单细胞悬液,调整细胞浓度为5×104/mL,每孔200μL细胞悬液于96孔培养板内,在37℃,5%CO2饱和湿度孵育箱内过夜,取出培养板,弃取旧培养液,分别加入不同浓度的Rg3(200、100、50、25、12.5和6.25μg/mL)和相应浓度的辅料 (50、25、12.5、6.25、3.125 和 1.563mg/mL),200μL/孔,空白对照组加入DMEM 培养液200μL,每组设4个平行孔,分别于24h,48h及72h取出96孔板,每孔加入 MTT(5mg/mL)20μL,培养箱内继续培养4h后,在倒置显微镜下观察细胞内MTT与线粒体酶反应后生成的蓝紫色结晶物,弃上清液,每孔加DMSO 150μL,室温震荡10min,用酶标仪检测570nm波长处的吸光度(A)值,实验共重复3次。按下列公式计算细胞生长抑制率(100%)=(1-加药孔平均A值/对照孔平均A值)×100%。
1.2.2 AO/EB双荧光染色法 取对数生长期细胞接种于6孔板内,加入不同剂量Rg3,各孔终浓度分别为0、12.5、25和50μg/mL,24h后用0.25%胰酶消化细胞,用PBS液洗涤,使其终体积为20 μL,加入AO/EB染液1μL。在荧光显微镜下观察涂片细胞的凋亡,选取3个不同视野,计算细胞凋亡率,每组设3个平行孔。凋亡率(%)=(早期凋亡细胞+晚期凋亡细胞)/总细胞数×100%。
1.2.3 AnnexinV/PI双染法 取对数生长期细胞接种于6孔板内,加入不同剂量Rg3,使各孔终浓度分别为0、12.5、25和50μg/mL。制成单细胞悬液经PBS液洗涤两次后,加入AnnexinV 10μL,避光孵育30min,离心收集细胞。将细胞再次重悬后加入PI 5μL。采用流式细胞仪检测混合液细胞的凋亡状况。正常细胞:AnnexinV/PI(-);早期凋亡:AnnexinV(+)、AnnexinPI(-);晚期凋亡细胞或坏死细胞:AnnexinV/PI(+)。
1.2.4 Western Blotting蛋白印迹 提取对数生长期细胞的蛋白,每孔加入20μL,经SDS-PAGE电泳后,转膜2h,将转膜后的硝酸纤维素膜置入TBST缓冲液中漂洗后,把膜放入稀释的一抗中[PAkt(ser473)兔多抗(1∶1 000)、Akt兔多抗(1∶1 000)、Bcl-2鼠单抗(1∶100)、Bax鼠单抗(1∶200)、β-actin兔多抗(1∶500)],温和震荡3h后置于4℃冰箱中过夜。回收一抗在TBST液中洗膜30min,把膜置入相应稀释的二抗中。取ECL试剂A和试剂B各0.5mL,混合后覆盖硝酸纤维素膜上,在暗室内同时放入X光胶片并作为方向标记,用底片扫描仪扫描X光,通过凝胶成像系统读取目的电泳带的密度扫描值,应用Quantity One软件定量分析目的条带与Actin的灰度值并计算比值。
1.2.5 统计学方法 采用SPSS 18.0软件对数据进行统计分析,计量资料用均数±标准差(±s)表示,采用单因素方差分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 人参皂甙20(R)-Rg3对U87细胞生长的影响
与人参皂甙20(R)-Rg3 6.25μg/mL组相比,其他浓度组人参皂甙20(R)-Rg3在同一作用时间内均对人胶质瘤U87细胞产生抑制作用,差异均有统计学意义(P=0.03)。人参皂甙20(R)-Rg3对肿瘤细胞的抑制效果有时间依赖性,与24h相比,48h及72h组20(R)-Rg3对肿瘤的抑制效果差异有统计学意义(P=0.04)(见表1)。
2.2 AO/EB双荧光染色法检测Rg3对U87细胞凋亡的影响
人参皂甙20(R)-Rg3 25μg/mL作用于 U87细胞,可导致细胞发生不同的形态改变(见图1)。随着Rg3浓度越高,肿瘤细胞发生早期凋亡和晚期凋亡的比例逐渐增高,凋亡细胞与正常细胞比例几乎接近1∶1。

表1 人参皂甙20(R)-Rg3对U87细胞生长的抑制率 (n=4,%)
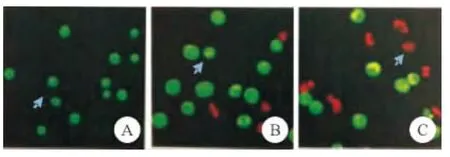
图1 U87细胞AO/EB双荧光下凋亡的形态学表现
2.3 Rg3对U87细胞中Bcl-2家族凋亡及侵袭蛋白影响
经不同浓度人参皂甙20(R)-Rg3作用于U87细胞72h后,实验发现Rg3可以显著降低肿瘤细胞U87中抑凋亡蛋白Bcl-2表达水平,升高促凋亡蛋白Bax的表达。随着Rg3浓度的增加,U87细胞中Bax/Bcl-2比值呈浓度依赖性增加(见图2)。
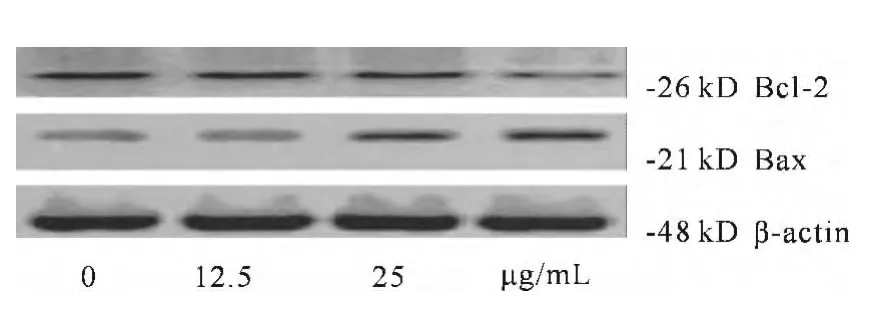
图2 Rg3对U87细胞中Bcl-2、Bax表达的影响
2.4 Rg3对U87细胞中PI3k/Akt信号通路的影响
经不同浓度人参皂甙20(R)-Rg3作用于U87细胞72h后,Western Blot蛋白印迹结果显示,Rg3显著降低肿瘤细胞磷酸化蛋白p-Akt(Ser473)的表达,而并未影响t-Akt蛋白的表达(图4)。
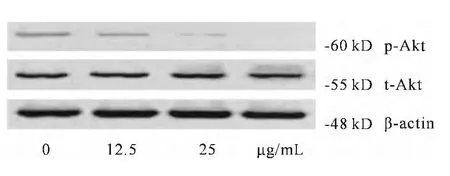
图3 Rg3对U87细胞中PI3K/Akt信号通路蛋白表达的影响
3 讨论
本研究发现6.25μg/mL人参皂甙20(R)-Rg3作用于人胶质瘤U87细胞24h后,可抑制肿瘤细胞的生长,随时间的延长抑制效果显著,而高浓度的Rg3(200μg/mL)对肿瘤细胞的生长抑制率可达97%以上,抑制呈时间-剂量依赖性。本研究采用形态学观察和流式细胞仪检测两种手段对Rg3处理的U87细胞进行观察,发现经人参皂甙20(R)-Rg3处理过的U87细胞体积缩小、核固缩,染色质凝集,部分染色质断裂成小块等典型的凋亡细胞表现。凋亡细胞数量随Rg3浓度增高而明显增多,流式细胞检测结果发现在Rg3处理24h后,肿瘤细胞凋亡比例明显增加。结果提示人参皂甙20(R)-Rg3通过促进细胞凋亡,抑制胶质瘤U87细胞的生长。
细胞凋亡受控于一个异常复杂的网络调控系统,PI3K/Akt信号传导是调节细胞凋亡的一个重要通路[3],胃癌、乳腺癌、肾癌及多种肿瘤均存在PI3K/Akt通路的异常活化。近年来,研究[4]发现70%的胶质瘤也存在PI3K/Akt信号通路的活化,Akt是丝氨酸苏氨酸蛋白激酶家族成员之一,位于PI3K/Akt信号传导通路的核心部位。活化的Akt在介导细胞生长和增殖、细胞凋亡和抵制放化疗方面发挥重要作用[5]。本研究提示人参皂甙20(R)-Rg3能显著降低U87细胞p-Akt蛋白的表达,而对t-Akt蛋白几乎无任何影响。结果提示人参皂甙20(R)-Rg3可能是通过抑制人胶质瘤细胞Akt的活化,抑制肿瘤细胞的生长。有研究[6]发现Bcl-2家族可能是PI3K/Akt通路下游的重要介导者,Akt能负性调节促凋亡的Bcl-2家族成员。Bcl-2家族分为抑制凋亡和促进凋亡蛋白两类,促凋亡因子如Bad、Bax和Bak等,抗凋亡因子如Bcl-2和 Bcl-xL。其中Bax和Bcl-2在凋亡发生过程中发挥重要作用[7]。Bax和 Bcl-2具有拮抗性,它们可以以同源或异源二聚体形式存在,Bcl-2增加时,Bcl-2/Bax比值增加,细胞则趋于存活,反之细胞则趋向死亡,一般认为Bcl-2/Bax比值决定细胞是否凋亡[8]。通常情况下,Bcl-2基因主要分布在机体永久性细胞、增殖旺盛细胞,而在正常神经组织和胶质细胞中Bcl-2基因不表达。在胶质细胞反应性增生及胶质细胞瘤组织则常伴随Bcl-2表达[9],肿瘤的恶性程度越高,Bcl-2基因表达越强[10]。Bcl-2基因表达强度与凋亡细胞密度成显著负相关。研究[11]认为肿瘤细胞中Bax蛋白表达与胶质瘤患者的生存率密切相关。本研究采用Western Blot技术定量分析了人参皂甙20(R)-Rg3对 U87细胞中Bcl-2及Bax蛋白表达的影响,结果发现Rg3能显著降低U87细胞中Bcl-2蛋白的表达,而升高Bax蛋白的表达,同时Bcl-2/Bax比值随着Rg3浓度的升高而增大。研究[12]发现人参皂苷 Rg3与 Bcl-2和Bcl-xL有很高的结合力。Park等[13]研究发现人参皂苷Rg3可以刺激肝细胞线粒体细胞色素酶释放,激活caspase-3和Bax蛋白,抑制Bcl-2蛋白表达,通过直接激活线粒体途径诱导肝细胞凋亡,与本研究结果相似。上述结果提示人参皂甙20(R)-Rg3通过改变Bcl-2及Bax蛋白表达,实现对人胶质瘤U87细胞的凋亡调控。
总之,本研究发现Rg3可能通过抑制PI3K/Akt信号转导通路中的Akt的磷酸化,降低肿瘤细胞抗凋亡蛋白Bcl-2表达,而调高促凋亡蛋白Bax的表达,进而调控人胶质瘤U87细胞的凋亡。
[1]Agarwal S,Manchanda P,Vogelbaum MA,et al.Function of the blood-brain barrier and restriction of drug delivery to invasive glioma cells:findings in an orthotopic rat xenograft model of glioma[J].Drug Metabolism and Disposition,2013,41(1):33-39.
[2]Sin S,Kim SY,Kim SS.Chronic treatment with ginsenoside Rg3induces Akt-dependent senescence in human glioma cells[J].International Journal of Oncology,2012,41(5):1669-1674.
[3]Song G,Ouyang G,Bao S.The activation of Akt/PKB signaling pathway and cell survival[J].Journal of Cellular and Molecular Medicine,2005,9(1):59-71.
[4]Rajasekhar VK,Viale A,Socci ND,et al.Oncogenic Ras and Akt signaling contribute to glioblastoma formation by differential recruitment of existing mRNAs to polysomes[J].Molecular Cell,2003,12(4):889-901.
[5]Song T,Wang L,Mo Z,et al.Expression of p-Akt in ovarian serous carcinoma and its association with proliferation and apoptosis[J].Oncology Letters,2014,7(1):59-64.
[6]Asnaghi L,Calastretti A,Bevilacqua A,et al.Bcl-2 phosphorylation and apoptosis activated by damaged microtubules require mTOR and are regulated by Akt[J].Oncogene,2004,23(34):5781-5791.
[7]Karmakar S,Banik NL,Patel SJ,et al.5-Aminolevulinic acid-based photodynamic therapy suppressed survival factors and activated proteases for apoptosis in human glioblastoma U87MG cells[J].Neuroscience Letters,2007,415(3):242-247.
[8]Yang E,Korsmeyer SJ.Molecular thanatopsis:a discourse on the Bcl2family and cell death[J].Blood,1996,88(2):386-401.
[9]Gomez M,Lianga P,Fueyo J,et al.Transfer of E2F-1to human glioma cells results in transcriptional up-regulation of Bcl-2[J].Cancer Res,2001,61(18):6693-6697.
[10]McDonald FE,Ironside JW,Gregor A,et al.The prognostic influence of Bcl-2in malignant glioma[J].British Journal of Cancer,2002,86(12):1899-1904.
[11]Cartron PF,Oliver L,Martin S,et al.The expression of a new variant of the pro-apoptotic molecule Bax,Baxpsi,is correlated with an increased survival of glioblastoma multiforme patients[J].Hum Mol Genet,2002,11(6):675-687.
[12]Sathishkumar N,Sathiyamoorthy S,Ramya M,et al.Molecular docking studies of anti-apoptotic BCL-2,BCL-XL,and MCL-1proteins with ginsenosides from Panax ginseng[J].Journal of Enzyme Inhibition and Medicinal Chemistry,2012,27(5):685-692.
[13]Park HM,Kim SJ,Kim JS,et al.Reactive oxygen species mediated ginsenoside Rg3-and Rh2-induced apoptosis in hepatoma cells through mitochondrial signaling pathways[J].Food and Chemical Toxicology,2012,50(8):2736-2741.

