吡非尼酮及盐酸氨溴索对百草枯诱导的大鼠急性肺损伤保护作用的比较
韩枫,凌心
(徐州市肿瘤医院药剂科,徐州 221005)
百 草 枯 [1,l'-二 甲 基-4,4'联吡啶氯化物](paraquat,PQ),又名克芜踪,为有机杂环类除草剂,因误服等因素造成的PQ中毒较为常见[1],其病死率可高达60.0%~81.6%[2],患者多死于多脏器功能衰竭或呼吸衰竭。近年来上市的吡非尼酮(pirfenidone,PF)是用于治疗肺纤维化的药物,研究[3]证实其具有抗炎、抗氧化作用。据报道[4],盐酸氨溴索(ambroxol hydrochloride,AH)对PQ中毒大鼠肺损伤具有保护作用,因此本研究通过建立大鼠PQ中毒肺损伤模型,初步探讨PF和AH对PQ中毒所致大鼠急性肺损伤是否有保护作用,并比较各组相关检测指标。
1 材料和方法
1.1 实验动物、药品和试剂
雄性成年SD大鼠40只,体质量280~300g,徐州医学院动物中心提供;PF(纯度99%),南京荣世医药科技有限公司;AH,常州四药制药有限公司,规格30mg/支,批号20120511T2;20%PQ 溶液,山东三元工贸有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)测定试剂盒,南京建成生物工程研究所;大鼠白细胞介素-6(IL-6)和肿瘤坏死因子α(TNF-α)ELISA 试剂盒,上海西塘生物有限公司。
1.2 主要仪器及设备
UV-754紫外可见分光光度计,上海精密科学仪器有限公司产品;TGL-16G台式高速离心机,上海安亭科学仪器厂产品;SSH-2型电热恒温水浴锅,上海精密科学仪器有限公司产品;IX71光学显微镜,日本奥林巴斯光学工业株式会社。
1.3 实验方法
1.3.1 大鼠急性肺损伤模型的制备 将SD大鼠随机分为4组,每组10只,分别为正常对照组、PQ组、AH阳性对照组(AH组)及PF治疗组(PF组)。自由饮食1w后,PQ组、AH组和PF组大鼠给予一次性腹腔注射PQ溶液25mg/kg,正常对照组给予腹腔注射等量生理盐水。腹腔注射1h后,PF组灌胃给予PF治疗,PF剂量为50mg/kg[溶于0.5%的羧甲基纤维素纳(CMC-Na中)],AH 组给予腹腔注射 AH 50mg/kg(每只 AH 针剂加入1mL生理盐水,配成30mg/mL溶液),正常对照组大鼠灌胃给予等量CMC-Na溶液。
1.3.2 样本采集 连续给药1w后,麻醉各组大鼠;腹主动脉采血,3 500r/min离心15min,分离血清,用于测定炎症因子。取大鼠左肺置于体积分数为4%多聚甲醛固定液中固定,取右肺上叶称重后置于烤箱中,70℃烘烤至恒重后称干重,计算肺组织湿重/干重比(W/D)值,立刻将其与左肺保存于-80℃,并进行后续生化指标测定。
1.3.3 组织病理学观察 将固定好的大鼠左肺组织进行常规石蜡包埋,连续性49μm切片,苏木精-伊红(HE)染色后,光镜下观察病理学变化。
1.3.4 生化指标测定 大鼠右肺组织匀浆后,3 000r/min离心10min,取上清,测定SOD、MDA和GSH的水平,严格按照试剂盒规定的方法比色测定吸光度,按公式换算成SOD的活性以及MDA和GSH的浓度。
1.3.5 TNF-α及IL-6含量测定 ELISA 法测定离心后的血清中TNF-α及IL-6含量。
1.4 统计学方法
采用SPSS 13.0统计软件进行统计学分析,数据以均数±标准差(±s)表示,组间比较采用oneway ANOVA分析,P<0.05为差异有统计学意义。
2 结果
2.1 HE染色
正常对照组肺泡结构清晰,肺泡壁薄,肺泡间隔无增宽及充血,无炎性细胞浸润及出血现象(见图1A);PQ组大鼠肺组织成纤维细胞大量增殖,肺充血、肺水肿及炎性细胞浸润病变严重处见纤维瘢痕样组织,肺泡萎陷或消失(见图1B);AH组肺组织损失明显减轻(见图1C);给予PF治疗后肺组织损伤情况减轻(见图1D)。
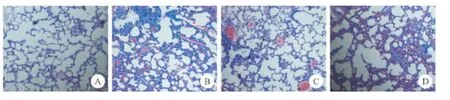
图1 肺组织HE染色
2.2 肺组织湿重/干重比(W/D)
与正常对照组比较,PQ组 W/D值显著上升(P<0.01);与PQ组相比,AH 组 W/D降低 (P<0.05),PF组 W/D 降低 (P<0.05);PF组与 AH组相比,差异无统计学意义(P>0.05)(见表1)。
表1 PF对小鼠肺组织SOD活性和MDA含量的影响(±s,n=6)

表1 PF对小鼠肺组织SOD活性和MDA含量的影响(±s,n=6)
与正常对照组比较,**P<0.01;与PQ组比较,#P<0.05
组别 W/D正常对照组2.36±0.22 PQ组 6.03±0.16**AH组 3.91±0.12#PF组 4.21±0.14#
2.3 肺组织SOD活性、MDA和GSH含量
与正常对照组比较,PQ组肺组织SOD活性显著降低 (P<0.001),MDA含量显著升高 (P<0.001),GSH含量显著降低 (P<0.01);与PQ 组比较,AH组大鼠肺组织SOD活性升高 (P<0.05),MDA含量降低(P<0.05),GSH 含量升高(P<0.05);与PQ组比较,PF组大鼠肺组织SOD活性升高 (P<0.05),MDA含量降低(P<0.05),GSH含量升高(P<0.05);PF组SOD活性、MDA及GSH含量与AH组相比,差异无统计学意义(P>0.05)(见表2)。
表2 PF对小鼠肺组织SOD活性和MDA含量的影响(±s,n=6)
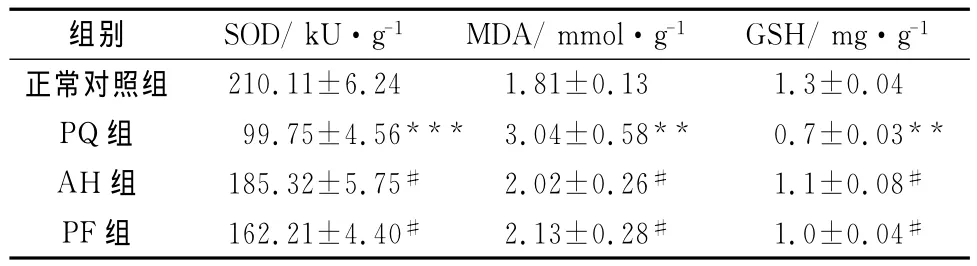
表2 PF对小鼠肺组织SOD活性和MDA含量的影响(±s,n=6)
与正常对照组比较,***P<0.001,**P<0.01;与PQ组比较,#P<0.05
组别 SOD/kU·g-1 MDA/mmol·g-1 GSH/mg·g-1正常对照组210.11±6.24 1.81±0.13 1.3±0.04 PQ组 99.75±4.56*** 3.04±0.58**0.7±0.03**AH组 185.32±5.75#2.02±0.26#1.1±0.08#PF组 162.21±4.40#2.13±0.28#1.0±0.04#
2.4 血清中IL-6和TNF-α含量
与正常对照组比较,PQ 组血清中IL-6和TNF-α含量显著升高 (P<0.001);与PQ组比较,AH组IL-6和 TNF-α含量明显降低 (P<0.01);与PQ组比较,PF组IL-6和TNF-α含量亦降低 (P<0.01);PF组IL-6和 TNF-α含量与 AH 组相比,差异无统计学意义(P>0.05)(见表3)。
表3 大鼠血清中IL-6和TNF-α含量(±s,n=6)

表3 大鼠血清中IL-6和TNF-α含量(±s,n=6)
与正常对照组比较,***P<0.001;与PQ组比较,##P<0.01
组别 IL-6(pg/mL) TNF-α(pg/mL)正常对照组10.58±4.35 70.30±10.11 PQ组 592.76±5.62***637.90± 5.89***AH组 326.82±3.77##190.50± 6.43##PF组 384.54±2.89##222.53±11.32##
3 讨论
急性肺损伤作为PQ中毒的主要临床表现,目前认为其发生可能主要与氧自由基、过度脂质过氧化反应所产生脂质过氧化物及体内减少的还原型GSH有关[5],复杂的发病机制导致其临床治疗难度较大。在PQ中毒的临床治疗方面,血浆灌流和血液置换是目前降低患者死亡率的最有效措施,但由于多数患者无法得到及时救治,临床治疗效果依然不容乐观。肺损伤的出现,除导致患者呼吸系统障碍以外,大量炎性介质“瀑布式释放”同样会促进其它器官的损伤,最终使患者死于心衰或全身器官功能衰竭等合并症[6]。因此,及时有效地改善PQ中毒患者的肺损失和呼吸系统症状,对于降低患者的死亡率和提高患者抢救成功后的生存质量均有重要的临床意义。但是在PQ中毒的临床用药方面,激素类药物、依达拉奉以及N-乙酞半肤氨等典型药物目前仅被证明在PQ中毒的动物模型中具有较好的治疗效果[7],但在人体研究方面尚缺乏可靠的临床结论,高效、安全的抗PQ中毒症状的药物亟待开发。
在本次研究中,分别以AH和PF为模型药物,对PQ诱导大鼠模型的急性肺损伤进行治疗。研究发现,给予PQ中毒大鼠PF或AH治疗后,肺组织SOD活性、GSH含量均上升,且 MDA含量下降,W/D下降;HE染色结果亦表明,PF或AH治疗后,肺损伤减轻,血清中IL-6和TNF-α的含量均降低,提示PF和AH均可明显降低PQ中毒大鼠肺组织中氧化应激和炎症反应水平。郑玉兰等[8]和李伟[9]分别以AH和PF为治疗药物,对其抗PQ所致肺损伤的临床疗效和机制进行了评价,结论与本研究的结果基本一致。本研究所涉及的评价指标中,肺组织W/D的变化可较好地反映肺间质及肺泡血管通透性改变,SOD、MDA及GSH常作为自由基损伤的观察指标,其水平的变化可大致反映机体清除自由基和抗脂质过氧化损伤的能力,进一步表明PF和AH抗PQ诱导的肺损伤作用机制与改变肺组织自由基活性及炎症反应有关。此外,PF组与AH组的治疗效果对比显示,两组的各项评价指标间比较差异无统计学意义(P>0.05),与既往研究[10]基本一致。
综上所述,PF和AH在改善PQ诱导的肺损伤方面均具有明确的临床疗效,可为该类中毒症状的治疗提供参考。但由于目前国内外均缺乏大样本量的人体研究结论,更加深入、全面、严谨的研究仍有必要。
[1]Lee Y,Lee JH,Seong AJ,et al.Arterial lactate as a predictor of mortality in emergency department patients with paraquat intoxication[J].Clinical Toxicology,2012,50(1):52-56.
[2]Gawarammana IB,Buckley NA.Medical management of paraquat ingestion [J]. British Journal of Clinical Pharmacology,2011,72(5):745-757.
[3]Potts J,Yogaratnam D.Pirfenidone:a novel agent for the treatment of idiopathic pulmonary fibrosis[J].Annals of Pharmacotherapy,2013,47(3):361-367.
[4]马玉腾,杜月菊,张军立,等.盐酸氨溴索对百草枯中毒大鼠肺SP-D表达及肺损伤的保护作用[J].中华急诊医学杂志,2013,22(7):737-740.
[5]Zhi QM,Yang LT,Sun HC.Protective effect of ambroxol against paraquat-induced pulmonary fibrosis in rats[J].Internal Medicine (Tokyo,Japan),2010,50 (18):1879-1887.
[6]Xaubet A,Serrano-Mollar A,Ancochea J.Pirfenidone for the treatment of idiopathic pulmonary fibrosis[J].Expert Opin Pharmacother,2014,15(2):275-281.
[7]Dinis-Oliveira RJ,Duarte JA,Sanchez-Navarro A,et al.Paraquat poisonings:mechanisms of lung toxicity,clinical features,and treatment[J].Critical Reviews in Toxicology,2008,38(1):13-71.
[8]郑玉兰,曹锋生.大剂量氨溴索对外伤所致肺损伤患者临床疗效的研究[J].临床急诊杂志,2013(1):24-26.
[9]李伟.吡啡尼酮对百草枯中毒小鼠急性肺损伤的保护机制研究[D].南京:南京大学,2011.
[10]高渝峰,廖晓星,李玉杰,等.大剂量盐酸氨溴索治疗急性百草枯中毒肺损伤的临床观察[J].中国急救复苏与灾害医学杂志,2008,3(5):261-263.

