胶原蛋白海绵浸提液对小鼠体外脾脏淋巴细胞转化作用的研究
【作 者】吴世福,刘成虎,侯丽,孙晓霞,盖潇潇,施燕平
山东省医疗器械产品质量检验中心;山东省医疗器械生物学评价重点实验室,济南市,250101
近年来,随着人们对医疗器械免疫毒理学安全性认识的不断深入,针对医疗器械,特别是动物源性医疗器械和组织工程产品中免疫原的评价逐渐成为医疗器械产品开发和安全性评价的热点领域之一。众所周知,有效控制医疗器械中含有的免疫原是控制相关产品潜在免疫毒性反应的关键所在。一般来说,机体对医疗器械中免疫原的反应大体可以分为体液免疫应答和细胞免疫应答两大类。其中,淋巴细胞转化试验是反映免疫原诱导细胞免疫应答的重要方法。其原理为当淋巴细胞在受到免疫原刺激时,可发生免疫应答反应并发生转化和增殖,通过检测淋巴细胞转化和增殖能力的强弱即可判定免疫原刺激能力的大小。
目前,实验室中常用于检测淋巴细胞转化和增殖的方法主要有3H-TdR掺入法和MTT法[1-2]。3H-TdR掺入法虽然敏感性较高,但需要实验室具有使用放射性材料的资质并且操作人员需取得相应的操作合格证书。因此,难以在大范围内推广。相比较而言,MTT法虽然具有操作简便、快捷和安全等优点,但却难以排除不同群体淋巴细胞之间存在的干扰因素,因此在适用范围上也受到了一定的限制。羧基荧光素乙酰乙酸(CFSE)是近年来使用较为普遍的一种用于检测细胞增殖的荧光染色标志物[3-4]。它可以穿透活细胞膜并不可逆地与活体细胞内蛋白质结合。当细胞分裂时,CFSE标记荧光可平均分配至两个子代细胞中,其荧光强度也变为亲代细胞的一半。因此,在一个增殖的细胞群中,各个连续细胞代的荧光强度呈2倍递减。将CFSE标记的淋巴细胞通过流式细胞术进行分析,可以快速准确地检测出特定亚群淋巴细胞的转化和增殖情况。与MTT法相比,CFSE标记法不但具有准确、快捷等优点,还与MTT法之存在良好的关联性。
胶原蛋白海绵是近年来开发上市的一种新型动物源性功能敷料。该产品的胶原成分一般取自牛跟腱,经不同加工工艺处理制得胶原蛋白海绵,主要用于创面止血和创伤修复,为可降解植入类医疗器械产品,并且具有良好的生物相容性。但是作为动物源性医疗器械产品,其在加工处理过程中无法彻底消除免疫原性。因此,选用合适的免疫原性评价方法对该类产品进行评价,将会有助于消除其潜在的免疫毒理学风险。根据ISO10993-20[5]中推荐采用的淋巴细胞增殖试验来评价医疗器械对淋巴细胞免疫功能的方法,本研究分别在体外利用MTT法和CFSE法研究胶原蛋白海绵浸提液对小鼠脾脏淋巴细胞转化和增殖作用的影响,旨在评价胶原蛋白海绵的免疫原性并探索建立一套体外评价医疗器械免疫原性的优化方法。
1 材料与方法
1.1 动物和细胞
雌性BALB/c小鼠,(6~8)周龄,(18~22)g,购自山东鲁抗实验动物中心;L929细胞系购自中国实验细胞库。
1.2 试剂和器具
所以试剂 刀豆蛋白A Ⅳ型(ConA)和脂多糖(LPS)(Sigma公司);MTT(Sigma公司);CFSE(Invitrogen公司);PE-CD3抗体(eBioscience,USA);RPMI1640培养基(GIBCO公司)。所用器具 倒置显微镜(Olympus TH4-200);快速细胞分析仪(CASY-TT,德国innovatis AG);全自动酶标仪(Multiskan MK3);流式细胞仪(Becton Dickinson,USA)。
1.3 试验样品及处理
胶原蛋白海绵由合作单位提供。细胞毒性试验中阴性对照产品高密度聚乙烯和阳性对照SPUZDEC均购自日本Hatano研究所。按照ISO10993-12的原则[6],取30 cm2无菌胶原蛋白海绵样品,以RPMI1640完全培养基为浸提介质,测定“吸收容量”后,按照6 cm2/mL的比例,在37±1oC的条件下浸提72±2 h,制备浸提液备用。
1.4 细胞毒性筛选试验
阳性对照组和阴性对照分别选取MEM完全培养基为浸提介质,按照0.1g/mL的比例,在37±1oC的条件下浸提24±2 h,制备浸提液,按ISO10993-5[7]中要求,对SPU-ZDEC、高密度聚乙烯和胶原蛋白海绵产品的浸提液进行体外细胞毒性筛选试验。
1.5 淋巴细胞制备
脱颈椎处死3只BALB/c小鼠,无菌取脾,研磨制备单细胞悬液,收集细胞悬液,混合后 400 g离心5 min,弃上清,加5 mL红细胞裂解液,混匀,4oC孵育5 min,加入含10%FCS的RPMI1640培养液终止反应,400 g离心5 min,弃上清,加入含10%FCS的RPMI1640培养液调整细胞浓度至 2×106U/mL。
1.6 试验分组
试验共分为以下几组:
(1)阴性对照组(细胞对照,VC);
(2)阳性对照组1(细胞+ ConA,5 µg/mL);
(3)阳性对照组2(细胞+ LPS,10 µg/mL);
(4)试验组1:细胞+第一种浓度抗原(浸提液原液);
(5)试验组2:细胞+第二种浓度抗原(浸提液原液50%稀释)。
1.7 试验步骤
1.7.1 MTT试验
将细胞悬液加入96孔板,每孔200 µL,设6个复孔。阳性对照组1加入ConA至终浓度为5 µg/mL,阳性对照组2加入LPS至终浓度为10 µg/mL,试验平板在37oC,5%CO2培养箱中培养3 d 后取出,600 g离心5 min,弃上清,加入MTT(1 mg/mL),50 µL /孔,继续培养6 h,加入DMSO,150 µL/孔,振荡平板至甲臜颗粒完全溶解,在酶标仪上570 nm波长处测定吸光度值(OD),参照波长为630 nm。
1.7.2 CFSE试验
无菌制备小鼠脾脏淋巴细胞悬液,用PBS至少洗2次,用2 mL含0.1%BSA的PBS重悬细胞,分别加入CFSE,终浓度为5 µMol/L。37oC避光孵育15 min~30 min。加入3 mL预冷的含2%FCS的RPMI1640培养液终止染色反应,冰上放置5 min后400 g离心5 min,加入含10%FCS的RPMI1640培养液2 mL。按实验分组将细胞悬液加入24孔板,1 mL/孔,每组设3个复孔。试验平板在37oC,5%CO2培养箱中培养3 d后,收集各孔细胞,用PE标记的抗小鼠CD3单克隆抗体在4oC避光条件下孵育30 min后,应用流式细胞术进行分析。
1.8 统计学分析
1.8.1 MTT试验
记录各组吸光度A的平均值。应用t-检验法来判定试验结果。与阴性对照组相比,P<0.05具有统计学意义。
1.8.2 CFSE试验
记录各组淋巴细胞的增殖百分比。应用t-检验法来判定试验结果。与阴性对照组相比,P<0.05被认为有统计学意义。
2 结果
2.1 细胞毒性筛选试验结果
按ISO10993-5:2009的要求采用浸提液接触法进行细胞毒性试验,结果显示,空白对照组和阴性对照组细胞生长繁殖旺盛,形态良好。阳性对照组细胞在48 h内100%细胞发生圆缩死亡。各试验样品组细胞生长繁殖旺盛,形态良好。正常细胞数量不少于空白对照组的80%。因此,定性判定试验样品浸提液对L929细胞的细胞毒性为I级,表明该产品的浸提液无明显细胞毒性作用。
2.2 MTT法检测体外淋巴细胞转化的结果
在细胞毒性筛选的基础上,根据试验分组利用MTT法进行体外淋巴细胞转化试验。结果显示,与阴性对照组相比,阳性对照组吸光度A显著增加(P<0.05),而试验组与阴性对照组之间吸光度A值无明显差异(P>0.05),表明胶原蛋白海绵产品浸提液不能在体外引起小鼠脾脏淋巴细胞发生明显的增殖和转化(见图1)。
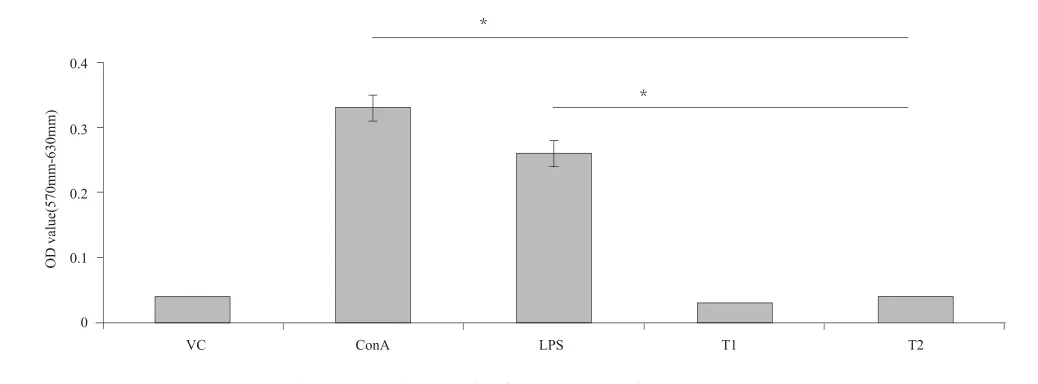
图1 MTT法测定小鼠体外脾脏淋巴细胞转化结果(*P<0.05)Fig.1 Results of mouse splenic lymphocyte transformation assay with MTT method in vitro (*P<0.05)
2.3 CFSE法检测体外T淋巴细胞转化试验的结果
在MTT试验结果的基础之上,我们进一步选用CFSE荧光掺入和PE-CD3抗体标记染色法分析试验样品对T淋巴细胞转化增殖的影响。流式结果显示,与阴性对照组相比,阳性对照组细胞发生明显增殖,出现了多个增殖峰,增殖百分率从(6.01±0.9)%增加到(14.7±0.1)%,见图2(a)和图2(b),而实验组细胞与对照组细胞间无显著性差异(P>0.05)。
3 讨论
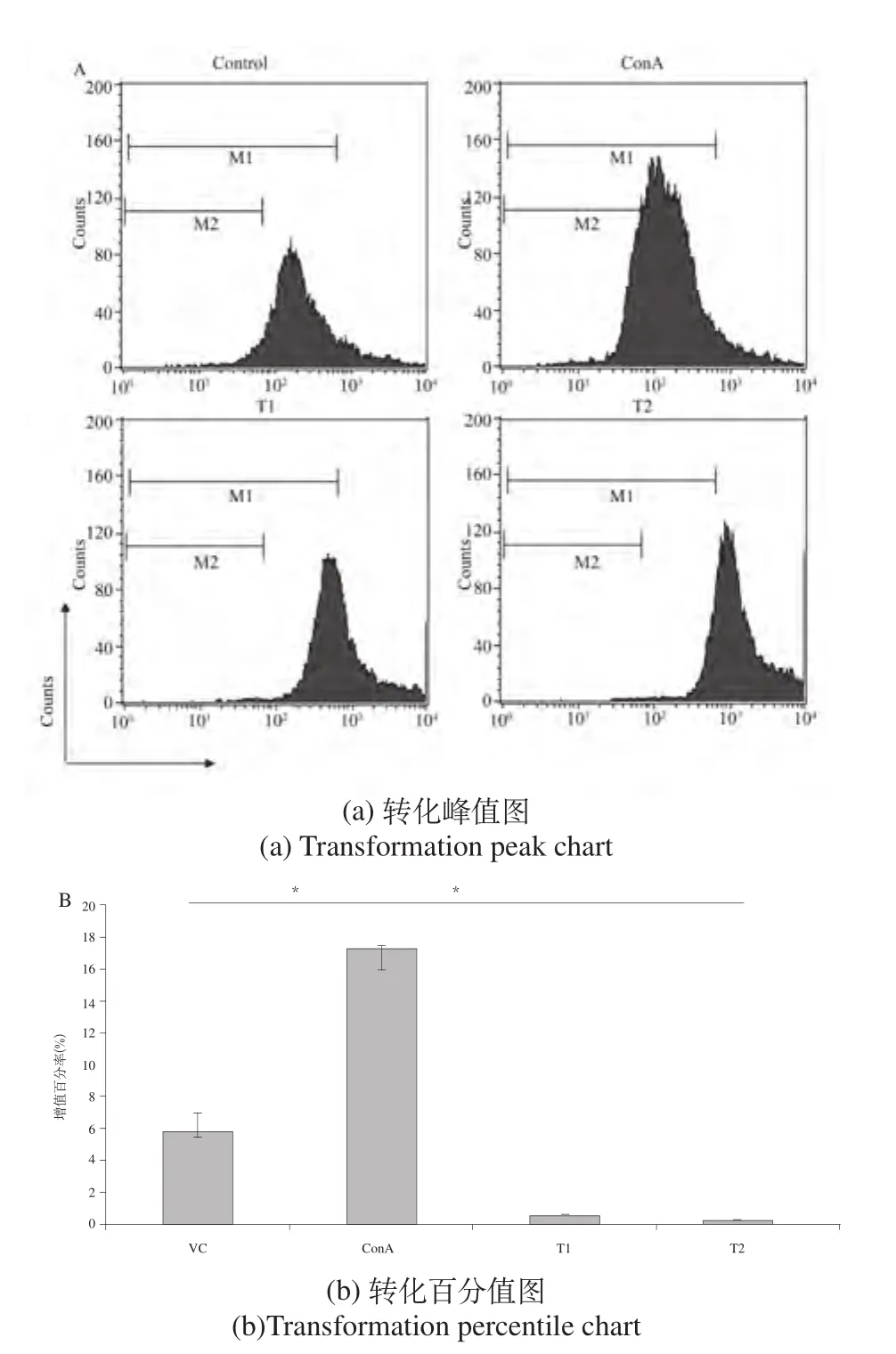
图2 CFSE法测定小鼠体外脾脏T淋巴细胞转化结果(*P<0.05)Fig.2 Results of mouse splenic T lymphocyte transformation assay with CFSE method in vitro (*P<0.05)
多年来,免疫应答的特性一直是研究的热点领域。然而,关于医疗器械/材料免疫原性的研究却很少。并且,目前还不清楚医疗器械/材料刺激机体产生的免疫应答对宿主有利还是有害。因此,应用医疗器械/材料或其浸提物进行免疫应答研究来获取相关的信息是非常重要的,特别是针对动物源性医疗器械,由于缺少评价免疫原性的技术和方法,很多该类产品在没有经过充分安全性评价的情况下上市,为临床应用和患者的健康留下了隐患。因此,亟需在传统组织学评价方法的基础上,开发出新的安全性评价方法来评价该类器械潜在的免疫毒理学作用以及对临床使用后组织重建的长期影响。淋巴细胞增殖和转化能力是衡量机体细胞免疫功能的重要指标,针对淋巴细胞增殖和转化能力的研究将有助于揭示医疗器械作用于人体后潜在的免疫毒理学反应。
在本研究中,我们首先对所选取的动物源性胶原蛋白海绵浸提液进行了体外细胞毒性研究,定性评价结果显示,该产品浸提液无明显细胞毒性作用。这为进一步使用MTT和CFSE标记进行淋巴细胞增殖和转化研究提供了前提条件。在MTT试验中,各实验组细胞吸光度值均小于阳性对照组,提示试验组细胞增殖程度小于阳性对照组,但各实验组之间无显著性差异(见图1)。在CFSE荧光标记法中,阳性对照组细胞发生明显多峰增殖现象,而与对照组相比,各试验组细胞中CD3+T淋巴细胞未发生明显增殖(见图2),这表明,MTT法与CFSE法之间存在良好的关联性。但是,与MTT法只能分析全部细胞增殖情况不同,结合荧光抗体标记及流式细胞术,CFSE法可以便捷、高效地分析出小鼠脾脏淋巴细胞中CD3+T细胞群体的增殖情况。例如,MTT法无法区分这一群细胞总体分裂一次与这群细胞中1/2的细胞分裂两次测得的结果,而CFSE法则可以清晰追踪特定细胞群体的整个分裂增殖过程。这里需要注意的是,实验组细胞的平均荧光强度高于对照组,初步考虑为试验样品浸提液的处理促进了CFSE与淋巴细胞之间的结合,但具体机制还需要进一步的研究。
影响本研究的关键因素包括ConA和LPS的浓度、试验周期的长短和CFSE的标记条件以及细胞计数的准确性。试验中,我们选用的ConA终浓度为5 µg/mL,这是在参考文献报道和预实验基础上给出的浓度[8]。结果显示,5 µg/mL 的ConA能够较好地保证试验系统的正常工作,同时也可用于比较T淋巴细胞对丝裂原和免疫原的免疫应答。而LPS的浓度则是依据预实验得出的。试验周期的选择是影响本研究的另一重要因素。针对淋巴细胞对生物材料中免疫原的应答,ASTM F1906标准[9]中推荐的试验周期为7 d,我们先后选用3 d、5 d和7 d的培养体系,综合考虑细胞增殖高峰期和荧光淬灭等多种因素的影响,最终确定采用3 d的培养体系进行试验。但是具体到不同的试验样品,建议实验者根据试验样品的特性、文献报道以及预实验的结果来确定具体的试验周期。CFSE的标记条件也是在参考文献报道和预实验的基础上给出的[10]。结果显示,在选用终浓度为5 µMol/L的 CFSE时,37oC避光孵育15 min~30 min的标记时间符合该试验的要求。需要注意的是,不同CFSE试剂盒中会有不同的标记浓度和标记时间,实验者应根据预实验的结果来摸索具体的标记条件。本研究采用德国CASY-TT自动细胞计数仪,将脾淋巴细胞计数到2×106U/mL,计数结果比手工计数更为准确,有效保证了试验结果的严谨性和科学性。
另外,试验中需严格遵守无菌操作规则。一般不建议在试验培养液中使用除青霉素/链霉素或庆大霉素以外的抗生素,因为它们的作用方式有可能干扰到细胞免疫应答。本研究通过CFSE荧光标记术来研究动物源医疗器械对小鼠脾脏淋巴细胞转化和增殖作用的影响,并将其与传统的MTT法进行比较,为CFSE法在医疗器械免疫原性检测中的运用奠定了基础。
[1]Sawicki W,Ostrowski K,Platkowska E.High-speed autoradiography of 3H-thymidine-labelled nuclei[J].Histochemistry,1977,24; 52(4): 341-347.
[2]Mosmann T.Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J].J Immunol Methods.1983,65(1-2): 55-63.
[3]Lyons AB,Parish CR.Determination of lymphocyte division by fl ow cytometry[J].J Immunol Methods.1994,171(1): 131-137.
[4]Hodgkin PD,Lee JH,Lyons AB.B cell differentiation and isotype switching is related to division cycle number[J].J Exp Med,1996,184(1): 277-81.
[5]ISO/TS 10993-20:2006 Biological evaluation of medical devices–Part 20: Principles and methods for immunotoxicology testing of medical devices[S].
[6]ISO 10993-12: 2012 Biological evaluation of medical devices-Part 12 Sample preparation and reference materials[S].
[7]ISO 10993-5: 2009 Biological evaluation of medical devices-Part 5:Tests for in vitro cytotoxicity[S].
[8]刘民,马华,李柏青. MTT 法检测小鼠淋巴细胞增殖性反应探讨[J].中国实验动物学杂志,1999,9(3): 146-149.
[9]ASTM F1906(2003) Standard Practice for Evaluation of Immune Responses In Biocompatibility Testing Using ELISA Tests,Lymphocyte Proliferation,and Cell Migration.
[10]Lyons AB.Analysing cell division in vivo and in vitro using fl ow cytometric measurement of CFSE dye dilution[J].J Immunol Methods.2000,243(1-2): 147-154.

