庆大霉素耳毒性模型大鼠耳蜗凋亡诱导因子表达及阿司匹林的拮抗作用△
陈晓栋 王烨 丁忠家 杨佳蕾 王曦 赵昱 岳波 陈福权 邱建华
1 第四军医大学西京医院全军耳鼻咽喉-头颈外科专科中心(西安710032);2 第四军医大学西京医院神经内科
庆大霉素是氨基糖苷类抗生素的代表性药物[1],自上世纪40年代起已被普遍认识了其耳毒性[2],但因其对抗结核菌和革兰氏阴性菌有较好的疗效,至今仍在广泛使用。以往认为庆大霉素的耳毒性作用主要是通过氧自由基损害内耳毛细胞导致耳聋,抗氧化剂可以减轻庆大霉素的耳毒性损伤[3]。阿司匹林(acetylsalicylic acid,ASA)是一种廉价的解热镇痛抗炎药,又是一种良好的抗氧化剂 ,1999年~2003年西京医院耳鼻咽喉头颈外科与美国密歇根大学听力研究中心联合开展了阿司匹林预防庆大霉素耳毒性的临床随机对照试验[5],研究结果表明,同时应用阿司匹林可以有效减轻庆大霉素的耳毒性损伤[6],但具体机制未做进一步研究。阿司匹林拮抗庆大霉素耳毒性过程中是否有细胞凋亡的参与,细胞凋亡诱导因子(apoptosis-inducing factor,AIF)[7]是否参与了细胞的凋亡尚不清楚,因此,本研究拟观察阿司匹林拮抗庆大霉素耳毒性过程中,SD大鼠听功能、毛细胞形态变化、毛细胞凋亡及在毛细胞凋亡过程中AIF的表达变化。
1 材料与方法
1.1 实验动物及分组 选用成年SD大鼠20只,雌雄不拘,由第四军医大学实验动物中心提供,体重100~150g,随机分为GM组和ASA+GM组,每组各10只动物。
1.2 实验方法
1.2.1 两组用药方法 GM组:硫酸庆大霉素(天津药业焦作有限公司生产,批号130360)120mg·kg-1·d-1,腹腔注射,连续21天。ASA+GM 组:阿司匹林(沈阳奥吉娜药业有限公司生产,批号H20065051)100mg/kg[8]灌胃,每天1次,1小时后皮下注射庆大霉素,剂量同GM组,连续21天。实验期间动物每天称体重以调整药量。
1.2.2 听性脑干反应(ABR)检测 两组大鼠分别在用药前1d,用药第7、14及21d分别行ABR测试。测试仪器为RZ6(美国TDT公司)诱发电位测试仪测试在隔声屏蔽室内进行,隔声室环境噪声符合国家标准GB/T16403规定,并采取电磁屏蔽措施,专业地线接地。大鼠腹腔注射15%水合氯醛150mg/kg麻醉,1寸毫针作为电极,记录电极置于颅顶正中皮下,参考电极置于测试耳耳后皮下,接地电极刺于尾巴根部皮下。刺激声为短纯音(tone burst),由MF1-S立体磁性扬声器输出,耳机距动物外耳道口2cm;声刺激重复率21.97次/秒,滤波带100~3 000Hz,叠加1 024次,上升与下降时间为0.5ms,间隔时间为45.517ms,扫描时间为10 ms,以能引出ABR波Ⅲ的最小刺激声强度为ABR反应阈。
1.2.3 耳蜗基底膜铺片[9]染色及外毛细胞计数两组动物连续用药完成,在第21天检测ABR后每组各取2只大鼠,迅速断头后取出颞骨,开放听泡,在解剖显微镜下,在蜗尖处钻一小孔,去除镫骨,钩针挑开蜗窗及卵圆窗,使用玻璃吸管将4%的多聚甲醛从蜗尖小孔处吹入耳蜗,观察有无液体从蜗窗和卵圆窗处流出,后灌注过程中使用力量切勿过大,以免损伤蜗内组织。后灌注后将耳蜗置4%的多聚甲醛溶液内4℃过夜,然后再在乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)中脱钙3天。脱钙完成后在解剖显微镜下小心的去除耳蜗的骨壳,去除血管纹、螺旋韧带,撕去前庭膜,将基底膜小心从骨螺旋板上游离下来,再于FITC-phalloidin 37℃ 孵育40min,PBS漂洗3次,每次10分钟,DAPI 37℃ 孵育20min,PBS漂洗后将基底膜移至载玻片上,甘油封片,荧光显微镜下观察及摄片。
1.2.4 免疫荧光染色 两组动物连续用药完成,在第21天检测ABR后每组各取2只,同上法将基底膜小心从骨螺旋板上游离下来后,放入装有PBS溶液的EP管内待用,将EP管内的PBS液体抽出,加入0.3%TritonX-100进行透膜处理30分钟,0.01 mmol/LPBS溶液漂洗3次,每次10分钟;洗净后加入5%的驴血清封闭液,封闭40分钟,吸出一抗液体,0.01mmol/LPBS溶液漂洗3次,每次10分钟,再加入一抗AIF单克隆抗体稀释液(1:100),4℃过夜,而后在避光条件下进行后续染色,加入荧光二抗594(1:200)37℃孵育2小时,0.01mmol/LPBS溶液漂洗3次,每次10分钟,加入鬼笔环肽稀释液(1:60),常温避光20分钟。吸出鬼笔环肽稀释液,加入0.01mmol/L的PBS溶液内,漂洗3次,每次10分钟,DAPI常温染色10分钟。洗净后再将基底膜在解剖显微镜下分段剪开,分清楚基底膜正反面后铺于玻片上,并用滤纸吸除标本边缘多余水分,以85%的甘油封片,防止荧光淬灭,激光共聚焦显微镜下观察拍照。AIF阳性表达表现为红色荧光,鬼笔环肽阳性表达为绿色荧光,DAPI衬染细胞核为蓝色荧光。
1.3 统计学方法 运用SPSS17.0和Excel软件对数据进行统计分析及图表绘制,组间两两比较采用单因素方差分析SNK-q检验,检验标准α=0.05。
2 结果
2.1 两组动物ABR反应阈比较 由表1可见,两组大鼠用药前ABR各频率反应阈差异无统计学意义(P>0.05),用药第7、14、21dGM 组各频率ABR反应阈均高于用药前1天(均为P<0.05),而ASA+GM组用药第7、14、21dABR反应阈与用药前1天比较差异无统计学意义(均为P>0.05)。用药第21天时 ASA+GM 组4、8、16、24、32kHz ABR反应阈均明显低于GM组(均为P<0.05)。
表1 用药前及用药第71421天两组动物各频率ABR反应阈(dB SPL±s

表1 用药前及用药第71421天两组动物各频率ABR反应阈(dB SPL±s
注:*与用药前比较,P<0.05;△与ASA+GM组用药第21天相应频率比较,P<0.05
测试时间 ASA+GM组4kHz 8kHz 16kHz 24kHz 32kHz GM组4kHz 8kHz 16kHz 24kHz 32kHz 95 21.25±2.26 21.25±2.26用药第7天 22.08±2.57 22.71±2.13 23.33±3.89 24.58±3.34 28.33±4.92 27.08±2.57* 32.50±2.61* 39.17±6.69* 41.25±6.44* 48.33±5.77*用药第14天 22.5±2.61 27.08±3.34 23.75±3.11 25.00±4.26 26.25±5.27 32.92±2.57* 38.33±2.46* 44.17±2.89* 45.42±3.34* 56.67±6.51*用药第21天 22.08±2.57 27.5±4.52 22.50±3.37 25.42±5.42 27.08±5.82 35.00±0*△ 41.67±4.44*△45.83±4.17*△47.08±2.57*△ 63.75±3.77用药前1天 20.42±1.44 21.25±2.26 20.83±1.95 20.83±1.95 21.67±2.46 20.83±1.95 21.67±2.46 20.83±1.*△
2.2 两组动物耳蜗基底膜毛细胞缺失率比较 ASA+GM组顶回外毛细胞排列整齐,GM组局部有少量缺失,中回及底回两组均有不同程度毛细胞缺失,但ASA+GM组缺失率明显较GM组低(图1);ASA+GM组和GM组大鼠耳蜗毛细胞缺失率分别为7.20%和21.51%,GM组毛细胞缺失率明显高于ASA+GM组(P<0.05)。
2.3 基底膜免疫荧光染色观察 免疫荧光染色结果显示,GM组可见毛细胞缺失较多,在毛细胞缺失处可见细胞核固缩现象,提示细胞正在凋亡,同时可见在细胞凋亡处AIF聚集且高表达(图2),提示在毛细胞凋亡时AIF核转位的出现以及局部高表达。ASA+GM组可见毛细胞缺失较少,但在毛细胞缺失处仍可见细胞核固缩、细胞凋亡的现象,同时可见细胞凋亡处AIF聚集以及高表达(图3)。可见,GM组耳蜗毛细胞凋亡的数量较ASA+GM明显增多,GM组AIF发生核转位较ASA+GM组多。

图1 用药第21天两组耳蜗基底膜铺片
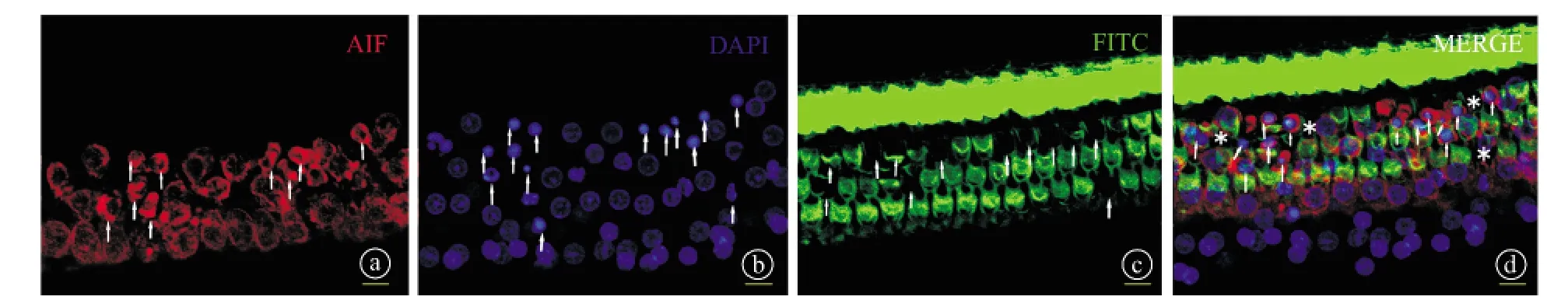
图2 GM组大鼠耳蜗基底膜免疫荧光染色

图3 ASA+GM组大鼠耳蜗基底膜免疫荧光染色
3 讨论
庆大霉素造成耳蜗损伤的病理改变主要是毛细胞的缺失[10],且以耳蜗底回为主,从耳蜗底回逐步向顶回发展。以往氨基糖苷类抗生素耳毒性的分子机理研究认为活性氧自由基参与了耳蜗和前庭的毒性损伤,引起毛细胞的凋亡[11]。庆大霉素在耳蜗毛细胞内聚集部位主要是线粒体,大量的庆大霉素聚集可引起线粒体的破坏,破坏的线粒体导致细胞色素C释放,释放细胞凋亡信号,从而引起经典的caspase凋亡通路激活[9],引起细胞凋亡,导致毛细胞死亡。阿司匹林即乙酰水杨酸,作为临床上常用的非甾体抗炎药,具有镇痛消炎、抗血栓形成的作用。大剂量的阿司匹林可致水杨酸样反应,症状为头痛、眩晕、耳鸣、视力听力减退,剂量过大时可出现精神错乱、惊厥,甚至昏迷等,停药2~3天可完全恢复[12];但小剂量可减轻氨基糖苷类抗生素的耳毒性[13],但其机制尚不完全清楚。
AIF是一种黄素蛋白[14],位于线粒体内膜,它结构复杂,既具有细胞凋亡活性又具有氧化还原酶活性,但两者的作用是解偶联的。AIF在介导细胞凋亡过程中起双重作用,一方面充当细胞凋亡的起始因子,另一方面又是细胞凋亡的直接效应因子[15]。在细胞凋亡时,AIF从线粒体内释放,并发生核转位进入细胞核内,引起核内染色质凝结、聚集,并且导致大分子DNA分子碎裂,它是一种非caspase依赖的凋亡途径。从文中结果看,ASA+GM组大鼠听功能明显好于GM组(P<0.05),且毛细胞缺失明显少于GM组(P<0.05),毛细胞形态好于GM组;GM组毛细胞缺失较多,且有大量细胞核出现固缩,提示细胞核进入凋亡状态,同时在出现核固缩的细胞核处可见AIF聚集,AIF的表达量增多,部分与细胞核重叠,提示核转位的出现;虽然ASA+GM组毛细胞缺失明显少于GM组,但在毛细胞缺失处也出现了细胞核固缩以及AIF的局部聚集及高表达,但无论是毛细胞缺失率还是局部AIF的表达均低于GM组,提示两组大鼠很可能是通过细胞凋亡的方式引起细胞死亡,AIF的出现和核固缩几乎同时出现,提示AIF的核转位导致细胞核固缩,引起细胞凋亡。此现象提示细胞凋亡是通过AIF凋亡途径引起细胞死亡的。
综上所述,阿司匹林能拮抗庆大霉素的耳毒性,在阿司匹林拮抗庆大霉素耳毒性的过程中,AIF的表达量与毛细胞发生凋亡呈正相关,即AIF的表达量高,细胞发生凋亡的数量就多。提示AIF在阿司匹林拮抗庆大霉素耳毒性过程中发挥重要作用,阿司匹林可以通过抑制AIF发生核转位来阻止细胞凋亡,减少毛细胞死亡,从而达到保护听功能的目的。但有关AIF是如何从线粒体内释放的,以及它是如何发生核转位并进入细胞核,具体机制尚不清楚,尚待进一步探讨。
1 Forge A,Schacht J.Aminoglycoside antibiotics[J].Audiol Neurootol,2000,5:3.
2 Schatz A,Bugie E,Waksman SA.Streptomycin,a substance exhibiting antibiotic activity against gram-positive and gram-negative bacteria.1944[J].Clin Orthop Relat Res,2005,437:3.
3 Conlon BJ,Aran JM,Erre JP,et al.Attenuation of aminoglycoside-induced cochlear damage with the metabolic antioxidant alpha-lipoic acid[J].Hear Res,1999,128:40.
4 Rybak LP,Whitworth CA.Ototoxicity:therapeutic opportunities[J].Drug Discov Today,2005,10:1 313.
5 陈阳,黄维国,查定军,等.阿司匹林预防庆大霉素耳毒性的随机对照试验[J].中华耳科学杂志,2008,6:145.
6 Sha SH,Qiu JH,Schacht J.Aspirin to prevent gentamicininduced hearing loss[J].N Engl J Med,2006,354:1 856.
7 Sevrioukova IF.Apoptosis-inducing factor:structure,function,and redox regulation[J].Antioxid Redox Signal,2011,14:2 545.
8 Lecain E,Omri B,Behar-Cohen F,et al.The role of PKCzeta in amikacin-induced apoptosis in the cochlea:prevention by aspirin[J].Apoptosis,2007,12:333.
9 蔡琴芳,蒋立新.豚鼠耳蜗基底膜硝酸银染色铺片法的改良与观察[J].听力学及言语疾病杂志,2010,18:282.
10 Zhang D,Fan Z,Han Y,et al.Apoptosis-inducing factor is involved in gentamicin-induced vestibular hair cell death[J].ORL J Otorhinolaryngol Relat Spec,2012,74:1.
11 Torres-Ruiz NM,Granados O,Meza G.Aminoglycosides:therapeutics,ototoxicity and hypersensitivity of mitochondrial genetic origin[J].Proc West Pharmacol Soc,2011,54:49.
12 陈林,王海涛 ,陆云刚,等.水杨酸钠诱导耳鸣的神经机制[J].中国科学技术大学学报,2008,38:987.
13 王锦玲,陈贤明,刘顺利.水杨酸钠对爆震性聋治疗作用的实验研究[J].听力学及言语疾病杂志,2001,9:1.
14 Xiao T,Zhang Y,Wang Y,et al.Activation of an apoptotic signal transduction pathway involved in the upregulation of calpain and apoptosis-inducing factor in aldosterone-induced primary cultured cardiomyocytes[J].Food Chem Toxicol,2013,53:364.
15 Op DBK,Schacht J,Van Camp G.Apoptosis in acquired and genetic hearing impairment:the programmed death of the hair cell[J].Hear Res,2011,281:18.

