MITF基因突变致Ⅱ型Waardenburg综合征发病的实验研究△
张华 陈红胜 李家大 罗洪金 梅凌云 贺楚峰 冯永
1 新疆医科大学第一附属医院耳鼻咽喉科(乌鲁木齐 830011);2 中南大学湘雅医院耳鼻咽喉科;3 中南大学医学遗传学国家重点实验室
Waardenburg 综合征(Waardenburg syndrome,WS)是最常见的综合征型聋,又称听力-色素综合征,遗传方式主要为单基因致病的常染色体显性遗传伴不全外显。WS占先天性聋的2%~5%,聋哑人群中其发病率为0.9%~2.8%[1]。WS属神经嵴病之一,神经嵴(neural crest,NC)是由起源于背神经管的多潜能细胞群神经嵴细胞(neural crest cells,NCC)组成。NCC通过增殖、迁徙、生存、分化等过程逐渐演变为成黑素细胞后到达真皮和表皮、内耳血管纹和眼睛的脉络膜,并开始发育为黑素细胞[2]。NC发育异常可导致黑素细胞发育不良,黑色素合成减少,从而影响皮肤、头发、眼睛的色素形成及耳蜗的听功能[3]。因此,WS是由于NC发育异常而导致的一组症候群,其主要临床表型特征为感音神经性聋和虹膜异色,临床上依据不同的表型将WS分为4型(WS1~4),以WS1和WS2最为多见[4]。
小眼球畸形相关转录因子(microphthalmiaassociated transcription factor,MITF)在黑素细胞中特异表达,其编码的MITF蛋白是一种含有螺旋-环-螺旋碱性亮氨酸拉链(helix-loop-helix leucine zipper,HLH-Zip)结构的转录因子,是调控黑素细胞发育的关键因子[4~8]。MITF主要通过调控黑素细胞中特异表达基因酪氨酸酶(tyrosinase,TYR)、酪氨酸相关蛋白1(tyrosinase related protein-1,TYRP1)、酪氨酸相关蛋白2(tyrosinase related protein-1,TYRP2)的转录活性来调节黑素细胞发育[9~13]。这三个基因编码的酶参与并调控黑色素合成,是黑色素生成的关键酶。
MITF基因是WS的主要致病基因之一,其突变可导致WS2,大约10%~15%的WS2患者是由MITF基因杂合突变致病[4,14]。MITF基因突变致WS2的发病机制尚不完全清楚,相关研究与报道较少,国外研究其可通过单倍体剂量不足[15,16]、显性负效应[17]、蛋白修饰磷酸化异常[18]导致 WS2,国内尚无相关研究。前期的研究[19]中发现 WS2的两个新发 MITF 基因突变 R217I(c.650G>T)和T192fsX18(c.575delC),它们导致的 WS2表型主要为先天性聋、虹膜异色、全身皮肤棕褐色沉着,与国外报道不尽相同。为进一步研究MITF基因突变如何导致国人WS2表型,本研究在体外实验对R2121和T192fsX18突变如何影响MITF基因的功能进行了研究,以初步探讨其致国人WS2发病的分子机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞 黑色素瘤细胞和小鼠胚胎成纤维细胞(NIH3T3细胞)由中南大学医学遗传学国家重点实验室提供,用于构建瞬时表达细胞模型。
1.1.2 主要试剂 野生型 MITF基因(GenBank accession no,NM_000248.2)真核细胞表达质粒pCMV-MITF-Flag和TYR基因报告质粒pGL3-TYR-Luc由Lubica Ondrusova教授(University Hospital Bulovka,Czach Republic)惠赠;质粒pCMV和pCMV-β-gal(β-半乳糖苷酶,LacZ)购自Clontech公司;NucleoSpin Plasmid kit购自德国Macherey-Nagel公司;Lipfectamine 2000购自美国Invitrogen公司;DMEM、FBS、Pen Strep、Opti-MEM、胰酶购自美国Gibco公司;Protease inhibitor cocktail、单克隆鼠抗Flag抗体、TWEEN-20、辣根过氧化物酶(HRP)偶联的山羊抗鼠IgG、PMSF、ONPG、DAPI、Protein-G-Agargose、Poly(dI-dC).Poly(dI-dC)、DTT、streptavidin-agarose beads、Tween-20、NP-40、EDTA、HEPES购自美国Sigma公司;Cy2标记的山羊抗鼠二抗购自美国Jackson公司;PVDF膜购自 Millipore公司;QuikChange定向突变试剂盒和ECL试剂盒购自英国GE Healthcare公司;单荧光素酶检测试剂盒购自Promega公司;fluoromount-G购自Southern Biotech公司;Triton X-100购自Bio Basic公司;牛血清白蛋白和山羊血清购自北京元亨圣马生物技术研究所。
1.1.3 主要仪器:Leica TCS SP5激光共聚焦显微镜(德国Leica公司)、Leica DMI 3000B荧光倒置式生物显微镜(德国Leica公司)、Sirius单管化学发光检测仪(德国Berthold公司)、CO2细胞培养箱(Thermo公司)、Multiskan Mk3型酶标仪(Thermo公司)、NanoDrop ND-1000分光光度计(Thermo公司)、生物安全柜(青岛海尔生物医疗设备公司)、Tanon-1600全自动数码凝胶图像分析系统(上海天能科技有限公司)、37℃恒温室均由中南大学医学遗传学国家重点实验室提供。
1.2 实验方法
1.2.1 以pCMV-MITF-Flag为模板构建R217I、T192fsX18突变型真核细胞表达质粒 利用在线软件 The QuikChange®Primer Design Program(https://www.genomics.agilent.com)在MITF基因(GenBank accession no NM_000248.2)编码区突变位点两侧分别设计两对突变引物,R217I突变位点引物序列:上游5’-CAA CCT GAT TGA AAC GAA GAA GAA TAT TTA ACA TAA ATG ACC GCA TTA-3’;下游5’-TAA TGC GGT CAT TTA TGT TAA ATA TTC TTC TTC GTT CAA TCA GGT TG-3’。T192fsX18突变位点引物序列:上游5’-CAC AGC GTG TAT TTT TCC CAA GAG TCT GAA GCA AG-3’;下游:5’- CTT GCT TCA GAC TCT TGG GAA AAA TAC ACG CTG TG-3’,由上海生工生物工程有限公司合成。以pCMVMITF-Flag为模板,根据QuikChange定向突变试剂盒说明书通过PCR进行扩增,转化筛选与扩增PCR产物,挑选鉴定克隆。DNA测序(武汉华大基因公司)鉴定R217I、T192fsX18突变质粒构建序列正确,分别命令为pCMV-R217R-Flag和pCMV-T192fsX18-Flag。NucleSpin Plasmid Kit试剂盒抽提质粒,分光光度计测质粒浓度,-20℃保存。
1.2.2 细胞培养、接种和转染 黑色素瘤细胞或NIH3T3细胞用DMEM+10%FBS+1%Pen Strep培养于37℃、5%CO2细胞培养箱中,转染前1天将黑色素瘤细胞用胰酶消化后均匀接种于24孔板或12孔板中,使每孔细胞密度达30%~40%,第二天细胞生长密度达50%~60%时进行脂质体法转染,每转染1μg DNA需3μl Lipfectamine 2000,加入Opti-MEM,6~8h后吸尽加入新鲜DMEM继续培养。
1.2.3 Western blot检测野生/突变 MITF蛋白在黑色素瘤细胞中的表达 野生型MITF及突变型R217I、T192fsX18质粒分别单独转染黑色素瘤细胞48h后,吸尽12孔板中的DMEM,1×PBS清洗后每孔加入2×SDS上样缓冲液(含Protease inhibitor cocktail 0.8μl和0.1MPMSF 0.8μl),冰上裂解10min,将贴壁细胞刮下后分别移至清洁EP管中;超声破碎后,95℃煮沸变性10min,冷却至室温,13 000rpm,离心1min,将上清移至新EP管内,取10~15μl上样在十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)中进行电泳跑胶(分离胶12%,浓缩胶5%);转膜后封闭、洗涤,加入一抗鼠抗anti-Flag单克隆抗体(1:1 000),4℃过夜;洗涤后加入HRP标记的山羊抗鼠二抗(1:10 000),室温1h。ECL试剂盒显色后曝光、显影、成像。
1.2.4 TYR报告基因荧光素酶活性检测 24孔板每孔所需转染质粒剂量设为200ng,分别加入野生或突变 MITF质粒(20、40、80ng),5ng报告质粒pGL3-TYR-Luc、5ng内参质粒pCMV-β-gal(LacZ),每孔所需剩余质粒剂量由空载体pCMV补平,实验每组设3个平行孔,重复3次;仅转染报告质粒和空载体的实验设为空白对照组。转染黑色素瘤细胞后48h,将24孔板中细胞用1×PBS清洗后加入单荧光素酶检测试剂盒中的1×Reporter Lysis Buffer裂解细胞,-80℃冻融30min,将贴壁细胞刮下后分别移至清洁EP管中,13 000rpm,离心10min,①取上清10μl转移至另一EP管后加入20 μl单荧光素酶检测试剂盒中的Luciferase Assay Reagent,经Sirius单管式化学发光检测仪检测10s的光输出值,经FB12Sirius Software软件数据处理后得到荧光素酶数值;②取上清10μl转移至96孔酶标板,加入100μl LacZ缓冲液,37℃孵育30 min。在酶标仪上选择波长A560检测β-半乳糖苷酶活性数值,通过β-半乳糖苷酶活性数值将荧光素酶活性数值归一化后设为1作为基准水平对照。
1.2.5 细胞免疫荧光观察野生/突变 MITF蛋白在NIH3T3细胞中的分布 转染前1d将NIH3T3细胞用胰酶消化后接种于加有灭菌圆形盖玻片的24孔板中,使每孔细胞密度达10%~20%,野生型MITF及突变型R217I、T192fsX18质粒分别单独转染48h后,吸尽24孔板中的DMEM,1×PBS洗1次;每孔加入4%多聚甲醛室温固定30min后吸尽,1×PBS洗涤2次;每孔加入0.2%PBST(250 ml 1×PBS+500μl Triton X-100 1×PBS)室温透化30~60min,吸尽;每孔加入200μl PBSB(牛血清白蛋白+山羊血清+0.2%PBST)封闭60 min,吸尽;每孔加入单克隆鼠抗anti-Flag抗体(1:600)于4℃过夜。0.2%PBST 洗3次后加入Cy3标记的山羊抗鼠二抗(1:300)室温避光孵育60 min,0.2%PBST洗3次后加入DAPI核染色2~s3 min,吸尽后1×PBS洗涤3次;fluoromount G封片后激光共聚焦显微镜断层扫描后照相。
1.2.6 野生/突变 MITF蛋白与 TYR启动子DNA的结合 设计MITF蛋白结合DNA生物素标记引物:MITF DNA binding-F:5’-GAA AAG TCA GTC ATG TGC TTT CAG AGG AT-3’(5’端生物素标记),CATGTG为 MITF特异性结合位点E box基序;MITF DNA binding-R:5’-ATC CTC TGA AAG CAC ATG ACT GAC TTT TC-3’,引物由上海生工生物工程有限公司合成。PCR合成生物素标记DNA双寡核苷酸链体系(20μl):5μl MITF DNA binding-F(0.2M),5 μl MITF DNA binding-R(0.2M),2μl 10×寡核苷酸退火缓冲液(100mM Tris-HCl,10mM EDTA,500mM NaCl),8μl去离子水。反应条件:95℃,5min;关机,待其自然冷却。野生型MITF及突变型R217I、T192fsX18质粒分别单独转染黑色素瘤细胞48h后,吸尽12孔板中的DMEM,1×PBS清洗后每孔加入500μl HKMG细胞裂解缓冲液(10mM HEPES,100mM KCl,5mM MgCl2,1 mM DTT,0.5%NP-40,含0.1MPMSF和protease inhibitor cocktail),冰上裂解10min,转移裂解液至洁净EP管;4℃,13 000rpm,5min,转移上清至新的EP管,每管加入30μl streptavidin-agarose beads,4℃翻转1~3h,4℃,13 000rpm,10~20min,转移上清至新的EP管,每管分别取30μl,加30μl 2×SDS凝胶上样缓冲液(1:1混合),95℃煮沸10min,为Input蛋白样品;剩余每管470μl平分为2管并分别加入HKMG缓冲液,其中一管加入8~10μg生物素标记的DNA双寡核苷酸链和10μg poly(dI-dC).poly(dI-dC),另一管则不加作为阴性对照,4℃翻转20h,每管分别加入30μl streptavidin-agarose beads,4℃,翻转1~3h,冰HKMG缓冲液洗涤3次,4℃,13 000rpm,1min,弃上清;每管分别加30μl 2×SDS凝胶上样缓冲液,95℃煮沸10min,为IP蛋白样品。Input和IP蛋白样品分别凝胶电泳分析,Western blot检测。
1.3 统计学方法 采用SPSS19.0统计软件对各组间数据比较采用不配对t检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 R217I和T192fsX18基因突变对MITF蛋白表达的影响 R217I为位于7号外显子HLH-Zip域的错义突变,由于MITF基因上的650位的碱基G突变为T,导致产生的突变蛋白的217位的精氨酸变成了异亮氨酸,但是仍然含有419个氨基酸(图1a),其分子量大小与野生 MITF蛋白相同,为46 kDa。T192fsX18(c.575delC)是一个移码突变,由于MITF基因上的575位的碱基C缺失,导致其后的核苷酸移位,编码的蛋白在211位氨基酸出现终止密码子,产生含有210个氨基酸、失去了HLHZip和TA功能域截断突变蛋白,其中最后的18个氨基酸是由移位的核苷酸编码产生的(图1a),分子量大小约23kDa野生MITF蛋白和突变R217I、T192fsX18蛋白出现目的条带,大小正确(图1b)。
2.2 R217I和T192fsX18基因突变对MITF蛋白调控TYR启动子转录活性的影响 TYR是MITF的主要靶基因之一,与空白对照组相比,MITF可提高TYR启动子转录活性约55倍;R217I保留部分活性,可使酪氨酸酶启动子转录活性增加约21倍,但明显较 MITF低(P<0.01);T192fsX18完全失去对酪氨酸酶启动子转录活性的调控作用(图2a)。R217I与MITF共转染时,随着R217I剂量的增加,酪氨酸酶启动子转录活性增加,与MITF单独上调酪氨酸酶启动子转录活性相比有显著性差异(P<0.01)(图2b),而随着T192fsX18剂量增加,酪氨酸酶启动子转录活性与MITF单独作用时相比无明显差异(P>0.05)(图2c)。
2.3 R217I和T192fsX18基因突变对MITF蛋白的亚细胞定位影响 R217I突变蛋白和野生MITF蛋白一样只在细胞核中分布,而T192fsX18突变蛋白则出现异常亚细胞定位:仅在细胞质中分布(图3)。
2.4 R217I和T192fsX18基因突变对MITF蛋白与酪氨酸酶启动子DNA结合的影响 R217I突变蛋白与野生MITF蛋白一样均可与特异DNA结合,而T192fsX18突变蛋白则不能与之结合(图4)。

图1 Western blot检测野生/突变MITF蛋白黑色素瘤细胞中的表达
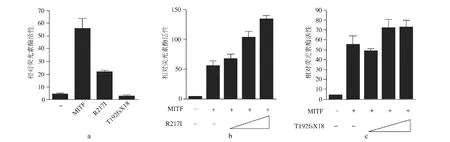
图2 野生/突变MITF蛋白对酪氨酸酶启动子转录活性的影响
3 讨论
MITF基因包含9个外显子,其编码的MITF蛋白包含419个氨基酸,分子量大小约46kDa,属于HLH-Zip蛋白的Myc超级基因家族[4,14]。HLH-Zip结构域是MITF蛋白重要功能域,这一结构域的氨基酸序列具有高度的保守性并具有结合DNA的能力,其结构的完整性对MITF蛋白功能的发挥至关重要。MITF蛋白通过HLH-Zip结构域形成同源或异源的二聚体后与靶基因启动子E box基序(CATGTG)结合进而调控其转录[20],另外,在其羧基端有一个富含丝氨酸的转录激活域(transcriptional activation domain,TA)。MITF参与调控机体多种NCC源性细胞生长发育过程,尤其是在黑素细胞的生存、迁徙、增殖和分化的发育过程中有重要作用[4,6,21,22],参与黑素细胞形态构成、黑色素合成、转运和运输。
由于MITF在黑素细胞中特异表达,本研究选择黑素细胞系之黑色素瘤细胞进行体外实验蛋白表达和靶基因启动子荧光素酶活性研究,以使结果能较好的模拟和反映MITF突变如何在体内影响其蛋白功能。本研究利用成功构建的野生/突变MITF真核细胞表达质粒通过瞬时转染黑色素瘤细胞进行相关体外实验研究,Western blot检测R217I和T192fsX18突变蛋白在黑色素瘤细胞均正确表达,说明二者导致WS2表型并非由于蛋白表达异常所致,同时进一步验证了构建的突变表达质粒的正确性。
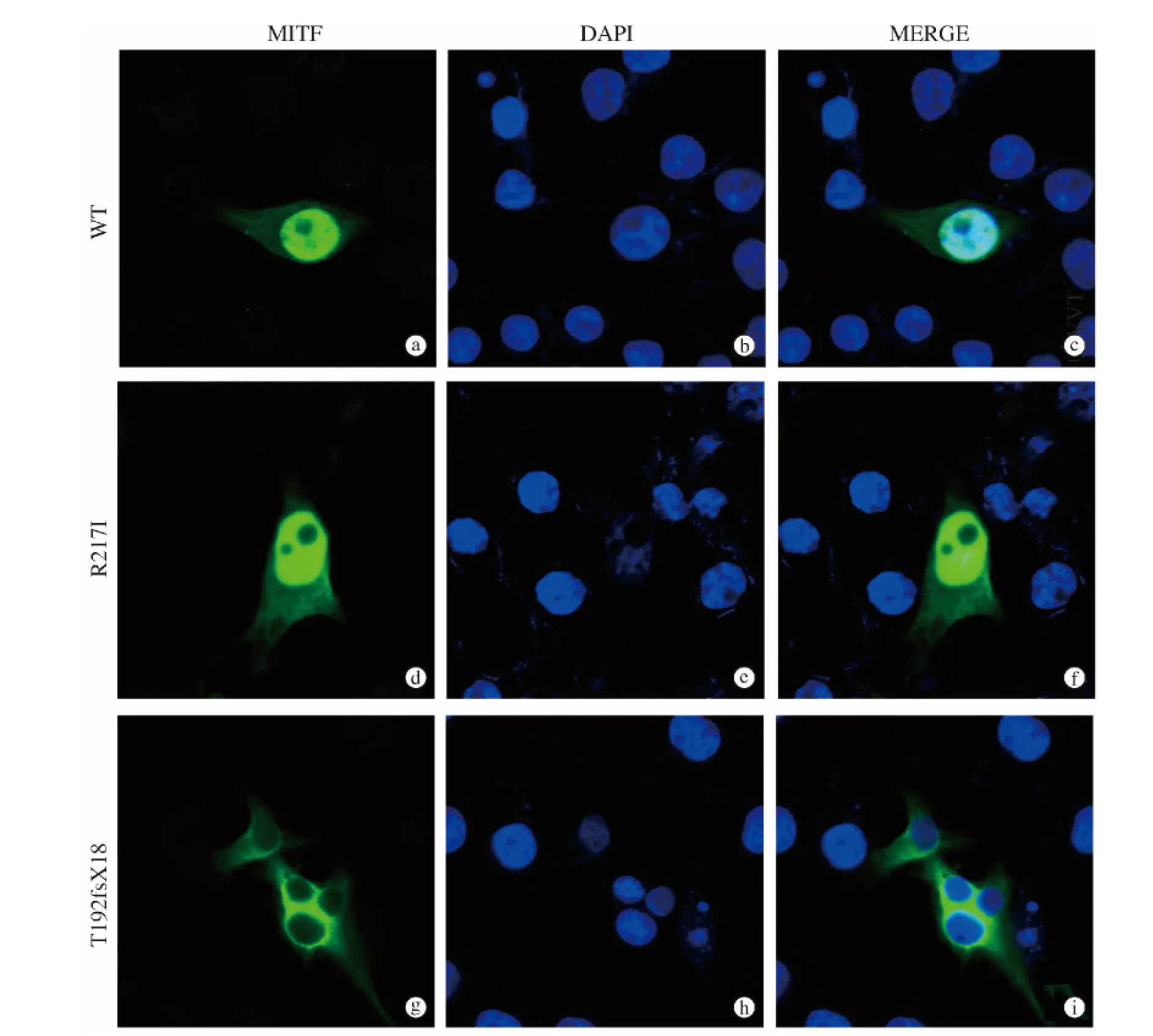
图3 野生/突变蛋白MITF蛋白在NIH3T3细胞中定位(×1 200)

图4 Western blot检测野生/突变MITF蛋白与特异DNA的结合
MITF对黑素细胞发育的调节作用主要是通过与TYR、TYRP1和TYRP2启动子E box结合进而调控它们的转录活性来完成的[9~13],这是 MITF行使其正常生理功能的必要条件。本研究所用报告基因质粒pGL3-TYR-Luc含TYR基因的启动子区序列(-300~+80),其中含有E box基序,在MITF及其突变单独转染UACC903细胞时,与空白对照组相比,MITF可以提高TYR转录活性约55倍,与文献报道一致[13,15,23]。尽管 R217I可以提高TYR转录水平约22倍,但明显低于MITF调控水平,提示突变R217I蛋白尽管有残余功能,但其剂量远不足以达到行使正常生理功能所需要量,使TYR的表达较正常下调,导致黑色素合成量不能满足机体正常所需,R217I的这种残余活性无生理意义。R217I的突变位点位于HLH-Zip,导致217位的极性碱性氨基酸精氨酸变成了非极性氨基酸异亮氨酸,HLH-Zip域氨基酸序列在脊椎动物高度保守,217位氨基酸极性的改变会造成MITF蛋白结构的变化,必然会对MITF功能产生影响。HLH-Zip对于MITF蛋白与启动子上的DNA的大沟结合有重要作用,217位氨基酸的改变可能会对这种结合产生影响。另一方面,R217I突变蛋白保留有HLH-Zip域,可以与其自身或野生MITF形成异常的二聚体,导致正常二聚体的量减少,结果突变蛋白R217I仍有一定功能,这与Schwarzbraun的研究[16]相符,他认为MITF突变产生的突变蛋白仅导致正常的二聚体量的减少,仍具有一定功能,因此产生单倍体剂量不足效应而导致 WS2。此外,R217I的残余功能也可能与其保留有转录激活域(TA)有关,而T192fsX18突变蛋白失去调控TYR转录活性的作用而表现为无功能蛋白,是由于其失去了HLH-Zip域和TA域,与文献报道一致[15,24]。T192fsX18功能的丧失导致TYR表达下降,进一步影响黑色素合成;有研究[17,18]表明该突变可通过显性负效应抑制野生MITF蛋白活性进而导致黑素细胞功能不良。文中结果发现随着突变蛋白剂量的增加,野生MITF对TYR转录活性的调控作用并无减弱,说明R217I和T192fsX18突变蛋白不抑制野生 MITF蛋白功能,即无显性负效应;同时R217I与MITF产生叠加效应,与R217I具有残余活性有关。
转录因子 MITF属于核蛋白,其核定位信号(nuclear localization signal,NLS)位于 HLH-Zip域[18],可以被相应的核转运蛋白识别后通过细胞核膜上的核孔复合体进入到细胞核,因此,正常的亚细胞定位是MITF行使其正常的生理功能的前提条件和充分条件,异常的细胞分布必然导致其功能的异常。本研究发现在NIH3T3细胞中表达的R217I突变蛋白和MITF蛋白可以正常的由细胞质被转运至细胞核,而T192fsX18突变蛋白则无法进入细胞核;R217I突变位点位于NLS内,但R217I的亚细胞定位与野生MITF相同,说明突变R217I并未对其蛋白的亚细胞定位产生影响,这与文献[18,25]报道一致,提示MITF的NLS区域中的错义突变可能不影响其被转运蛋白识别进入核内,这也从另一个角度验证了R217I的部分功能,正确的亚细胞定位是R217I残有部分功能的必要条件。T192fsX18缺失HLH-Zip意味着其NLS的缺失,失去NLS即不能被转运蛋白识别,本研究结果显示其出现异常亚细胞定位,仅在细胞质分布,说明其失去调控TYR转录作用与其不能进入细胞核有关。本研究结果在一定程度上解释和支持了荧光素酶活性检测中R217I和T1921fsX18突变对MITF蛋白调控TYR转录作用的影响。
本研究将生物素标记含有CATGTG寡核苷酸链探针与野生或突变MITF蛋白杂交,发现MITF和R217I可与DNA结合,而T192fsX18不能与DNA结合。这一结果对本研究荧光素酶活性检测实验结果予以进一步的验证与支持,T192fsX18失去了HLH-Zip域导致其失去结合DNA的能力,即失去激活TYR启动子转录的能力;而R217I由于可以和DNA结合,仍保留有一定的激活TYR转录的活性,与文献[18,25]报道一致,HLH-Zip域的单个氨基酸改变对其与DNA的结合影响较小,但由于R217I上调TYR转录的水平远低于野生MITF,推测可能在结合DNA的强度和剂量上要远低于野生MITF。
综上所述,本研究通过两个MITF新发基因突变体外实验对国人WS2发病的分子机制进行了初步的研究。等位基因杂合突变R217I和T192fsX18产生的突变蛋白剂量不足以达到野生蛋白行使正常生理功能的最低阈值,突变导致蛋白失去部分或全部功能,引起TYR转录活性下降、表达下调甚至不表达,结果黑色素合成减少,最终导致皮肤、毛发、虹膜和内耳血管纹黑色素分布减少,最终以单倍体剂量不足效应产生WS2表型。R217I和T192fsX18突变对TYRP1和TYRP2转录活性调控作用的影响尚需进一步研究。
1 Nayak CS,Isaacson G.Worldwide distribution of Waardenburg syndrome[J].Ann Otol Rhinol Laryngol,2003,112:817.
2 Sauka-Spengler T,Bronner-Fraser M.Development and evolution of the migratory neural crest:agene regulatory perspective[J].Curr Opin Genet Dev,2006,16:360.
3 Thomas AJ,Erickson CA.FOXD3regulates the lineage switch between neural crest-derived glial cells and pigment cells by repressing MITF through a non-canonical mechanism[J].Development,2009,136:1 849.
4 Pingault V,Ente D,Dastot-Le Moal F,et al.Review and update of mutations causing Waardenburg syndrome[J].Hum Mutat,2010,31:391.
5 Mosammaparast N,Pemberton L.Karyopherins:from nuclear-transport mediators to nuclear-function regulators[J].Trends Cell Biol,2004,14:547.
6 Hou L,Pavan WJ.Transcriptional and signaling regulation in neural crest stem cell-derived melanocyte development:do all roads lead to Mitf?[J].Cell Res,2008,18:1 163.
7 Bejar J,Hong Y,Schartl M.Mitf expression is sufficient to direct differentiation of medaka blastula derived stem cells to melanocytes[J].Development,2003,130:6 545.
8 McGill GG,Horstmann M,Widlund HR,et al.Bcl2regulation by the melanocyte master regulator Mitf modulates lineage survival and melanoma cell viability[J].Cell,2002,109:707.
9 Lowings P,Yavuzer U,Goding CR.Positive and negative elements regulate a melanocyte-specific promoter[J].Mol Cell Biol,1992,12:3 653.
10 Bentley NJ,Eisen T,Goding CR.Melanocyte-specific expression of the human tyrosinase promoter:activation by the microphthalmia gene product and role of the initiator[J].Mol Cell Biol,1994,14:7 996.
11 Bertolotto C,Busca R,Abbe P,et al.Different cis-acting elements are involved in the regulation of TRP1and TRP2 promoter activities by cyclic AMP:pivotal role of M boxes(GTCATGTGCT)and of microphthalmia[J].Mol Cell Biol,1998,18:694.
12 Yavuzer U,Keenan E,Lowings P,et al.The Microphthalmia gene product interacts with the retinoblastoma protein in vitro and is a target for deregulation of melanocyte-specific transcriptionJ.Oncogene199510123.
13 Yasumoto K,Yokoyama K,Shibata K,et al.Microphthalmia-associated transcription factor as a regulator for melanocyte-specific transcription of the human tyrosinase gene[J].Mol Cell Biol,1994,14:8 058.
14 Tassabehji M,Newton VE,Read AP.Waardenburg syndrome type 2caused by mutations in the human microphthalmia(MITF)gene[J].Nat Genet,1994,8:251.
15 Nobukuni Y,Watanabe A,Takeda K,et al.Analyses of loss-of-function mutations of the MITF gene suggest that haploinsufficiency is a cause of Waardenburg syndrome type 2A[J].Am J Hum Genet,1996,59:76.
16 Schwarzbraun T,Ofner L,Gillessen-Kaesbach G,et al.A new 3p interstitial deletion including the entire MITF gene causes a variation of Tietz/Waardenburg type IIA syndromes[J].Am J Med Genet A,2007,143:619.
17 Takebayashi K,Chida K,Tsukamoto I,et al.The recessive phenotype displayed by a dominant negative microphthalmia-associated transcription factor mutant is a result of impaired nucleation potential[J].Mol Cell Biol,1996,16:1 203.
18 Takeda K,Takemoto C,Kobayashi I,et al.Ser298of MITF,a mutation site in Waardenburg syndrome type 2,is a phosphorylation site with functional significance[J].Hum Mol Genet,2000,9:125.
19 Chen H,Jiang L,Xie Z,et al.Novel mutations of PAX3,MITF,and SOX10genes in Chinese patients with type I or type II Waardenburg syndromeJ.Biochem Biophys Res Commun,2010,397:70.
20 Meadows NA,Sharma SM,Faulkner GJ,et al.The expression of Clcn7and Ostm1in osteoclasts is coregulated by microphthalmia transcription factor[J].J Biol Chem,2007,282:1 891.
21 Arnheiter H.The discovery of the microphthalmia locus and its gene,Mitf[J].Pigment Cell Melanoma Res,2010,23:729.
22 Cheli Y,Ohanna M,Ballotti R,et al.Fifteen-year quest for microphthalmia-associated transcription factor target genes[J].Pigment Cell Melanoma Res,2010,23:27.
23 Vachtenheim J,Novotna H,Ghanem G.Transcriptional repression of the microphthalmia gene in melanoma cells correlates with the unresponsiveness of target genes to ectopic microphthalmia-associated transcription factor[J].J Invest Dermatol,2001,117:1 505.
24 Tachibana M.Evidence to suggest that expression of MITF induces melanocyte differentiation and haploinsufficiency of MITF causes Waardenburg syndrome type 2A[J].Pigment Cell Res,1997,10:25.
25 Kim DK,Morii E,Ogihara H,et al.Different effect of various mutant MITF encoded by mi,Mior,or Miwh allele on phenotype of murine mast cells[J].Blood,1999,93:4 179.

