姜黄素对人结肠癌细胞HT-29中β-catenin、血管内皮生长因子的影响
贾 佳 赵 逵 张银萍 陈 涛 卢光新 (湖北医药学院附属人民医院,湖北 十堰 563003)
姜黄素是从中药姜黄中提取的酚性色素,具有抗肿瘤、降血脂、抗炎、利胆、抗氧化等作用,且长期应用无明显毒副反应〔1〕。多年临床研究表明,姜黄素在抗肿瘤方面具有很好的发展前景〔2〕。美国国立肿瘤研究所已将其列为第3代肿瘤化学预防药物〔3〕。大肠癌是我国最常见的恶性肿瘤之一,发病率及病死率呈上升趋势,目前居恶性肿瘤死亡率第3位〔4〕。研究证明,在肿瘤的侵袭、转移过程中,相关基因β-catenin和血管内皮生长因子(VEGF)发挥了极其重要的作用〔5〕。本实验观察姜黄素对人结肠癌HT-29细胞增殖的影响及β-catenin、VEGF蛋白表达的变化。
1 材料和方法
1.1 药物和试剂 姜黄素、MTT(Sigma公司);胎牛血清、改良型1640培养基、胰蛋白酶(Hyclone公司);二甲基亚砜(DMSO)(贵阳恒因生物);VEGF引物、β-catenin引物、β-actin引物、β-catenin多克隆抗体(兔来源)(上海生工生物工程上海服务有限公司);BCA法蛋白定量试剂盒、辣根酶标记鼠抗兔IgG(H+L)(北京博奥森生物技术有限公司);β-actin多克隆抗体(小鼠来源)、辣根酶标记山羊抗小鼠IgG(H+L)(北京中杉金桥公司)。
1.2 方法
1.2.1 细胞培养 人结肠癌细胞株HT-29购自中科院上海细胞所,细胞培养:结肠癌细胞HT-29,接种于含10%胎牛血清改良型1640培养基中培养,置于37℃、5%CO2、100%温度的培养箱中培养,隔天换液,待细胞长至对数生长期时,用0.25%胰蛋白酶消化传代。
1.2.2 MTT法检测姜黄素对HT-29细胞增殖的抑制 取对数生长期的HT-29细胞,实验组分为量效组和实效组,设空白组、阴性对照组、实验组,调整细胞浓度为2.0×106个/ml,接种于96 孔板中,药物处理组分别加入 5、10、20、40、60、80、100、120 μmol/L,设5个复孔,对照组加入培养基,培养48 h,每孔加入20 μl 0.5%的 MTT溶液,继续培养4 h,每孔加入150 μl DMSO,低速振荡10 min,酶标仪读取A490值,细胞生长抑制率(%)=(1-用药组A值/对照组A值)×100%,计算出IC50。时效组种板同量效组,加药时以IC50为参照,96孔板加入不同浓度的姜黄素 18、21、24 μmol/L,分别测药物干预 12、24、36、48、60 h的MTT,得到相应的吸光值。所有试验重复3次。
1.2.3 Western印迹法检测HT-29细胞中β-catenin、VEGF蛋白的表达 用21 μmol/L姜黄素处理HT-29细胞,培养6、12、24和48 h,并设阴性对照,提取总蛋白后,再用BCA定量试剂盒进行总蛋白定量,然后上样、电泳、转膜、封闭,加一抗杂交(β-catenin、VEGF、β-actin)及相应二抗,暗盒中曝光后进行显影和定影,以β-actin校正作相对量分析。
1.3 统计学方法 采用SPSS13.0软件进行单因素方差分析。
2 结果
2.1 姜黄素对人结肠癌细胞HT-29的抑制率 MTT实验显示不同药物浓度、不同作用时间对人结肠癌细胞HT-29有抑制作用。实验组与对照组比较A值差异均有统计学意义(P<0.05)。同阴性对照组对比,随着浓度的增加,OD值随之降低,存在量效关系(图1)。由A490处测得的吸光值,并测得姜黄素对HT-29细胞的IC50(半数抑制浓度)为19.27 μmol/L。3种不同剂量的姜黄素作用于HT-29细胞,随着时间的延长,浓度越大的,抑制率越高,存在时效关系(图2)。
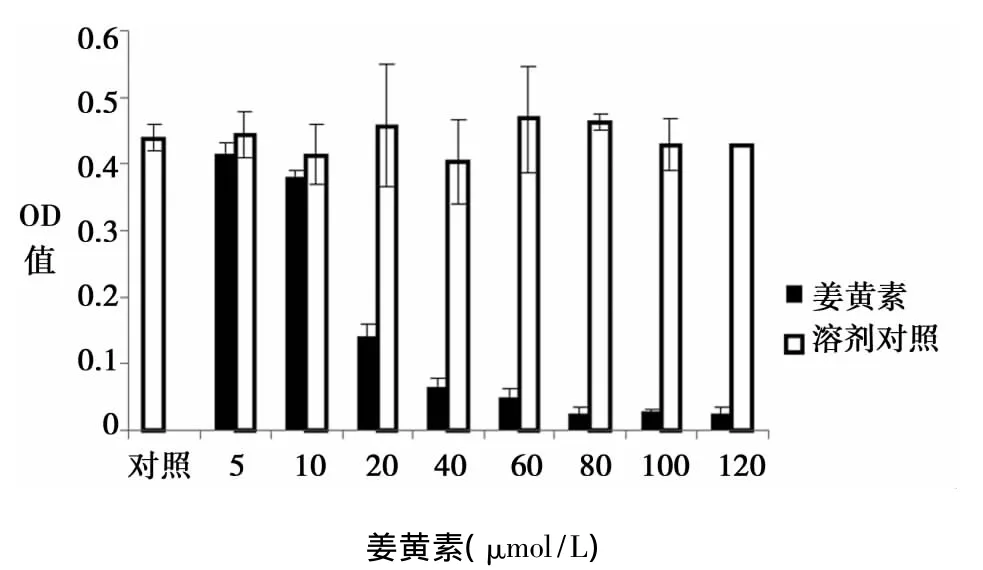
图1 不同浓度姜黄素对HT-29细胞48 h生长增殖的影响(n=4)
2.2 姜黄素对HT-29细胞中VEGF、β-catenin蛋白表达的影响 姜黄素浓度21 μmol/L干预 HT-29细胞6 h、12 h、24 h和48 h时VEGF、β-catenin蛋白均较对照组表达逐渐降低(图3),其余组与阴性对照组相比差异有统计学意义(P<0.05),见表1。

图2 姜黄素作用不同时间对HT-29细胞的抑制率(n=4)
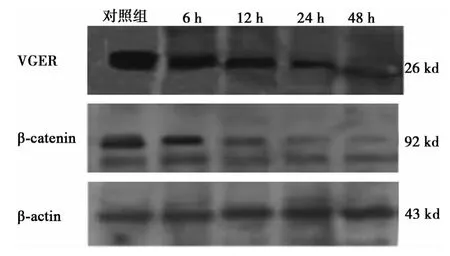
图3 姜黄素作用HT-29细胞后VEGF、β-catenin蛋白的表达
表1 姜黄素作用于HT-29细胞后VEGF、β-catenin蛋白的表达(n=4,s)
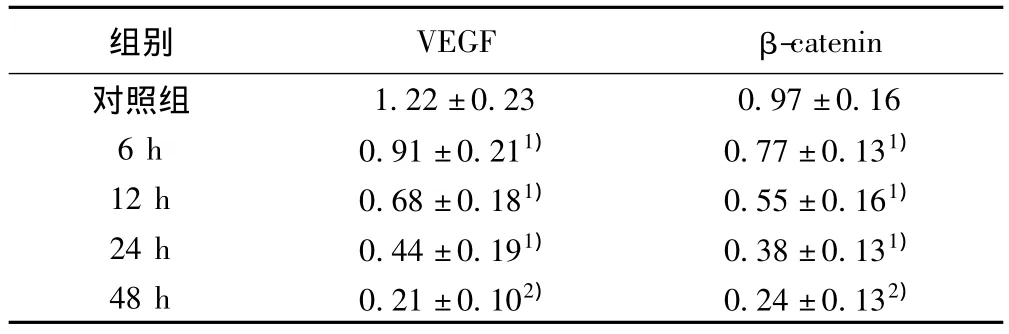
表1 姜黄素作用于HT-29细胞后VEGF、β-catenin蛋白的表达(n=4,s)
与对照组比较:1)P<0.05,2)P<0.01
-catenin对照组组别 VEGF β 1.22±0.23 0.97±0.16 6 h 0.91±0.211) 0.77±0.131)12 h 0.68±0.181) 0.55±0.161)24 h 0.44±0.191) 0.38±0.131)48 h 0.21±0.102) 0.24±0.132)
3 讨论
在1815年在姜黄根茎中首次分离得到姜黄素〔6〕,半个世纪后,姜黄素的晶体被首次制得。二十世纪八十年代,Kuttan等〔7〕报道姜黄素可能具有潜在抗肿瘤活性,但多年都不被关注,1995年之后,大量的实验才显示其抗肿瘤的活性〔8~10〕。近年来,不断地体外实验证明,姜黄素能够抑制多种肿瘤细胞株生长、增值并诱导其凋亡。陈建等〔11〕应用MTT和Western印迹实验方法发现姜黄素能够抑制结肠癌SW480细胞,其机制可能是抑制Akt的磷酸化并下调survivin蛋白。罗强等〔12〕应用人结肠癌SW620细胞,采用CCK8和流式细胞仪检测法发现,姜黄素可诱导结肠癌细胞凋亡。本实验用MTT法又一次证实,姜黄素能够抑制体外结肠癌HT-29细胞的增殖,并呈剂量和时间依赖性,存在时效与量效关系。
β-catein是新原癌基因的产物,分布于细胞膜和胞质,一方面维系着细胞的紧密连接,同时从细胞膜进入胞质后,作为信息传递介质可激活结肠癌癌变中起重要作用的Wnt通路,因此在结肠癌中处于高表达〔13〕,而正常的结肠上皮细胞质中没有游离的β-catenin。VEGF是迄今所发现的最重要的促血管生成因子,通过促进新生血管的生成参与肿瘤的发生、发展〔14〕。VEGF也可通过自分泌和旁分泌的直接间接两种方式,影响肿瘤浸润和转移〔15,16〕。VEGF随着肿瘤增殖、侵袭加深和出现转移而表达明显增高,大量的体外实验研究还显示VEGF可诱导血管内皮细胞产生的间质胶原酶既满足血管新生对基质降解的要求,也有助于肿瘤细胞从组织的脱落,侵入血管,浸润周围脏器或发生远处转移,这间接证明了VEGF参与了肿瘤的增殖、侵袭和转移等发展过程〔17,18〕。Wnt/β-catenin 通路和 VEGF是抗癌药物作用的新靶点,而姜黄素是通过阻断通路中的相关因子而起到治疗大肠癌的作用。
本实验结果说明姜黄素可能是通过抑制β-catenin从而影响Wnt通路,进而抑制HT-29细胞的增殖。VEGF蛋白表达的下降说明姜黄素有可能抑制了VEGF促进肿瘤新生血管的作用,这与Shankar等〔19〕研究说明姜黄素能抑制肿瘤的生长转移和血管发生相符。
综上,结肠癌的发生、发展、增殖及侵袭与 VEGF及 βcatenin有密切的关系,姜黄素抑制VEGF和β-catenin蛋白的表达,可能是其抑制结肠癌增殖的机制之一,而两种蛋白表达的影响之间的相互关系不明确,两者对结肠癌发生机制是独立还是协同作用有待进一步研究。
1 Lin JK,Lin-Shiau SY.Mechanisms of cancer chemoprevention by curcumin〔J〕.Proc Nat Sci Counc Repub China B,2001;25(2):59-66.
2 胡 静,李 立.姜黄素药理作用研究现状〔J〕.检验医学与临床,2007;4(12):1186-7.
3 Odot J,Albert P,Carlier A,et al.In vitro and in vivo anti-tumor effect of curcumin against melanoma cells〔J〕.Int J Cancer,2004;111(3):381-7.
4 Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002〔J〕.CA Cancer J Clin,2005;55(2):74-108.
5 Sakoguchi-Okada N,Takahashi-Yanaga F,Fukada K,et al.Celecoxib inhibits the expression of surviving via the suppression of promoter activity in human colon cancer cells〔J〕.Biochem Pharmacol,2007;73(9):1318-29.
6 Aggarwal BB,Sung B.Pharmacological basis for the role of curcumin in chronic diseases:an age-old spice with modern targets〔J〕.Trends Pharmacol Sci,2009;30(2):85-94.
7 Kuttan R,Bhanumathy P,Nirmala K,et al.Potential anticancer activity of turmeric(Curcuma longa)〔J〕.Cancer Lett,1985;29(2):197-202.
8 黄赞松.姜黄素对消化系肿瘤作用的研究进展〔J〕.时珍国医国药,2009;20(2):383-5.
9 周 进,方 丽,姚文秀,等.槲皮素、姜黄素对人肝癌HepG2细胞增殖和凋亡作用的比较〔J〕.中国肿瘤生物治疗杂志,2011;18(3):324-6.
10 霍红梅,张利元,江家贵,等.姜黄素抑制乳腺癌MCF-7细胞增殖及其相关的氧化应激机制〔J〕.中国肿瘤生物治疗杂志,2009;16(5):490-3.
11 陈 建,林秀秀.姜黄素抑制结肠癌SW480细胞的增殖及其机制〔J〕.中国肿瘤生物治疗杂志,2012;19(3):280-3.
12 罗 强,刘开阳,孙 黎.姜黄素对入结肠癌SW620细胞凋亡机制的影响〔J〕.中国老年学杂志,2011;31(8):3108-9.
13 Li J,Mizukami Y,Zhang X,et al.Oncogenic K-ras stimulates Wnt signaling in colon cancer through inhibition of GSK-3beta〔J〕.Gastroenterology,2005;128(4):1907-18.
14 Thun MJ,Calle EE,Namboodiri MM,et al.Risk factors for fatal colon cancer in a large prospective study〔J〕.Natl Cancer Inst,1992;84(19):1491-500.
15 赵 达,侯小明,冯 颖,等.大肠癌中C-Met VEGF及其受体KDR的表达与预后的相关性〔J〕.中国肿瘤临床,2010;37(16):941-4.
16 冀俊琴,周建华.DLL4和VEGF蛋白在大肠癌中的表达及其临床意义〔J〕.现代肿瘤医学,2011;19(6):1160-3.
17 李卫东,姚庆娟.结直肠癌VEGF和MMP-9基因的表达〔J〕.中国肿瘤临床,2008;35(13):756-60.
18 Russolino FD,Di Renzo MF,Ziche M,et al.Hepatocyte growth factor is a potent angiogenic factor which stimulates endothelial cell motility and growth〔J〕.J Cell Biol,1992;199(3):629-41.
19 Shankar S,Ganapathy S,Chen Q,et al.Curcumin sensitizes TRAIL-resistant xenografts:molecular mechanisms of apoptosis,metastasis and angiogenesis〔J〕.Mol Cancer,2008;7(16):1-13.

