大鼠骨髓间充质干细胞体外培养与pEGFP/Ang-1转染方法的建立
李福智 侯 阳 李晓明 房 艳 臧东钰 (辽宁医学院附属第三医院胸外科,辽宁 锦州 000)
骨髓间充质干细胞(BMSCs)具有两个特性,一是所有干细胞具有自我更新的能力,即干细胞可以通过对称分裂,形成两个相同的干细胞以维持自身细胞群的数目;二是干细胞都具有分化能力,干细胞可以通过非对称的分裂方式分裂,产生子代细胞并保持亲代的特性。BMSCs移植为临床各系统疾病损伤修复治疗和细胞替代治疗提供一种新的手段〔1,2〕。选用BMSCs,不仅可以用于缺失细胞的修补治疗,也是有效的基因片段载体。Lou 等〔3〕及 Yoo等〔4〕的研究表明,BMSCs基因转染率较高,经转染后到达不同区域可分化为相应的组织,因而可以作为一个有效的载体进行基因治疗。
1 材料与方法
1.1 实验材料和主要试剂 4~6周龄的雄性SD大鼠4~6只,体重(110±10)g,由辽宁医学院动物实验中心提供。真核表达载体pEGFP-N1为辽宁医学院解剖教研室提供。FUGENE HD转染试剂为Ebiotrade公司生产(批号1118843)、L-DMEM培养基购置 HyClone公司(批号 NWF0426)、乙二胺四乙酸(EDTA)购置 Sigma公司(批号E6758)、胎牛血清(FBS)购置Thermo Fisher北京公司(批号NVA0227)、兔抗大鼠单克隆抗体CD 44、CD 45购置美国 BD公司(批号分别是55751,55752)。
1.2 BMSCs的培养及鉴定 采用贴壁筛选法〔5〕和密度梯度离心法〔6〕联合操作获取BMSCs:取4周龄SD大鼠2只,拉颈处死后,酒精浸泡消毒,剪除骨的两端,用注射器吸取DMEM/F12培养基并含15%FBS 5 ml冲洗每根股骨。进行细胞计数,按1×107细胞/cm2接种于25 cm2培养瓶,置于培养箱中培养。基于细胞增殖和细胞密度融合时用含0.25% 胰蛋白酶0.02%EDTA的液消化后按1∶3的比例每3天进行分瓶。免疫组化检测滴加一抗为兔抗大鼠单克隆抗体 CD44、CD45,实验结果获得纯度较高BMSCs。CD44表达阳性,而CD 45表达阴性,证实培养的细胞为BMSCs。
1.3 FuGENE HD转染试剂将重组表达质粒稳定转染到BMCSs细胞内 将P2~P3代细胞置于6孔板;将 HD转染试剂-质粒DNA混合物中,调节浓度为500 μg/ml的G418培养液进行筛选:选择出在10~14 d内使细胞全部死亡的最低G 418浓度进行下一步的筛选试验(本次筛选浓度为500 μg/ml)。同时用未加转染液的细胞做对照。当对照细胞大部分死亡时(3~5 d后),再换一次筛选液,G418浓度可降至150~250 μg/ml维持筛选作用。10~20 d后,可见有抗性克隆形成,待其逐渐增大后,将其逐一移至24孔板继续培养。
1.4 蛋白印记检测Ang-1在BMSCs中的表达 收集稳定转染后的BMSCs和未转染的BMSCs(密度为2×106个/ml)离心,磷酸盐缓冲液(PBS)冲洗。加入细胞裂解液60~100 μl,短暂振荡,冰上作用30 min,12 000 r/min离心5 min。聚遍氯乙烯(PVDF)膜在含有50 g/L脱脂奶粉的Tris盐酸缓冲液(TTBS)中37℃封闭90 min,依次加入一抗(抗鼠Ang-1抗体,抗体稀释浓度为1∶1 000),4℃孵育过夜,二抗(辣根过氧化酶标记的羊抗人IgG,抗体稀释浓度为1∶1 000)显色,观察结果。进行凝胶图像分析。
2 结果
2.1 BMSCs的形态学及免疫组织化学鉴定 在倒置显微镜下观察接种时漂浮的单个核细胞呈圆形,在显微镜下观察具有很强的折光性。在4~5 d贴壁的BMSCs呈短梭形或不规则形,传至3代以后细胞逐渐变为长梭形,杂质细胞较少,细胞排列呈明显的旋涡状在瓶底清晰可见。免疫组织化学结果显示几乎所有BMSCs细胞CD 44表达阳性,而CD 45表达阴性,证实培养的细胞为BMSCs。见图1,图2。
2.2 Western印迹检测BMSCs内重组蛋白的表达 转染Ang-1的BMSCs有相应的Ang-1蛋白表达;未转染的BMSCs未见Ang-1蛋白表达。见图3。
2.3 转染后BMSCs细胞的形态学结果 成功将pEGFP/Ang-1质粒转入BMCSs,在荧光显微镜下观察;1 d绿色荧光不明显,3 d荧光最为明显。见图4。
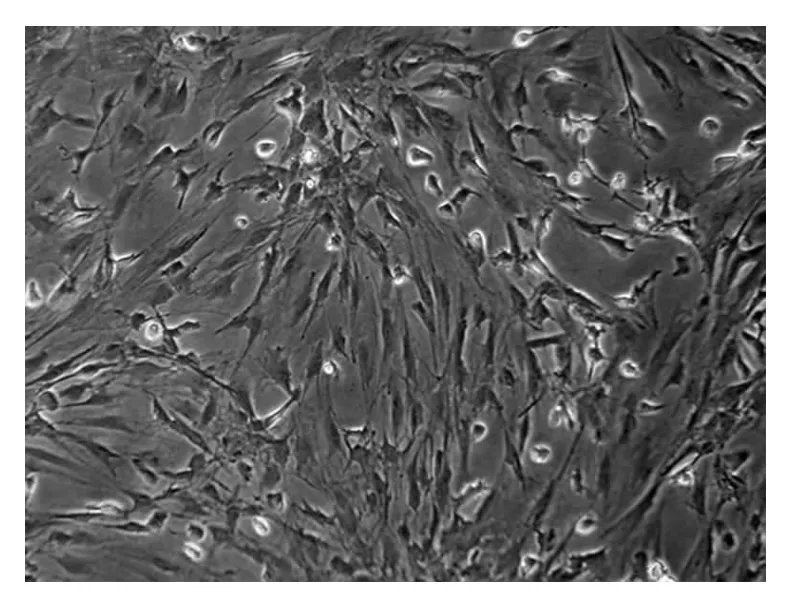
图1 光镜下观察传至第3代的BMSCs(×200)
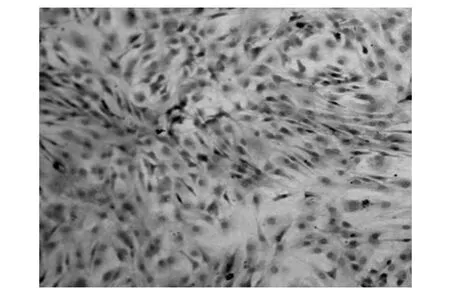
图2 免疫组化染色检测CD44(×200)
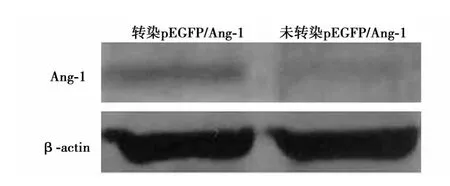
图3 Western印迹鉴定重组融合蛋白的表达
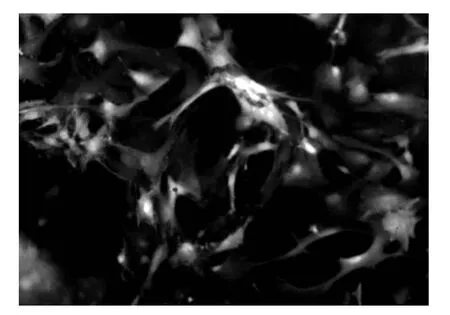
图4 转染pEGFP/Ang-1质粒后荧光显微镜下形态(×100)
3 讨论
BMSCs具有干细胞的共性,即具有自我复制和多向分化能力,在不同条件下可以分化所有中胚层来源的组织,如成骨细胞、软骨细胞、脂肪细胞、神经胶质细胞、血管内皮细胞等〔7~10〕。根据细胞的大小和密度常可分离具有不同生物学特征的各种细胞亚群。根据本实验条件摸索几种简便的方法,获得纯化效果较好。贴壁法:最常用的分离培养方法,除非有些特殊的细胞要求是悬浮培养,大部分细胞都适用于贴壁法。密度梯度离心法:常用Ficoll直接作为分离介质来分离细胞,但是高浓度Ficoll黏度较大,分离效果还很不理想,加入Hypaque可使分离液黏度降低,以提高分离效率。免疫选择法:Phinney〔11〕采用一种免疫消耗技术,精确地将目的细胞造血细胞系和内皮细胞系从基质细胞中成功的分离出来。流式细胞仪分选法:此技术较为复杂,仪器昂贵,需专业技术人员进行操作,操作费时。本文在反复取材和多次培养BMCSs采用贴壁法和密度梯度离心法两种方法相结合,细胞在传至第一代时纯度较高,传第三代时纯度可以达到95%。在镜下观察细胞变为纺锤形,细胞排列呈明显的辐射状或旋涡状,此时细胞状态最好,经多次传代换液,细胞轮廓清楚,折光性强,生长迅速,少量集落排列呈漩涡状。此时细胞处于有丝分裂中期更容易表达脂质体导入。接下来就是将含绿色荧光蛋白(GFP)的pEGFP-N1作为报告基因,证实目的基因在细胞内持续、高效、稳定地表达。在基因治疗的载体有病毒载体和质粒载体被广泛应用,脂质体作为基因转移的载体具有低毒、使用方便等优点,而且具有一定的转染效率〔12〕,该转染技术近年来发展较快,试剂商品化和安全性好,因而目前广泛应用于细胞基因转染。在基因治疗中将外源基因导入干细胞使其穿过细胞膜,进入细胞核表达是实验成败的关键,基因治疗的最大优点是通过机体自身细胞分泌转基因产物,避免了使用重组蛋白的昂贵费用。需要指出的是,本实验中转染效率仍偏低,这可能与载体细胞的特性和转染方法有关,应采取措施提高转染效率进一步改善基因治疗的效果。
1 Sensebé L,Krampera M,Schrezenmeier H,et al.Mesenchymal stem cells for clinical application〔J〕.Vox Sang,2010;98(2):93-107.
2 Uccelli A,Moretta L,Pistoia V.Mesenchymal stem cells in health and disease〔J〕.Nat Rev Immunol,2008;8(9):726-36.
3 Lou J,Xu F,Merkel K,et al.Gene therapy:adenovirus-mediated human bone morphogenetic protein-2 gene transfer induces mesenchymal progenitor cell proliferation and in vitro and differentiation bone formation in vivo.J Orthop Res,1999;17(1):43-50.
4 Yoo JU,Mandell I,Angele P,et al.Chondrogenitor cells and gene therapy〔J〕.Clin Orthop Relat Res,2000;379(Suppl):S164-70.
5 Franklin RJ,Gilson JM,Franceschini IA,et al.Schwann cell-like myelination following transplantation of an olfactory bulb-ensheathing cell line into areas of demyelination in the adult CNS〔J〕.Glia,1996;17(3):217-24.
6 Majumdar MK,Thiede MA,Mosca JD,et al.Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells(MSCs)and stromal cells〔J〕.J Cell Physiol,1998;176(1):57-66.
7 Wang Y ,Volloch V,Pindrus MA,et al.Murine osteoblasts regulate mesenchymal stem cells via WNT and cadherin pathways:mechanism depends on cell-celI contact mode〔J〕.J Tissue Eng Regen Med,2007;1(1):39-50.
8 Sim WY,Park SW,Park SH,et al.A pneumatic micro cell chip for the differentiation of human mesenchymal stem cells under mechanical stimulation〔J〕.Lab Chip,2007;7(12):1775-82.
9 黄定强,杨大鉴,黎万荣,等.骨髓间充质干细胞定向诱导条件下向脂肪细胞和成骨细胞诱导分化的关系〔J〕.中国组织工程研究与临床康复,2006;10(1):31-3.
10 Wang XJ,Dong Z,Zhong XH,et al.Transforming growth factor-beta1 enhanced vascular endothelial growth factor synthesis in mesenchymal stem cells〔J〕.Biochem Biophys Res Commun,2008;365(3):548-54.
11 Phinney DG.lsolation of mesenchymal stem cells from murine bone marrow by immunodepletion〔J〕.MethodsMol Biol,2008;449:171-86.
12 Hammes HP,Lin J,Wagner P,et al.Angiopoietin-2 causes pericyte dropout in the normal retina:evidence for involvement in diabetic retinopathy〔J〕.Diabetes,2004;53(4):1104-10.

