绿茶提取物EGCG对视神经节细胞RGC-5的促氧化和抗氧化作用
郑 斌 李光宇 李佳睿 郑永晨 (吉林大学第二医院眼科,吉林 长春 3004)
现代研究表明多酚类化合物是绿茶中主要的有效成分,包括儿茶素及其衍生物,儿茶素主要包括表没食子儿茶素没食子酸酯(EGCG)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)和表儿茶素(EC),其中含量最多的是EGCG〔1〕。大量研究表明,茶叶具有明显的神经保护作用,其作用机制与儿茶素的抗氧化作用、茶氨酸的镇静作用和咖啡碱的兴奋作用有关。EGCG是茶多酚中抗氧化功能最强的化合物,具有抗肿瘤、抗辐射、抗衰老和诱导细胞凋亡等功能〔2,3〕;然而,EGCG 在一定条件下可以产生过氧化氢,表现为促氧化的细胞毒作用〔4,5〕。因此,探讨EGCG对于细胞促氧化和抗氧化的条件非常有意义。
1 材料与方法
1.1 材料 小鼠视神经节细胞系RGC-5购自ATCC(本室保存);EGCG(Sigma-Aldrich);DMEM培养液和胎牛血清(FBS,Hyclone);过氧化氢(Fluka);过氧化氢检测试剂盒和活性氧(ROS)检测试剂盒(碧云天生物技术研究所);中性红;过氧化氢酶(牛肝,Sigma-Aldrich);台酚蓝(Sigma-Aldrich);细胞培养板和培养瓶(NUNC)。二氧化碳培养箱(150i.Thermal);全波长分光光度仪(Thermal);倒置显微镜和倒置荧光显微镜(奥林巴斯)。
1.2 方法
1.2.1 细胞培养 RGC-5细胞培养在含10%FBS的DMEM培养基中,37℃、5%CO2条件下培养,用培养瓶进行细胞增殖和传代,传代细胞密度2.0×104细胞/ml。实验细胞培养于96孔培养板内,细胞密度1.0×105细胞/ml,培养16~24 h,细胞融合度达75%用于试验。
1.2.2 EGCG和 EGCG-E配制 EGCG(分子量 458.4,纯度98%)配制10 mmol的贮存液;取46.8 mg EGCG,分别溶于10 ml生理盐水和无血清DMEM培养基中;培养基溶解的EGCG中加入1.0 mg过氧化氢酶,37℃ 4 h;然后80℃ 30 min灭活过氧化氢酶(EGCG-E),两种EGCG液分别过滤除菌,冻存。1.2.3 细胞增殖率检测 用中性红摄入法检测细胞增殖率。用0.25%胰酶消化细胞,用10%FBS的DMEM稀释细胞,密度1.0 ×105细胞/ml,加入 96 孔细胞培养版,每孔 100 μl,37℃、5%CO2培养16~24 h,细胞融合度达75%用于试验,试验时培养液换成含1%FBS的DMEM。根据不同试验组培养的时间加入中性红。方法是弃净培养液,用无血清DMEM洗2次,用无血清 DMEM稀释中性红浓度为0.05 mg/ml,每孔加入100 μl,37℃、5%CO2条件下培养2 h;弃净液体,用PBS洗2次,弃净PBS后每孔加入100 μl酸化乙醇液(0.4%盐酸,70%乙醇),室温避光2 h,检测OD530的光密度。细胞增殖和存活率计算方法是试验孔光密度比正常对照组的比值乘100%。1.2.4 过氧化氢检测 试剂在冰水浴上溶解,系列稀释标准品,在检测孔内加入50 μl样品或标准品;每个样品2孔,再向样品孔加入100 μl检测试剂轻轻振荡混匀,室温放置30 min,检测560 nm光密度。制作标准曲线和计算过氧化氢浓度。1.2.5 ROS检测 用无血清培养液1∶1 000稀释DCFH-DA,使终浓度为10 μmol。弃细胞培养液,加入50 μl稀释的DCFHDA,37℃细胞水浴箱内孵育20 min。用无血清细胞培养液洗涤细胞三次,再加入50 μl无血清培养液。荧光检测488 nm激发和525 nm收集的光密度,以试验孔的光密度比正常对照孔光密度比值乘100%为各组ROS相对活性。1.2.6 RGC-5细胞代谢过氧化氢 在75%细胞融合度96孔板内分别加入200 μmol的EGCG和过氧化氢100 μl,设置正常对照孔,37℃、5%CO2条件下培养,在培养0,10 ,30 ,60,90,120,150,180和240 min时收集培养上清液,每个时间点收集3个复孔。用过氧化氢检测试剂盒检测过氧化氢。1.2.7 EGCG,EGCG-E和过氧化氢细胞毒作用 在75%细胞融合度的96孔板内分别加入不同稀释度的EGCG,EGCG-E和过氧化氢 100 μl,稀释液是含 1%FBS的 DMEM,浓度为 0,12.5,25,50,100,200 和 400 μmol;每个稀释度 6 个复孔,37℃、5%CO2条件下培养24 h,中性红摄入法检测。1.2.8 EGCG和EGCG-E预处理的抗氧化作用 在75%细胞融合度96孔板内分别加入25 μmol EGCG或EGCG-E 100 μl,37℃、5%CO2条件下培养2 h;弃净液体,再重复处理一次;用含1%FBS的DMEM 稀释过氧化氢,浓度分别为0,25,50,100,200,400 和 800 μmol;每孔100 μl,每个稀释度 6 个复孔,37℃、5%CO2条件下培养24 h,中性红摄入法检测细胞存活率。1.2.9 EGCG,EGCG-E和过氧化氢对RGC-5细胞ROS的影响用含1%FBS的DMEM培养液分别稀释EGCG,EGCG-E和过氧化氢;浓度分别为 0,12.5,50,100,200 和 400 μmol,每孔100 μl,每个稀释度 6 复孔,37℃、5%CO2条件下培养 24 h,弃净培养液,进行ROS检测。
2 结果
2.1 RGC-5细胞代谢过氧化氢 直接加入的过氧化氢代谢快,120 min已接近消失,在最初30 min代谢50%以上;而EGCG产生的过氧化氢消失较慢,需要近240 min,150 min仍高于初始浓度的50%。见图1。
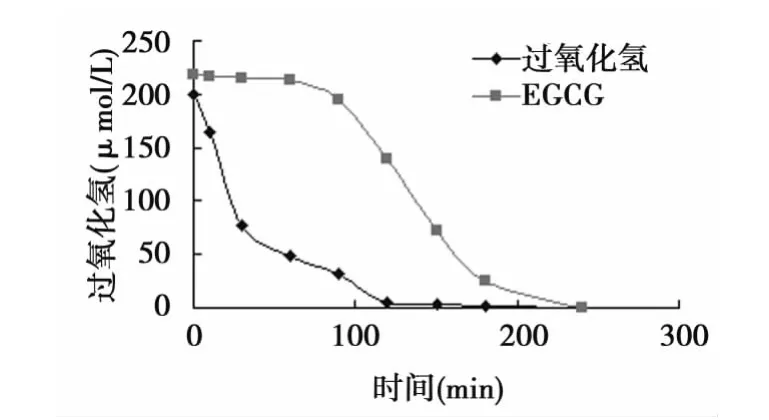
图1 RGC-5细胞代谢过氧化氢
2.2 EGCG,EGCG-E和过氧化氢对RGC-5细胞的细胞毒作用过氧化氢对RGC-5细胞的IC50为200 μmol;EGCG的IC50为367 μmol;而 EGCG-E 的 IC50在400 μmol以上。见图2。
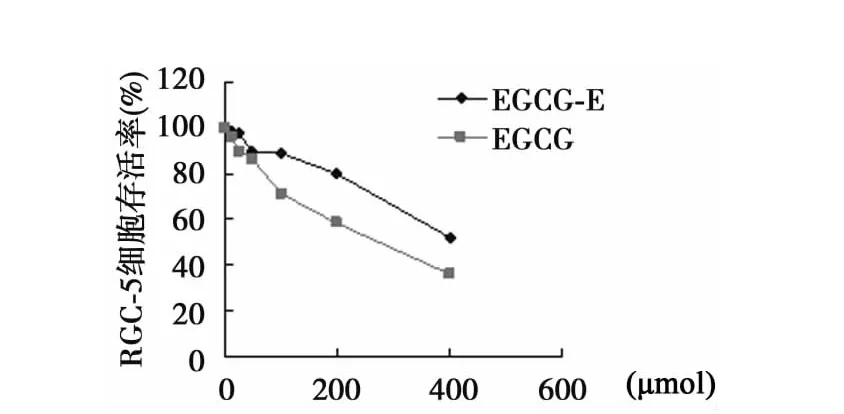
图2 EGCG和EGCG-E对RGC-5细胞的细胞毒作用
2.3 EGCG和EGCG-E预处理RGC-5细胞抗氧化作用 预处理的RGC-5细胞存活率明显提高;EGCG-E的存活率略高于EGCG。见图3。
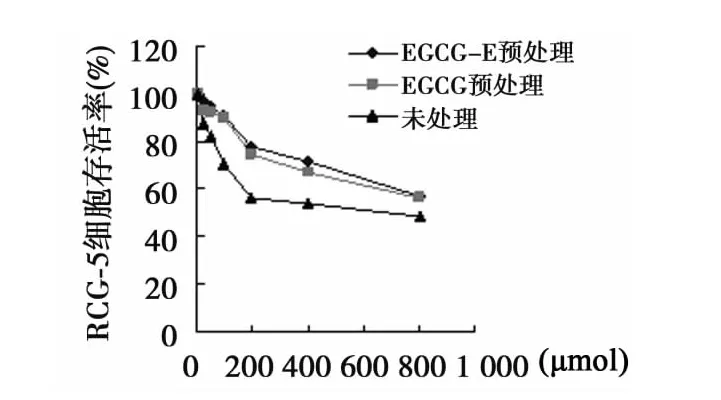
图3 EGCG和EGCG-E预处理RGC-5细胞抗氧化作用
2.4 EGCG,EGCG-E和过氧化氢对RGC-5细胞ROS的影响EGCG和EGCG-E浓度增高后ROS活性相对降低,两者没有明显差别;而过氧化氢在400 μmol时ROS明显升高。见图4。
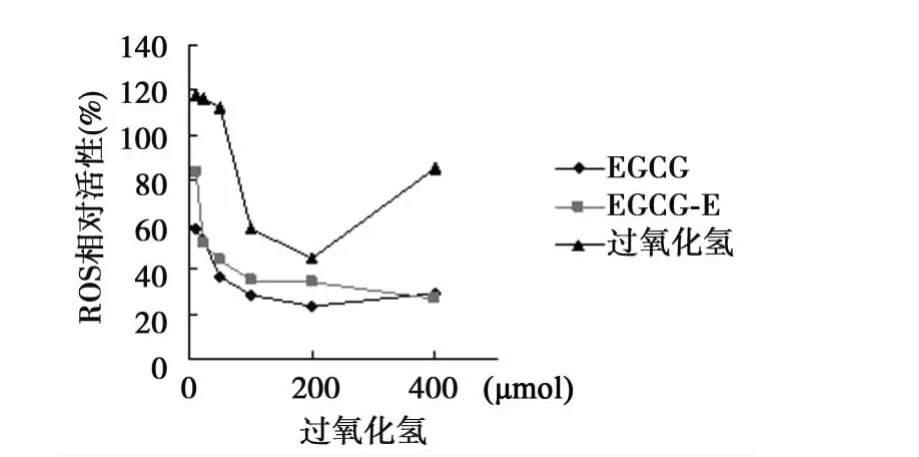
图4 EGCG,EGCG-E和过氧化氢对RGC-5细胞ROS的影响
3 讨论
EGCG是茶叶中的多酚类化合物,EGCG具有抗氧化和对抗各种活性氧的作用,EGCG与靶蛋白结合引起细胞静止或凋亡,还可以激活氧化还原敏感的NrfI信号通路,调节应激氧压力下抗氧化酶的活性〔6,7〕。
近期研究发现EGCG在体内可以产生多种活性氧,人和动物实验表明大量的摄入茶叶可以引起肝毒性。有报道重复低剂量的过氧化氢刺激可以诱导抗氧化酶系统的活性而保护大剂量过氧化氢引起的细胞损伤〔8〕,但是EGCG具体的生物活性作用的位置不清。
本文研究结果表明EGCG在培养细胞液中可以产生过氧化氢,并且EGCG产生的过氧化氢持续时间较长。EGCG经过氧化氢酶处理后表现为IC50上升400 μmol以上,表明EGCG对细胞的毒性并非完全来自EGCG产生的过氧化氢。本文研究结果显示EGCG和EGCG-E预处理对抗过氧化氢作用差别较小,说明EGCG不单纯是产生的小剂量过氧化氢诱导细胞抗氧化作用,还有EGCG对细胞信号系统的调节作用。在培养的条件下细胞内ROS的产生与很多因素有关系,根据本文结果,EGCG和EGCG-E不同浓度处理RGC-5细胞,ROS产生随浓度升高而减少,推测EGCG和EGCG-E在较高浓度时并非直接抑制ROS产生,可能是对细胞的毒性所致,而400 μmol过氧化氢显示的高ROS可能是细胞死亡后残留的过氧化氢。
总之,EGCG表现为在一定条件下产生过氧化氢,对细胞产生氧化作用,在较低剂量表现抗氧化作用,因此不宜过多摄入。
1 Yang CS,Wang X,Lu G,et al.Cancer prevention by tea:animal studies,molecular mechanisms and human relevance〔J〕.Nat Rev Cancer,2009;9:429-39.
2 Yang CS,Lambert JD,Sang S.Antioxidative and anti-carcinogenic activities of tea polyphenols〔J〕.Arch Toxicol,2009;83:11-21.
3 Ishii T,Mori T,Tanaka T,et al.Covalent modification of proteins by green tea polyphenol(-)-epigallocatechin-3-gallate through autoxidation〔J〕.Free Radic Biol Med,2008;45:1384-94.
4 Li GX,Chen YK,Hou Z,et al.Pro-oxidative activities and dose-response relationship of(-)-epigallocatechin-3-gallate in the inhibition of lung cancer cell growth:acomparative study in vivo and in vitro〔J〕.Carcinogenesis,2010;31:902-10.
5 Leonilla Elbling,Irene Herbacek,Rosa-Maria Weiss,et al.Hydrogen peroxide mediates EGCG-induced antioxidant protection in human keratinocytes〔J〕.Free Rad Biol Med,2010;49:1444-52.
6 Owuor ED,Kong AN.Antioxidants and oxidants regulated signal transduction pathways〔J〕.Biochem.Pharmacol,2002;64:765-70.
7 Na HK,Kim EH,Jung JH,et al.(一)-Epigallocatechin gallate induces Nrf2-mediated antioxidant enzyme expression via activation of PI3K and ERK in human mammary epithelial cells〔J〕.Arch Biochem Biophys,2008;476:171-7.
8 Lambert JD,Sang S,Yang CS.Biotransformation of green tea polyphenols and the biological activities of those metabolites〔J〕.Mol Pharm,2007;4:819-25.

