盐胁迫下小麦种子萌发及生理指标的测定
刘建巍,朱 宏
(哈尔滨师范大学)
0 引言
土壤盐渍化是一个世界性的资源问题和生态问题,越来越引起人们的重视,联合国粮农组织的调查结果显示,全球6%的陆地面积遭受着土壤盐渍化的侵蚀,20%的灌溉农业受到不同程度的盐害威胁.以中国天津市为例,全市轻、中、重盐渍化土壤共计1250 km2,土壤盐分以氯化钠占绝对优势[1].土壤盐碱重、面积大、治理困难,严重影响着干旱和盐渍化地区种植业的持续发展,也给园林绿化带来很大困难[2].目前研究者已从盐分胁迫对植物的影响及植物的抗盐研究方面开展了大量研究.主要包括以下几个方面.
(1)盐胁迫对植物光合作用的影响
光合作用是植物最基本的生命活动,相关文献报道盐胁迫会抑制植物的光合作用,但也有一些报道发现,低盐刺激不会抑制光合作用而且有时反而对光合有促进作用[3].盐害使叶绿体内的蛋白质合成受到破坏[4],从而叶绿体内蛋白质的数量减少,叶绿体与蛋白质的结合削弱,叶绿体趋向分解.叶绿素和类胡萝卜素的合成也受干扰,叶片失去绿色.
(2)盐胁迫对植物生长的影响
一般而言,在高盐胁迫下,植物生长发育会发生一定变化,高盐胁迫会抑制植物组织和器官的生长和分化,使植物的发育进程在一定程度提前.同时高盐胁迫还会造成植物叶面积扩展速率降低,随着含盐量的增加,叶面积停止增加,叶、茎和根的鲜重及干重降低[5].
(3)盐胁迫对植物蛋白及脂类的影响
一般而言过多的盐分抑制蛋白质合成而促进其分解,抑制的直接原因可能是由于破坏了氨基酸的合成[6].脂类对于很多生理胁迫的耐受都有很重要的作用,主要包括饱和脂肪酸和不饱和脂肪酸,其中不饱和脂肪酸可以消除水胁迫和盐胁迫的危害.
(4)盐胁迫对抗氧化酶的影响
相关的研究表明,由高浓度的NaCl等盐分引起的植物氧化胁迫是非生物胁迫中一个非常重要的潜在因素.在高盐胁迫条件下,植物体内SOD等酶的活性与植物的抗氧化胁迫能力呈正相关,而且在盐分胁迫下,盐生植物与非盐生植物相比,其SOD、CAT、POD活性更高,因而更能有效地清除活性氧,防止膜脂过氧化.一些科学家认为,盐胁迫下小麦叶片中抗坏血酸含量下降,用活性氧清除剂处理可明显缓解抗坏血酸含量下降,且外源抗坏血酸能明显缓解由盐胁迫造成的细胞膜伤害.
(5)盐胁迫对膜透性的影响
植物生长在盐渍环境中,由于细胞质是有机体与外界环境的屏障,盐分胁迫首先并直接影响细胞质膜,盐分胁迫对植物的伤害作用,在很大程度上是通过生物膜的生理功能引起的[7].例如杨国会用不同浓度的 NaCl处理甘草,发现质膜相对透性由46%增大到84%,植物细胞膜完整性遭到破坏,胞质电解质大量外渗[8].因此,盐胁迫浓度增大,即破坏膜透性程度增大.大量研究表明,盐胁迫可能增大植物质膜的膜脂过氧化作用,影响膜的组分[9].
盐胁迫通常会抑制植物的生长,此方面的研究多以种子发芽后成苗的各个发育阶段为研究对象,而较少的涉及到植物生长发育的起始阶段——种子萌发阶段.种子能够在盐胁迫下萌发成苗,是植物在盐碱条件下生长发育的前提,因此,研究盐胁迫下种子的萌发及生理特性具有重要的意义.该文以非耐盐植物小麦作为实验材料,研究一下盐胁迫条件下小麦种子萌发率及萌发阶段胚根的各生理指标的变化.希望为小麦的耐盐栽培提供一定的理论和试验依据.
1 实验材料与方法
1.1 实验材料
市场上购买的普通小麦(T.aestivum L.)作为实验材料.
1.2 萌发率的统计——计数法
室内种子萌发试验.选择100粒大小一致、籽粒饱满的种子,置于铺有3层滤纸的干净培养皿中,分别加入浓度0.1%、0.2%、0.4%、0.6%、0.8%NaCl溶液,以蒸馏水处理为对照(CK).3次重复,采用随机排列.放入温度为(25±1)℃的恒温培养箱内保温培养,黑暗条件下进行发芽试验,在第6天运用计数法分别查出每个培养皿中小麦萌发的个数,计算萌发率,并且称量小麦的胚根长以及百粒小麦的胚根总重.
1.3 脯氨酸含量的测定——茚三酮法
脯氨酸含量测定采用磺基水杨酸提取,茚三酮比色法[11].具体步骤如下:每个处理组随机取小麦胚根0.5 g,用3%磺基水杨酸研磨提取(终体积为5 mL),匀浆转入玻璃离心管,沸水浴10 min,冷却后3000 r/min离心10min,取上清2 mL,加入2 mL水、12 mL冰乙酸和4 mL的2.5%的茚三酮,沸水浴60 min,冷却加入4 mL甲苯,静置后取甲苯相测定OD620值.
1.4 可溶性蛋白含量;考马斯亮蓝染色法
0.5 g小麦胚根,加入 1.5 mL预冷的内含0.1%PVP,0.1 mol/L EDTA,1 mol/L 抗坏血酸磷酸(pH=7.8)缓冲液,4℃冰浴研磨,15000 g离心30 min,取上清液.用考马斯亮蓝G-250做显色剂,分光光度计在波长595 nm处测定OD值,以牛血清白蛋白为标准并根据标准曲线计算蛋白质量分数[12].
1.5 丙二醛含量:硫代巴比妥酸法
称取小麦胚根0.2 g,加入10%三氯乙酸(TCA)5 mL(分两次加)和少量石英砂充分研磨,匀浆液以4000 r/min离心20 min,上清液即为样品提取液.取2 mL提取液,分别加入2 mL 0.6%TBA液,混匀,在试管上加盖塞,置于沸水浴中沸煮15 min,迅速冷却,离心.取上清液测定532 nm和450 nm下的A值.以2 mL水代替提取液调零.根据 C=6.45 ×A532-0.56 ×A450,计算出样品提取液中丙二醛的浓度C,然后再计算出每克样品中丙二醛的含量(μmol/g(FW))[13].
1.6 质膜相对透性——电导率法
细胞膜透性采用电导法[14],以电解质渗透率表示.具体方法是:将小麦胚根剪成0.3cm或0.5 cm的小段,每个注射器中放入0.3 g胚根,再加入10 mL蒸馏水,堵住注射器进行抽气,至胚根沉降,并全部沉入水底,然后注入试管中,并将试管放置室温下保持60 min,其间要多次摇动试管.待充分摇匀,用DDS-1lC型电导仪测电导值S1,将各试管盖塞封口,置沸水浴中10 min,以杀死植物组织.取出试管后用自来水冷却至室温,并在室温下平衡10 min,摇匀测其终电导值S2,最后设蒸馏水为空白,测空白电导值.以相对电导率的大小表示细胞膜受伤害的程度,可根据以下公式计算:相对电导率(L)=(S1-空白电导率)/(S2-空白电导率).
2 实验结果与分析
2.1 不同盐浓度对小麦萌发率、胚根长度、胚根重的影响
由表1可得出结论:盐胁迫盐浓度在0.0%~0.2%之间时,萌发率随盐浓度的增加而增加,盐浓度在0.2% ~0.8%之间时,萌发率随盐浓度的增加而下降.0.2%的 NaCl浓度是小麦萌发的最适浓度,小麦胚根平均长度以及胚根重呈正相关.由以上数据还可以看出虽然0.2%的 NaCl浓度适宜小麦萌发却不适宜胚根生长,0.1%的NaCl浓度最适宜小麦胚根的生长.用spss1.3软件对以上数据进行单因素差异显著性分析可得:各盐浓度萌发率、平均胚根长度、胚根总重与对照组相比均差异显著,且两两比较均表示差异显著(见表1).
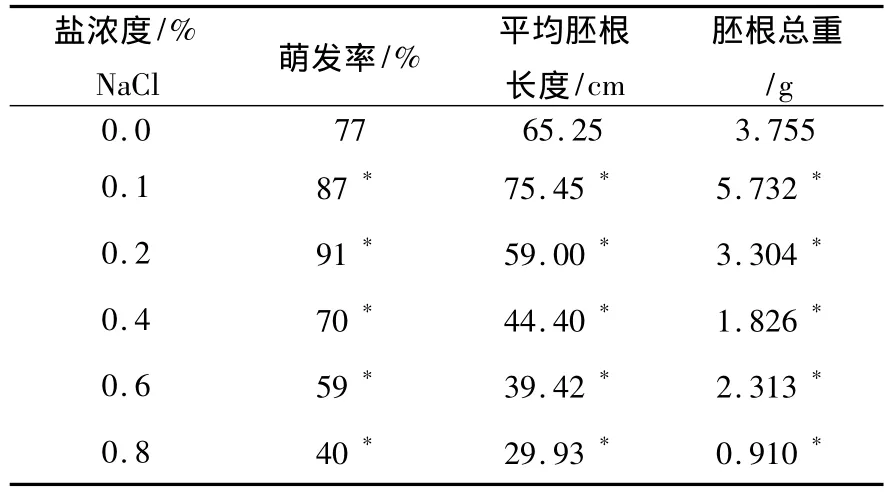
表1 不同盐浓度下小麦萌发率、胚根长及总重
2.2 不同浓度盐胁迫对小麦胚根脯氨酸含量的影响
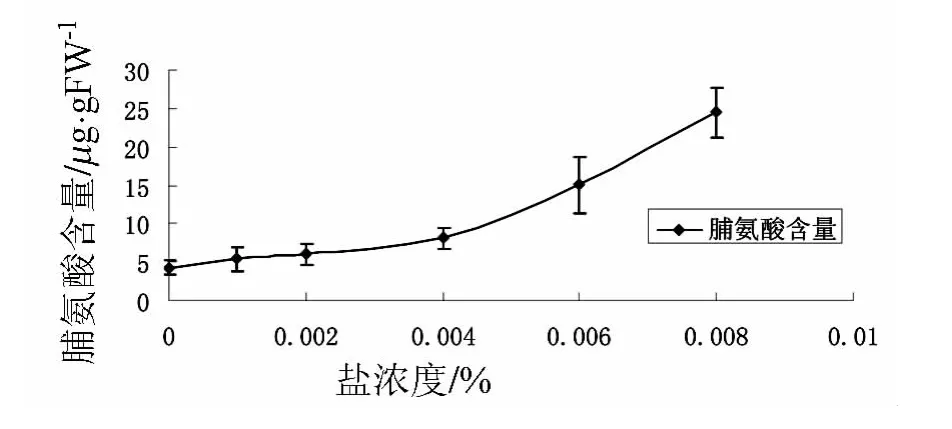
图1 不同盐浓度下小麦胚根的脯氨酸含量
由图1的结论可知,盐胁迫可以使小麦胚根的脯氨酸含量有极显著的增加且随盐胁迫浓度的增加,脯氨酸含量呈逐渐增加的趋势.脯氨酸含量随盐浓度增加的程度表现为0.8%NaCl的盐胁迫最高,0.1%NaCl盐胁迫和 0.2%NaCl接近相等.此外,本试验结果显示:0.1%NaCl盐胁迫所造成的脯氨酸含量的增加显著低于0.8%NaCl盐胁迫,分析这种情况出现的原因可能是由于0.8%NaCl的盐胁迫较强烈地抑制了脯氨酸的分解反应,即高浓度的盐胁迫降低了脯氨酸分解过程中酶的活性,导致脯氨酸含量持续性的增高.
2.3 不同浓度盐胁迫对小麦胚根可溶性蛋白含量的影响
由图2可得出结论:不同浓度盐胁迫下小麦胚根的可溶性蛋白含量不同,随着盐浓度的增加小麦胚根中可溶性蛋白含量呈上升的趋势.对照组的可溶性蛋白含量最低,盐浓度为0.8%NaCl时可溶性蛋白的含量最高.
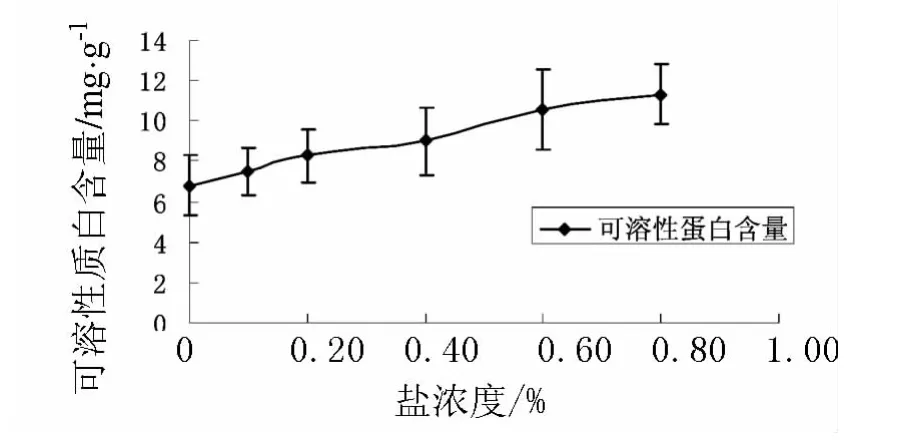
图2 不同盐浓度下小麦胚根的可溶性蛋白含量
2.4 不同盐浓度对小麦胚根丙二醛(MDA)含量的影响

图3 不同盐浓度下小麦胚根MDA含量
由图3可得结论:不同浓度盐胁迫下小麦胚根的丙二醛含量不同,0.8%NaCl时丙二醛的含量最低,盐浓度为0.2%NaCl时丙二醛的含量最高.随着盐浓度的增加丙二醛含量呈先上升后下降的趋势,由上图可以看出盐浓度为0%~0.2%之间时MDA含量随盐浓度增加而上升,盐浓度为0.2% ~0.8%之间时MDA含量随盐浓度增加而下降.
2.5 不同盐浓度对小麦胚根质膜相对透性的影响
由图4可得出结论,不同盐浓度处理引起小麦胚根的膜透性发生显著变化,且这种变化呈逐渐递增的趋势.其中0.1%的 NaCl浓度与水培下小麦胚根的膜电导率接近相等,说明0.1%的NaCl浓度对小麦胚根而言是适宜的盐浓度.
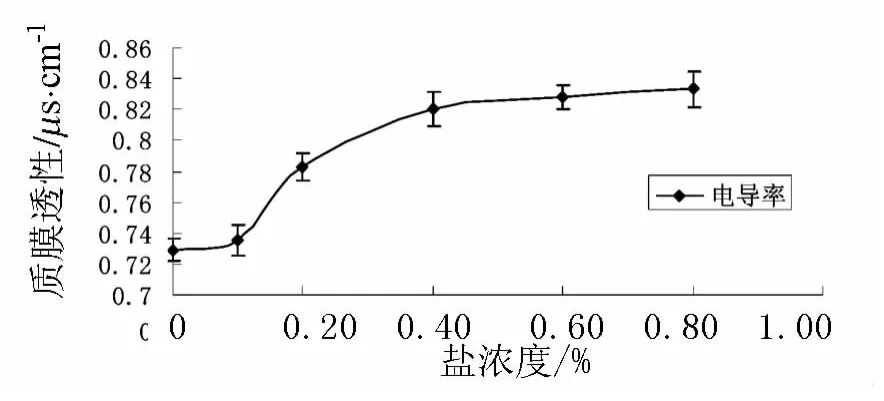
图4 不同盐浓度处理下小麦胚根的质膜透性
3 讨论
前人盐胁迫研究已经取得了一定的成果,例如张亚冰等利用葡萄砧木为材料研究盐胁迫下不同耐盐性葡萄砧木丙二醛和脯氨酸含量的变化[15],结论是在不同胁迫下,不同耐盐性葡萄砧木品种的丙二醛和可溶性蛋白含量变化不同,不同盐浓度下丙二醛和蛋白的含量随盐浓度的增加呈增加的趋势;马文月等研究植物抗盐性研究进展,得出结论——盐胁迫可能增大植物质膜的膜脂过氧化作用[16],影响膜的组分;韩金龙利用玉米为材料研究盐胁迫下不同玉米品种在苗期叶片和根中 Na+、K+、Ca2+及脯氨酸含量变化[17],得出结论——脯氨酸的累积与植物对环境胁迫的耐受能力正相关;本次实验所得结果与前人的结论基本是一致,盐胁迫可破坏膜组分,影响膜透性,使脯氨酸含量积累,且这种影响是随盐浓度的增加而逐渐加强的;盐胁迫也可以影响小麦胚根中可溶性蛋白的含量,其中可溶性蛋白含量随盐浓度的增加而逐渐增加.
但该实验研究的生理指标中,丙二醛的含量变化与一些学者的研究结论不同,小麦胚根中的丙二醛含量成先升高后下降的趋势,丙二醛含量在盐浓度为0.2%NaCl时达到最大值,随着盐浓度增加丙二醛含量却下降.分析出现这种现象的原因可能是由于小麦胚根中丙二醛对盐胁迫的反应比较敏感,起初随盐浓度的增加丙二醛逐渐积累来反应细胞受胁迫程度,当盐浓度到一定程度时达到了丙二醛积累体系的极限,致使丙二醛不再继续积累.
[1] 毛建华,沈伟然.天津滨海新区土壤盐碱与污染状况及土地利用的思考.天津农业科学,2005(11):15-17.
[2] 张征云,孙贻超,孙静.天津市土壤盐渍化现状与敏感性评价.农业环境科学学报,2006,25:954-957.
[3] 王亚庆,刘敏,张守栋.盐胁迫对盐角草种子萌发与幼苗生长效应的研究.江苏农业科学,2002(2):P69-71.
[4] 李潮流,周湖平,张国芳.盐胁迫对多叶型苜蓿种子萌发的影响.中国草地,2004(7):21-25.
[5] 郝鲁宁,余叔文.植物细胞内信使及其功能.植物生理学与分子生物学,1992,5:12-14.
[6] 杨国会,石德成.NaCl和Na2CO3胁迫对甘草幼苗膜质过氧化作用的影响.湖北农业科学,2009,48,11-13.
[7] 白宝璋,汤学军.植物生理学测试技术.北京:中国科学技术出版社,1993(7):73-157.
[8] 张殿忠,汪沛洪,赵会贤.测定小麦叶片游离脯氨酸含量的方法.植物生理学通讯,1990(4):62-65.
[9] 王世珍,蔡庆生,孙菊华.冷锻炼下高羊茅抗冻性的变化与碳水化合物和脯氨酸含量的关系.南京农业大学学报,2003,26:10-13.
[10]田敏,饶龙兵,李纪元.植物细胞中的活性氧及其生理作用.植物生理学通讯,2005,41,235-241.
[11]薄鹏飞,孙秀玲,孙同虎.NaCl胁迫对海滨木槿抗氧化系统和渗透调节的影响.西北植物学报,2008(1):7-9.
[12]陈发河,张维一.低温胁迫对甜椒果实游离脯氨酸的影响.植物生理学通讯,1991,27,365-368.
[13]杜长霞,李娟,郭世荣.外源亚精胺对盐胁迫下黄瓜幼苗生长和可溶性蛋白表达的影响.南京农业大学学报,2007(4):3-4.
[14]龙桂友,刘杰,饶力群.枳落叶前的抗寒能力分析.湖南农业大学学报,2007,6:21-22.
[15]张亚冰,刘崇怀.盐胁迫下不同耐盐性葡萄砧木丙二醛和脯氨酸含量的变化.河南农业科学,2006(4):4-6.
[16]马文月.植物抗盐性研究进展.农业与技术,2004(4):95-99.
[17]韩金龙,徐立华,徐相波.盐胁迫下不同玉米品种在苗期叶片和根中Na+、K+、Ca+及脯氨酸含量变化的研究.作物杂志,2010(1):3-5.

