哈尔滨师范大学样地土壤微生物的分离及鉴定*
邢卉研,王继华,魏京焘
(哈尔滨师范大学)
0 引言
土壤微生物是衡量土壤生态环境的重要指标之一,它们参与土壤中的许多生物化学反应过程.自然界中凡是肉眼看不清楚或看不见的微小生物统称土壤微生物,一般包括细菌、真菌、放线菌、古菌、原生动物、纤维藻类和病毒等[1].微生物在土壤营养元素循环过程中起着十分关键的作用,细菌通过其自身的生理特性可引起土壤成分变化,调节土壤酸碱性等,为农作物的生长提供营养[2].
主要研究哈尔滨师范大学大豆样地土壤微生物的种类和生理生化特性.认识土壤微生物结构,能够更好地发挥土壤微生物的功能,为改良土壤,提高产量提供科学依据,为工农业生产服务[3].因此研究土壤微生物结构的变化及微生物与生态环境之间的关系具有重要的科研和实践意义.
1 实验材料与方法
1.1 实验材料
土壤样品取自于哈尔滨师范大学大豆试验田,采集土壤样品装入无菌聚乙烯袋后密封,土壤带回实验室立即进行土壤微生物分离,剩余土样放入4℃冰箱进行保存.
1.2 实验方法
1.2.1 微生物数量统计
土壤微生物(细菌、放线菌、真菌)的菌群数量单位为个/g干土,数量采用平板稀释涂布方法测定.
细菌数量的测定采用牛肉膏蛋白胨琼脂培养基,以平板表面涂抹法或平板倾注法,按公式1计算细菌数.放线菌数量测定采用改良的高氏Ⅰ号培养基.真菌采用链霉素-马丁氏孟加拉红培养基进行涂布计数.将所得数据记录结果.
公式1:菌数=菌落平均数×稀释倍数/干土%
1.2.2 微生物分离、纯化及鉴定
采取传统微生物分离方法,对土样的微生物进行分离、纯化,进行形态观察并记录.对纯化的细菌菌株进行生理生化试验,包括接触酶(过氧化氢)试验,尿素试验,苯丙氨酸脱氢酶试验,糖发酵(葡萄糖、蔗糖、淀粉)试验,甲基红(M.R.)试验,乙酰甲基甲醇(V.P.)试验,淀粉水解试验,纤维素水解试验,吲哚试验,柠檬酸盐试验和油脂水解试验.测试细菌的对生物大分子,含C或含N化合物的利用情况,并记录结果.
用不同的生理生化指标培养特征作为鉴定放线菌的依据.生理生化实验包括:吲哚实验、淀粉水解实验、明胶液化实验、产硫化氢实验、牛奶石蕊实验、糖发酵实验(葡萄糖、乳糖、麦芽糖).
对土壤真菌的鉴定主要依据真菌菌落特征、菌丝体特征以及孢子着生位置和形态特点.对真菌的菌落形态特征观察并记录.
依据经典的微生物分类方法,对菌种的形态学特征及生理生化特征进行测定,主要依据微生物的形态学、生理学和生态学特征进行初步的分类,并参照《伯杰细菌鉴定手册》(第八版)[4]、《微生物分类学》[5]进行鉴定.
2 实验结果与分析
2.1 土壤中三大类微生物的数量
土壤微生物在土壤中的数量、分布与活动情况,反映了土壤肥力的高低,因此常用作评价土壤质量,维持生产力、保护环境质量以及维持系统健康的生物指标.
实验对哈尔滨师范大学大豆耕地土壤微生物数量进行统计(见表1).结果表明在土壤微生物三大类群微生物组成中,细菌数量占绝对优势,放线菌数量次之,真菌数量最少.

表1 三大类微生物在土壤中的数量组成
2.2 土壤微生物分类鉴定结果
2.2.1 细菌形态学鉴定结果
研究细菌的生理生化反应主要观察细菌的代谢特征,对营养源的利用情况,生长发育条件,能否产酸、产气、产碱等.本次实验共分离获得细菌25株,生理生化实验表明:土壤中大多数细菌不能水解油脂和明胶,多数菌种可以水解纤维素和淀粉,所得菌种均不产氨,多数能还原硝酸盐,仅少数菌种能够发酵葡萄糖、淀粉产酸,多数能发酵蔗糖产酸或既产酸又产气,接触酶反应、吲哚反应大部分为阳性,石蕊牛奶实验多数产碱、胨化.
利用《微生物分类学》等,根据细菌的形态学特征和生理生化特征,对分离菌株进行初步的鉴定,鉴定结果(见表2).土壤中25株细菌分别属于12个不同菌属:其中芽孢杆菌属约占44%、固氮菌属约占8%、微球菌属及假单胞菌属也占8%、芽孢八叠球菌属约占4%、黄单胞菌属占4%、盐杆菌属及动性球菌属也占4%.
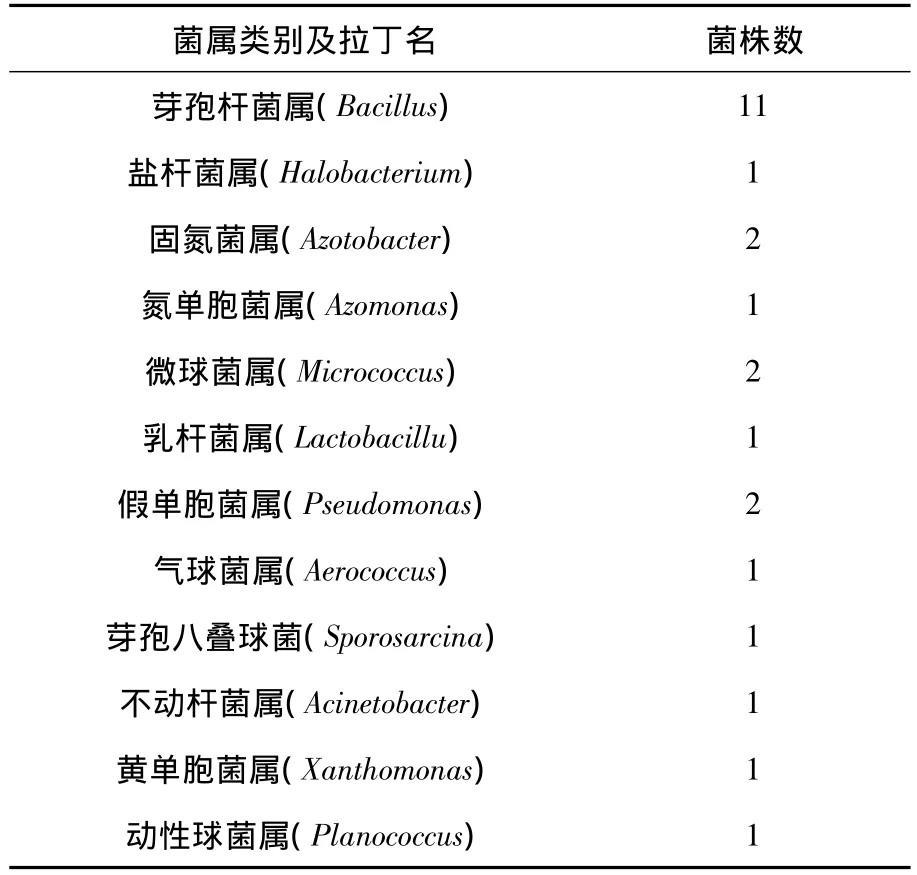
表2 细菌菌属鉴定结果
2.2.2 放线菌形态学鉴定结果
放线菌主要存在于土壤环境中,绝大多数能够产生抗生素,是土壤微生物重要的成员.实验对土壤放线菌进行培养、分离、纯化得到优势菌种,共分离获得放线菌10株.放线菌的生理生化实验主要包括:淀粉水解、接触酶试验、硝酸盐还原试验、糖发酵试验(葡萄糖、蔗糖).实验表明,大部分土壤放线菌能够产生过氧化氢酶,但大部分土壤放线菌不能够水解淀粉,硝酸盐还原反应大部分为阳性,多数放线菌能够发酵糖类产酸.经鉴定,分别属于7个不同菌属(见表3):链霉菌属(Streptomyces)3株、罗氏菌属(Rothia)、线杆菌属(Bacterionema)2株、诺卡氏菌属(Nocardia)、假诺卡氏菌属(Pseuconocardia)、链孢囊菌属(Streptosporangium)及嗜皮菌属(Dermatophilus).

表3 放线菌菌属鉴定结果
2.2.3 真菌形态学鉴定结果
真菌的基本结构为菌丝和孢子,观察真菌孢子结果显示,大部分真菌孢子为分生孢子,样品中未分离出酵母菌.共分离真菌7株(见表4),属于青霉属(Penicillium)、曲霉属(Aspergillus)、根霉属(Rhizopus)、镰孢菌属(Fusarium)及不产孢真菌(Sterile mycelia).

表4 真菌菌属鉴定结果
3 结束语
土壤微生物是土壤中活跃的因子之一[6],也是土壤肥力的一个重要部分,施肥制度和施肥方式的不同将会改变土壤微生物的种群数量、结构和活性进而对土壤肥力产生影响[7].土壤中微生物数量巨大,繁殖性强,种类繁多,作用机理复杂多样,在土壤生物的地球化学循环过程的研究中占有重要的地位[8,9].土壤的微生物类群中,细菌数量最多,放线菌数量次之,真菌数量最少.实验根据所分离微生物的个体特征、菌落形态特征及其生理生化特性进行初步鉴定.结果表明,土壤中25株细菌分别属于12个不同菌属;共分离获得放线菌10株,分别属于7个不同菌属;共分离真菌7株,属于5类不同菌属.
该实验旨在研究样地土壤微生物多样性,在后续试验中还将对土壤酶活性、土壤理化性质进行分析,找出微生物与土壤环境的互作关系,再进一步探讨该互作关系对作物生长的影响.
[1] Zhang P J,Zheng J F,Pan G X,et al.Changes in microbial community structure and function within particle size fractions of a paddy soilunderdifferent long-term fertilization treatments from the TaiLake region[J].Colloids and SurfacesB,2007,58:264-270.
[2] 邹莉,袁晓颖,李玲,等.连作对大豆根部土壤微生物的影响研究[J].微生物学杂志,2005,25(2).
[3] 杨鹏,薛立,陈红跃,等.不同混交林地土壤养分,酶活性和微生物的研究.湖南林业科技,2004,31(4).
[4] Buchanan RE,et al.伯杰氏细菌鉴定手册:第八版[M].北京:科学出版社,2000.
[5] 张纪忠.微生物分类学[M].北京:复旦大学出版社,1990.
[6] Dong X Z.Manual of Determinative Bacteriology[M].Beijing:Science Press,2001.
[7] Abbott L K,Murrphy D V.Soil Biological Fertility[M].Nether lands:Kluwer Academic Publishers,2003.
[8] Tied je J M,Asuming-Brem pong S,Nusslein K,et al.Opening the black box of soil microbial diversity[M].Applied Soil Ecology,1999(13):109-122.
[9] Girvan M S,Bullimore J,Pretty J N,et al.Soil type is the primary determinant of the composition of the total and active bacterial communities in arable soils[M].App lied and Enviromental Microbiology,2003,69:1800-1809.

