细胞周期调控系统相关因子Cyclin D1-CDK4-p21在瘢痕癌中的表达及意义
林宇静,郭瑞珍,王海青
0 引 言
细胞周期调控系统“Cyclins-CDKs-CKIs”由细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(Cyclin dependent kinases,CDK)、细胞周期蛋白依赖性激酶抑制物(Cyclin dependent kinase inhibitors,CKI)共同构成[1],细胞周期的不同时相由不同的Cyclin控制,不同的Cyclin与不同的CDK结合形成复合物,促进细胞由一个细胞阶段向另一个细胞阶段有序转换,系统中CDK是细胞周期调节的中心环节,其活性受CyclinD的正向调控,受CKI的负向调控[2]。执行细胞周期G1/S期调控的Cyclin主要有Cyclin D1、D2,CDK 主要有 CDK4、CDK6,CKI有p21、p27等细胞因子。本文探讨并报道细胞周期调控系统相关因子Cyclin D1-CDK4-p21在瘢痕癌中的表达和意义。
1 材料与方法
1.1 主要实验材料 标本取自遵义医学院病理教研室和中山大学附属第五医院病理科2005-2011年石蜡包埋的标本,分为瘢痕癌组、病理性瘢痕组和正常组。瘢痕癌组病例临床均有病理性瘢痕形成史,病变部位分布在上肢、下肢和头皮,从瘢痕形成到癌变的时间为2年到20年不等,癌的组织学类型均为鳞状细胞癌;病理性瘢痕组患者临床有皮肤烧伤或机械性创伤等损伤史,部位在下肢及胸腹部等处,瘢痕形成的时间为2个月至2年不等;正常皮肤组织取自临床手术切除的带有正常皮肤组织的病变标本。
1.2 主要实验试剂 兔抗人Cyclin D1多克隆抗体,CDK4、p21单克隆抗体,均购自武汉博士德公司。CyclinD1 mRNA、CD4 mRNA和p21 mRNA寡核苷酸探针原位杂交试剂盒,购自武汉博士德公司。
1.3 实验方法及步骤 所用组织均为4%甲醛固定,石蜡包埋,所用切片均为4 μm厚,捞片于处理过的防脱片上,60℃烤干,4℃保存备用。
1.3.1 免疫组化法 p21蛋白用乳腺癌组织作阳性对照,Cyclin D1、CDK4用结肠癌组织作阳性对照,以PBS代替一抗为阴性对照。切片常规脱蜡至水,微波抗原修复,操作步骤按试剂盒说明书进行,经DAB显色,苏木精复染,脱水干燥、透明,中性树胶封固。
1.3.2 原位杂交技术 p21 mRNA用乳腺癌组织作阳性对照,CyclinD1 mRNA、CDK4 mRNA用结肠癌组织作阳性对照,滴加没有探针的预杂交液为阴性对照。操作步骤按原位杂交试剂盒说明书进行,每张切片分别滴加20 μL含CyclinD1 mRNA、CDK4 mRNA和p21 mRNA核苷酸探针杂交液,40℃杂交过夜,CyclinD1 mRNA用AEC显色,其他2种指标用DAB显色,苏木精复染,封固,光学显微镜观察。
1.4 标准判断
1.4.1 免疫组化及原位分子杂交阳性表达定位判断 DAB显色阳性信号为棕黄色颗粒状,AEC显色阳性信号为红色颗粒状。Cyclin D1蛋白阳性信号位于细胞核,p21、CDK4蛋白及CyclinD1 mRNA阳性信号位于细胞核及细胞质,CDK4 mRNA、p21 mRNA阳性信号位于细胞质。
1.4.2 免疫组化及原位分子杂交阳性等级判断采用半定量积分法,根据每张切片的阳性细胞百分数和染色强度计分的乘积来判定[3],<2分为阴性,2~3分为弱阳性,4~6分为阳性,>6分为强阳性。
1.4.3 免疫组化及原位分子杂交表达水平和表达强度判断 运用CCD成像系统,在400倍镜下,每张切片选取10个不同视野成像,应用显微图像分析系统分别检测阳性染色的表达水平(阳性面积)和表达强度(平均光密度),各取平均值。
1.5 统计学分析 采用SPSS 17.0软件进行统计分析,定量资料采用均数±标准差(±s)表示,各检测指标均采用单因素方差分析,两两比较采用最小显著差异法,相关性分析采用Pearson相关分析。以P≤0.05为有统计学意义。
2 结 果
2.1 CDK4蛋白及其mRNA的表达 在正常皮肤表皮中,仅2例病例基底层细胞CDK4蛋白及其mRNA见弱阳性表达;在病理性瘢痕被覆上皮中,阳性细胞数比正常皮肤表皮稍增多,均呈弱阳性表达;在瘢痕癌组织中呈强阳性表达。见图1、图2。瘢痕癌组分别与正常皮肤组和病理性瘢痕组比较,CDK4蛋白及其mRNA表达水平、表达强度差异均有统计学意义(P<0.01),但正常皮肤组与病理性瘢痕组比较,差异无统计学意义(P>0.05)。见表1。
2.2 CyclinD1蛋白及其mRNA的表达 分别检测10例正常皮肤表皮、15例病理性瘢痕被覆上皮和25例瘢痕癌组织。Cyclin D1蛋白及其mRNA在正常皮肤表皮中,仅基底细胞层见少数弱阳性表达细胞;在病理性瘢痕上皮中弱阳性表达细胞数比正常皮肤表皮略显增多;在瘢痕癌组织中呈强阳性表达,见图3、图4,瘢痕癌组分别与正常皮肤组和病理性瘢痕组比较,CyclinD1蛋白及其mRNA表达水平、表达强度差异均有统计学意义(P<0.01),但正常皮肤组与病理性瘢痕组比较,差异无统计学意义(P >0.05)。见表2。
2.3 p21蛋白及其mRNA的表达 分别检测10例正常皮肤表皮,15例病理性瘢痕被覆上皮和30例瘢痕癌组织,p21蛋白及其mRNA在正常皮肤表皮和病理性皮肤瘢痕上皮中均呈阴性或弱阳性表达;在瘢痕癌癌巢中呈强阳性表达,见图5、图6。瘢痕癌组与皮肤瘢痕组和正常皮肤组比较,p21蛋白及其mRNA表达水平、表达强度差异均有统计学意义(P<0.01),但瘢痕组与正常皮肤组比较,差异均无统计学意义(P>0.05)。见表3。
2.4 相关性分析 经过Pearson相关分析,瘢痕癌中CyclinD1与 CDK4(r=0.798,P < 0.000 1)、p21 与CDK4(r=0.876,P <0.0001)的表达均呈正相关。
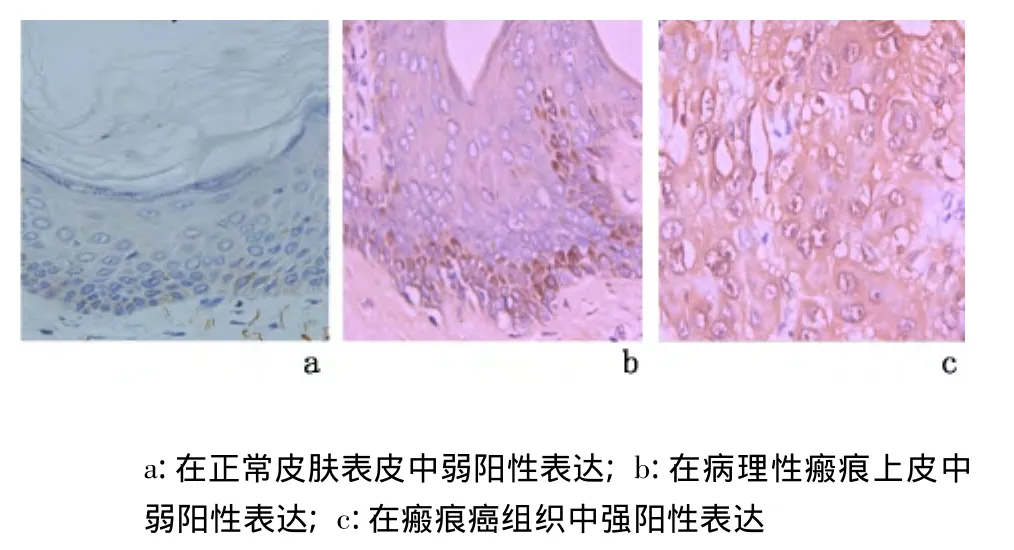
图1 各组皮肤组织中CDK4蛋白的表达(IHC ×400)Figure 1 The expression of CDK4 protein(IHC×400)
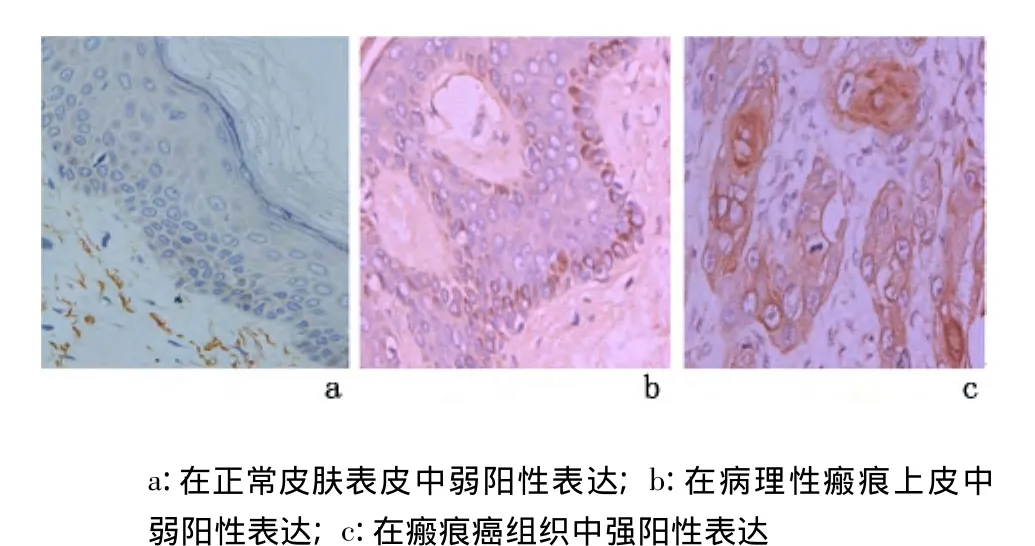
图2 各组皮肤组织中CDK4 mRNA的表达(ISH ×400)Figure 2 The expression of CDK4 mRNA(ISH×400)
表1 各组皮肤组织中CDK4蛋白及其mRNA的表达(±s)Table 1 The expression of CDK4 protein and CDK4 mRNA in different skin tissues(±s)
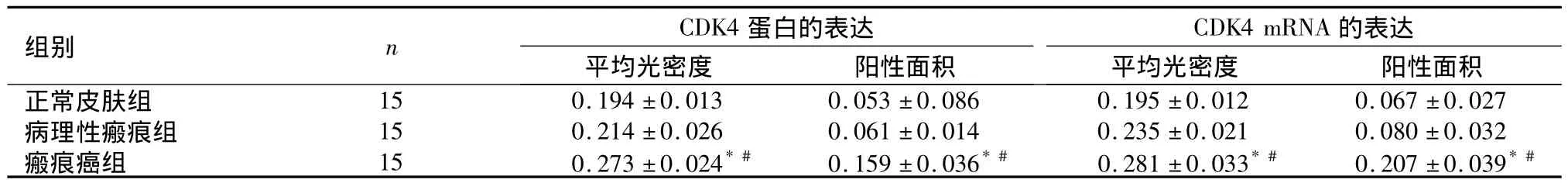
表1 各组皮肤组织中CDK4蛋白及其mRNA的表达(±s)Table 1 The expression of CDK4 protein and CDK4 mRNA in different skin tissues(±s)
与正常皮肤组比较,*P<0.01;与病理性瘢痕组比较,#P<0.01
组别 n CDK4蛋白的表达CDK4 mRNA 的表达平均光密度 阳性面积正常皮肤组 15 0.194 ±0.013 0.053 ±0.086 0.195 ±0.012 0.06平均光密度 阳性面积7 ±0.027病理性瘢痕组 15 0.214 ±0.026 0.061 ±0.014 0.235 ±0.021 0.080 ±0.032瘢痕癌组 15 0.273 ±0.024*# 0.159 ±0.036*# 0.281 ±0.033*# 0.207 ±0.039*#
表2 各组皮肤组织中CyclinD1蛋白及其mRNA的表达(±s)Table 2 The expression of CyclinD1 protein and mRNA in different skin tissues(±s)
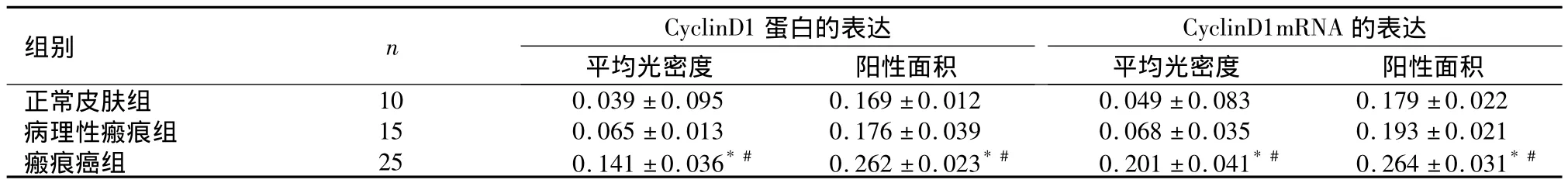
表2 各组皮肤组织中CyclinD1蛋白及其mRNA的表达(±s)Table 2 The expression of CyclinD1 protein and mRNA in different skin tissues(±s)
与正常皮肤组比较,*P<0.01;与病理性瘢痕组比较,#P<0.01
组别 n CyclinD1蛋白的表达CyclinD1mRNA 的表达平均光密度 阳性面积正常皮肤组 10 0.039 ±0.095 0.169 ±0.012 0.049 ±0.083 0.17平均光密度 阳性面积9 ±0.022病理性瘢痕组 15 0.065 ±0.013 0.176 ±0.039 0.068 ±0.035 0.193 ±0.021瘢痕癌组 25 0.141 ±0.036*# 0.262 ±0.023*# 0.201 ±0.041*# 0.264 ±0.031*#
表3 各组皮肤组织中p21蛋白及其mRNA的表达(±s)Table 3 The expression of p21 protein and p21 mRNA in different skin tissues(±s)
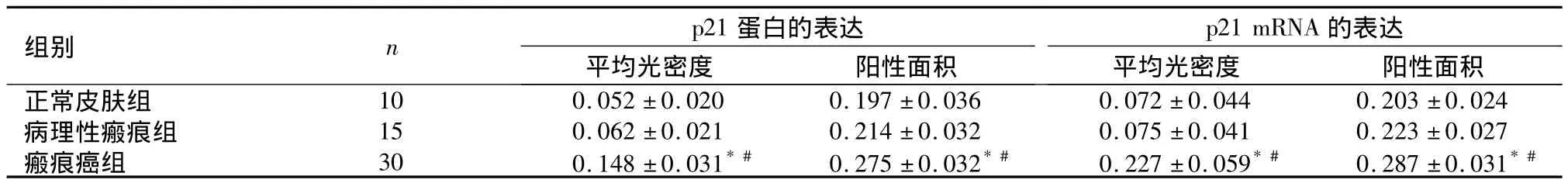
表3 各组皮肤组织中p21蛋白及其mRNA的表达(±s)Table 3 The expression of p21 protein and p21 mRNA in different skin tissues(±s)
与正常皮肤组比较,*P<0.01;与病理性瘢痕组比较,#P<0.01
组别 n p21蛋白的表达p21 mRNA 的表达平均光密度 阳性面积正常皮肤组 10 0.052 ±0.020 0.197 ±0.036 0.072 ±0.044 0.20平均光密度 阳性面积3 ±0.024病理性瘢痕组 15 0.062 ±0.021 0.214 ±0.032 0.075 ±0.041 0.223 ±0.027瘢痕癌组 30 0.148 ±0.031*# 0.275 ±0.032*# 0.227 ±0.059*# 0.287 ±0.031*#
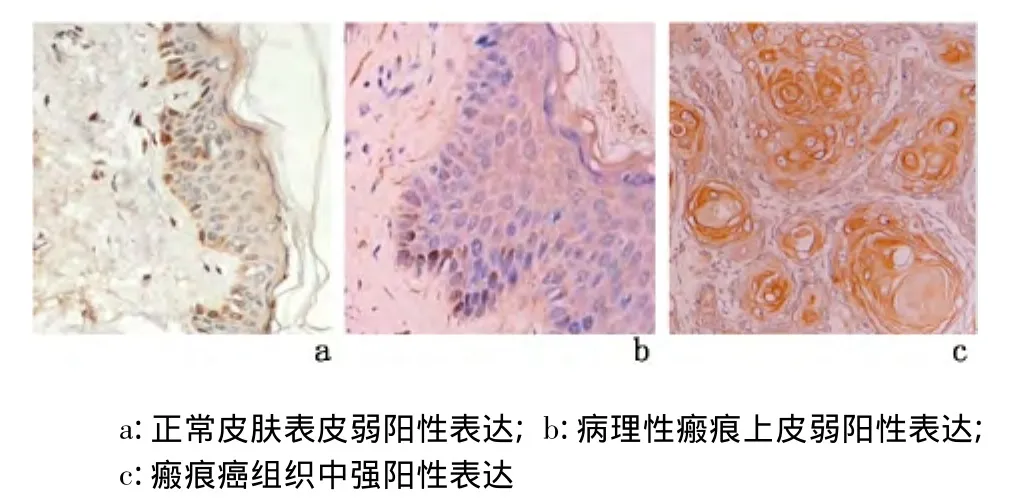
图3 各组皮肤组织中Cyclin D1蛋白的表达(IHC ×400)Figure 3 The expression of Cyclin D1 protein(IHC×400)
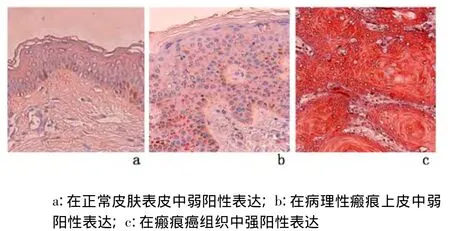
图4 各组皮肤组织中Cyclin D1 mRNA的表达 (ISH ×400)Figure 4 The expression of Cyclin D1 mRNA(ISH×400)
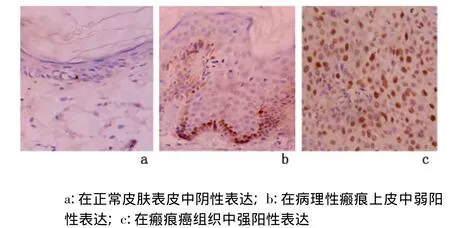
图5 各组皮肤组织中p21蛋白的表达(IHC ×400)Figure 5 The expression of p21 protein(IHC×400)
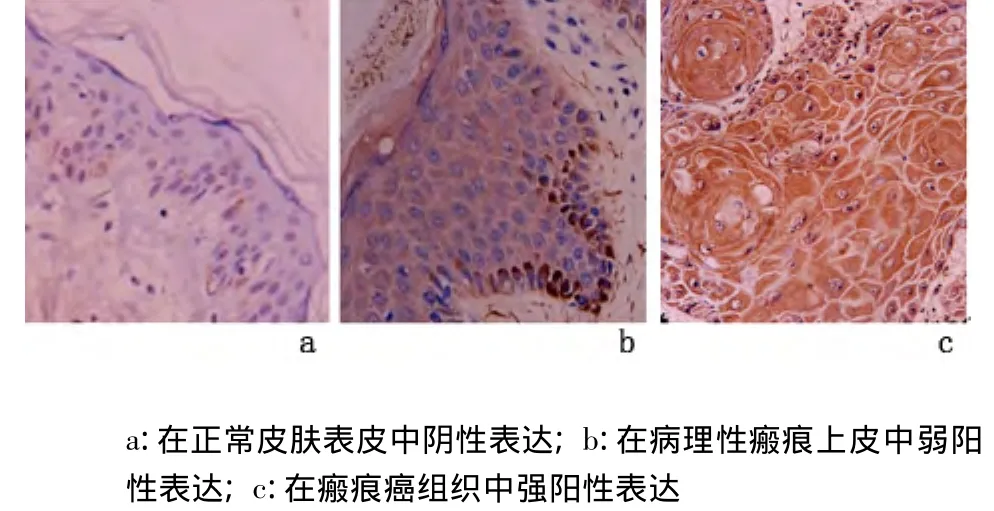
图6 各组皮肤组织中p21mRNA的表达(ISH ×400)Figure 6 The expression of p21mRNA(ISH×400)
3 讨 论
3.1 Cyclin D1与细胞周期调控 CyclinD是Ras-Raf-MAPK信号通路的下游靶基因,CyclinD的激活是细胞周期调控系统的始动环节。Cyclin D包括了D1、D2、D3 3种类型,对Cyclin D1目前研究较为深入,Cyclin D1在细胞周期的G1早期表达增加,它与细胞中CDK4或CDK6结合形成复合物,通过Cyclin D1/CDK4或CDK6通路使细胞越过G1调控点,是细胞G1期到S期重要的调控因子[4]。研究表明,Cyclin D1在正常细胞周期的控制和肿瘤的发生中均发挥重要作用,Cyclin D1的过表达可激活 CDK4、CDK6的活性,缩短G1期,降低细胞增殖对有丝分裂原的依赖,使细胞周期调节失控和细胞异常增生,导致肿瘤发生,故认为Cyclin D1的异常表达,与肿瘤的发生密切相关[5]。
3.2 瘢痕癌中Cyclin D1与CDK4的正调控作用Cyclins-CDKs-CKIs是真核细胞最重要的细胞周期调控系统,CDK是此系统的中心,Cyclin具有正性调控CDK的作用。在有生长因子的情况下,Cyclin D1在细胞周期中首先被合成,并于G1中期合成达到高峰,是G1期细胞增殖信号的关键蛋白质,CDK4/6蛋白的含量及活化程度在细胞增殖周期由G1向S期过渡过程中起限速作用[6-7],两者结合成复合物,促进细胞周期进程。其异常表达可致细胞增殖失控,肿瘤发生。有研究表明,黑色素瘤、前列腺癌、恶性淋巴瘤等肿瘤中有 CDK4或 CDK6的过表达,或有Cyclin D1和CDK4的同时过表达[8-9],这些研究提示CDK与Cyclin在肿瘤组织中的表达成正性调控关系,它们的高表达具有促癌作用。我们的研究表明,病理性Cyclin D1及其mRNA、CDK4及其mRNA在瘢痕癌组中均呈强阳性表达,其表达水平、表达强度明显高于正常皮肤组和病理性瘢痕组,说明在瘢痕癌中既有Cyclin D1的高表达,也有CDK4的高表达;既有蛋白水平的高表达也有分子水平的高表达。相关性分析:Cyclin D1与CDK4的表达均呈正相关关系(正向调控),提示在瘢痕癌中,在细胞周期G1/S期转换过程中,Cyclin D1并非是一个促进细胞周期的独立执行基因,它需要与CDK结合形成复合物而发挥作用,促进细胞增殖和分化。总言之,瘢痕癌中Cyclin D1与CDK4表现为一种正向调控,Cyclin D1可能是通过与CDK4结合形成复合物,促进细胞周期G1/S期转化,导致细胞异常增生,瘢痕癌发生。瘢痕癌有可能是一种细胞周期性疾病。
3.3 瘢痕癌中p21与CDK的负调控作用 p21作为CKI家族成员之一,是目前已知具有最广泛激酶抑制活性的细胞周期蛋白依赖性激酶抑制剂,具有抑癌作用。在细胞周期调控系统中p21为负性调控因子,通过对CDK起抑制作用,促进DNA的损伤修复,保证遗传信息的稳定性和准确性,同时与PCNA结合抑制DNA复制,抑制肿瘤的发生。一旦p21表达降低或消失,则失去对CDK及其复合物蛋白激酶活性的正常调节,影响细胞增殖与分化的调控,导致恶性肿瘤的发生。根据这一论点,我们认为p21在瘢痕癌组织中预期结果应该是呈低表达,与Cyclin-CDK的表达呈负相关(负向调控)。事实是:在瘢痕癌组织中p21蛋白及其mRNA呈强阳性表达,而且p21的表达与Cyclin D1、CDK4表达呈正相关关系,与瘢痕癌细胞增殖呈正向调控。这与预期结果不相吻合,分析其原因可能有:①有研究表明,p21在不同肿瘤组织如在胃癌、肺癌、鼻咽癌细胞株等恶性肿瘤中表现为缺失或表达下降,对肿瘤细胞增殖呈负向调控作用[10-11],而在皮肤鳞状细胞癌癌、食管鳞状细胞癌等恶性肿瘤中p21表现为高表达,对肿瘤细胞增殖的正向调控作用[12-13]。我们在瘢痕癌研究中也获得高表达的结果,提示 p21在肿瘤组织中的表达可能具有组织特异性,皮肤鳞状细胞癌、食管鳞状细胞癌和瘢痕癌的组织来源都与鳞状上皮有关,提示在这一类型肿瘤中,负向调控CDK的有可能是CKI家族的其它成员。②通过 siRNA技术封闭KLF6基因表达,可以导致Cyclin D1/CDK4蛋白的结合能力增加,提示Cyclin D1/CDK4复合物的活性还受到KLF6的调控。KLF6又称Kruppel样因子6,是一种肿瘤抑制基因产物,能与Cyclin D1连接,并降低Cyclin D1/CDK4复合物的活性[14],提示Cyclin D1-CDK4复合物活性的抑制调控可能还有CKI家族以外的其他抑制调控因子参与。③有研究报道,p21在肿瘤组织中的异常高表达,可能还应考虑p21与p53基因突变之间的关系,在胃癌细胞中p53基因无突变者p21高表达,而p53基因有突变者p21低表达[15],p21的表达呈 p53依赖性,其高表达可能与p53基因无突变有关。④p21除了具有抗凋亡的功能外,也具有促进凋亡的双重功能,Kralj等[16]用腺病毒载体导入外源性p21基因到4株肿瘤细胞中,结果p21过表达引起其中2株细胞凋亡的发生。说明p21具有促进凋亡的功能。本组瘢痕癌中p21高表达,是否发挥了促进细胞凋亡的作用,其确切关系有待进一步探讨。目前,由于p21在肿瘤细胞中的抗凋亡功能,使其在肿瘤发生、发展中的作用变得备受争议。综上所述,瘢痕癌中p21与CDK的负调控作用,有可能是由CKI家族的其他成员或者由CKI家族以外的其他抑制调控因子来执行,有待进一步探讨。
[1] Viallard JF,Lacombe F,Belloc F,et al.Molecular mechanisms controlling the cell cycle:fundamental aspects and implications for oncology[J].Cancer Radiother,2001,5(2):109-129.
[2] Nurse P.A long twentieth century of the cell cycle and beyond[J].Cell,2000,100(1):71-78.
[3] Liu WH,Kaur M,Wang G,et al.Inverse PCR-based RFLP scanning identifies low-level mutation signatures in colon cells and tumors[J].Cancer Res,2004,64(7):2544-2551.
[4] 胡成久,郭瑞珍.Ras基因及其信号转导通路与皮肤肿瘤关系[J].医学研究生学报,2012,25(7):771-773.
[5] 戴 颖,王安明,刘 琦.Wnt信号通路异常激活在卵巢上皮性癌中的作用[J].医学研究生学报,2012,25(3):312-314.
[6] Grimmler M,Wang Y,Mund T,et al.Cdk-inhibitory activity and stability of p27Kip1 are directly regulated by oncogenic tyrosine kinases[J].Cell,2007,128(2):269-280.
[7] Li W,Kotoshiba S,Berthet C,et al.Rb/Cdk2/Cdk4 triple mutant mice elicit an alternative mechanism for regulation of the G1/S transition[J].Proc Natl Acad Sci USA,2009,106(2):486-491.
[8] Gruber F,kastelan M,Braiac I,et al.Molecular and genetic mechanisms in melanoma[J].Coll Antropol,2008,32(2):147-152.
[9] Kim J,Park H,Im JY,et al.Sodium butyrate regulates androgen receptor expression and cell cycle arrest in human prostate Cancer cells[J].Anticancer Res,2007,27(5A):3285-3292.
[10] 彭 纲,陈 静,邹枕玮,等.SHP-1/P21/CDK6/CyclinD1在不同放射敏感度鼻咽癌细胞中的表达[J].肿瘤防治研究,2012,39(10):1193-1196.
[11] 丁焕然,姜广建,马小兵,等.肺癌组织中HSG、p21和PCNA的表达及意义[J].临床与实验病理学杂志,2009,25(2):147-150.
[12] 王宏伟,王秀丽,王椿森.p21、p53及PCNA在人皮肤基底细胞癌和鳞状细胞癌中的表达[J].中华皮肤科杂志,1998,31(6):380.
[13] 张 凡,彭 钧,李波凌.p21在食管鳞状细胞癌及食管鳞状上皮良性增生性病变中表达的临床意义[J].蚌埠医学院学报,2010,35(4):372-373,376.
[14] 王少平,亢黎莉,陈孝平,等.KLF6在肝细胞癌中的表达缺失及对肝癌细胞增殖的影响[J].中华肝胆外科杂志,2011,17(2):132-137.
[15] 张春林,廖威明,李佛保.细胞周期调控基因p21WAF1/CIPI与肿瘤[J].肿瘤研究与临床,2002,14(2):134-141.
[16] Kralj M,Husnjak K,Körbler T,et al.Endogenous p21WAF1/CIP1 status predicts the response of human tumor cells to wild-type p53 and p21WAF1/CIP1 overexpression[J].Cancer Gene Ther,2003,10(6):457-467.

