环磷酰胺体内干预对肾上腺皮质癌细胞ABCG2表达的影响
陈小舟,罗佐杰,邝晓聪,秦映芬,曾文清,黄振兴,覃 苑,吴峰萍
0 引 言
三磷酸腺苷结合转运蛋白G家族成员2(ATP-binding cassette super family G member 2,ABCG2)是能够将具有不同化学结构和作用于细胞内不同靶点的化疗药物泵出细胞外,从而介导多种肿瘤的多药耐药。肾上腺皮质癌是恶性程度极高的肿瘤,对多种化疗药物不敏感,而ABCG2与肾上腺疾病关系的研究报道尚不多见。本研究通过建立环磷酰胺体内干预裸鼠移植瘤模型,探讨药物干预对肾上腺皮质癌细胞ABCG2表达的影响,以期了解ABCG2在肾上腺皮质癌耐药中的可能作用机制。
1 材料与方法
1.1 细胞株和裸鼠 人肾上腺皮质癌细胞株SW-13,购自中国科学院上海生命科学研究所。选用4~6周龄、体重为18~22 g的BALB/C-nu裸鼠10只,雌雄不拘,购自广西医科大学实验动物中心,实验动物合格证号:SCXK桂2003-00。裸鼠饲养在SPF级超净层流架内,保持温度22℃ ~24℃、湿度45%~50%,笼具、垫料及饲料、饮水均以高压蒸汽灭菌。将10只裸鼠随机列表法分为环磷酰胺组和对照组(注射等渗盐水),每组5只。
1.2 主要试剂和设备 DMEM/F12培养基(Hyclone公司),胎牛血清(FBS,Hyclone 公司),胰蛋白酶粉(mresco公司),环磷酰胺(山西普德药业公司),鼠抗人ABCG2(Bioword公司),二抗通用型试剂盒、DAB试剂盒(中杉金桥公司),PerCP-CyTM5.5 Mouse anti-human CD338(ABCG2)和 PerCPCyTM5.5 Mouse IgG2b,κIsotype Control(美国 Becton Dickinson公司),恒温CO2培养箱(日本SANYO公司),流式细胞仪(美国Becton Dickinson公司);普通光学显微镜(日本Nikon公司)。
1.3 方法
1.3.1 细胞培养 SW-13细胞株培养于含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM/F12培养基中,并置于37℃、5%CO2饱和湿度条件下培养。
1.3.2 裸鼠移植瘤模型建立及药物干预 参照蒋莉等[1]建立的方法,将处于对数生长期SW-13细胞密度调整为1×107/mL,以0.2 mL/侧剂量注射入裸鼠两侧腋窝皮下,待瘤体长至可触及时,环磷酰胺组腹腔注射环磷酰胺10 mg/kg,1次/d,连续3 d,对照组注射同等剂量等渗盐水。3周后处死裸鼠,取出肿瘤进行原代培养。
1.3.3 原代培养 将取出的新鲜瘤体组织剪碎至1 mm3大小,胶原酶Ⅲ(200~250U/mL)及0.25%胰酶消化后用200目滤网过滤,800 r/min离心5 min(离心半径5.25 cm)、DMEM/F12培养基重悬后种入培养瓶中,并连续传3~5代。
1.3.4 流式细胞术 取对数生长期环磷酰胺组和对照组细胞,将其消化成单细胞悬液,调整细胞密度至1×106/mL后分别移入2个EP管中,每管体积为 100 μL,其中一管加入 5 μL 同型对照(PerCPCyTM5.5 Mouse IgG2b,κIsotype Control)作为对照管,另一管加入5 μL ABCG2荧光抗体(PerCP-CyTM5.5 Mouse anti-human CD338)为样本管,避光,室温孵育30 min,上流式细胞仪检测。
1.3.5 免疫组化检测法 裸鼠皮下移植瘤组织固定、包埋、制成5 μm切片,经脱蜡水化后柠檬酸盐高压修复,3%H2O2孵育阻断内源性过氧化物酶,加入鼠抗人ABCG2一抗,4℃孵育过夜,加入二抗孵育,DAB显色,苏木精复染,脱水,封固。用已知阳性片作为阳性对照,以PBS代替一抗作阴性对照。高倍镜下选取5个视野,计数1000个细胞,阳性肿瘤细胞占所有肿瘤细胞的百分比<10%者为阴性,≥10%为阳性。
1.4 统计学分析 采用SPSS 16.0软件进行统计分析,实验数据以均数±标准差()表示,两样本均数的比较采用t检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 裸鼠移植瘤模型的建立 皮下注射SW-13细胞8~9 d,裸鼠两侧腋窝可触及3 mm大小肿块,成瘤率为100%。腹腔环磷酰胺干预3周后肿瘤直径达1.5cm,对照组直径可达2cm。肿瘤边界清楚,包膜完整,分叶呈结节状。见图1。
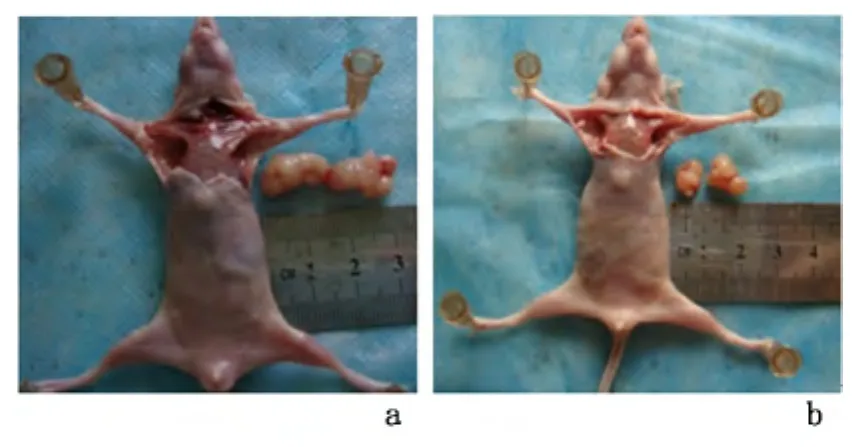
图1 裸鼠环磷酰胺干预后皮下移植瘤情况Figure 1 Subcutaneous transplantation tumor after CTX intervention
2.2 流式细胞术检测原代培养细胞ABCG2的表达水平 流式细胞术检测结果显示,ABCG2在环磷酰胺组肿瘤细胞中的表达率[(97.89±1.36)%]高于对照组[(81.88±8.31)%],差异有统计学意义(t=3.290,P=0.030)。见图 2。
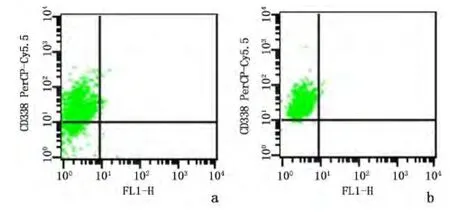
图2 ABCG2(CD338)在原代培养细胞中的表达Figure 2 Expression of ABCG2(CD338)in the primarie cultured cells
2.3 免疫组化检测法检测ABCG2在裸鼠移植瘤组织中的表达 移植瘤组织中可见异型性肿瘤细胞,核大小不一,核分裂像多见。ABCG2阳性细胞细胞质和细胞膜呈棕黄或棕褐色颗粒。ABCG2在环磷酰胺组裸鼠移植瘤组织中的表达阳性率[(69.1±1.83)%]高于对照组[(53.4 ±1.65)%],差异有统计学意义(t=14.191,P=0.000)。见图3。
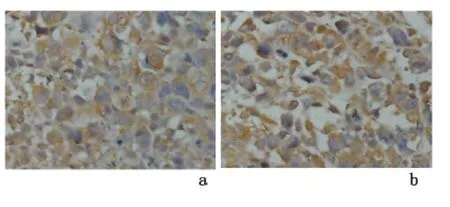
图3 ABCG2在移植瘤组织中的表达(SP×400)Figure 3 Expression of ABCG2 in transplantation tumors(SP×400)
3 讨 论
ABCG2首次发现于乳腺癌耐药细胞系MCF-7/Adr-Vp3000,故又称为乳腺癌耐药蛋白[2]。随着研究的深入,发现ABCG2在胰腺癌、非小细胞肺癌、神经胶质瘤、胃癌、结肠癌等多种肿瘤组织和细胞中亦有表达[3-7]。ABCG2具有结合和水解 ATP 的能力,并利用其提供的能量主动把不同化学结构和作用于细胞内不同靶位点的化疗药物(包括蒽环类、长春花生物碱类、紫衫烷类和拓扑异构酶抑制剂等)从细胞内泵出,从而使肿瘤对多种抗癌药物产生抗性。
ABCG2转运蛋白的表达水平及功能的发挥受多种因素的影响。有研究证明表皮生长因子能通过ERK1/2和JNK/SAPK信号途径使ABCG2表达增加,导致对米托蒽醌和拓扑替康的耐药性增加[8]。研究表明,通过采用逐步增加体内多西他赛浓度的方法可选择出高表达ABCG2转运蛋白的耐药细胞系(SPC-A1/Docetaxel)[9]。Calcagno 等[10]采用多柔比星单步法和长程法治疗可使ABCG2蛋白表达增加,进一步研究发现,化疗药物通过使ABCG2基因启动子区域发生甲基化,引起ABCG2转录因子上调。因而,ABCG2蛋白表达增多,细胞内有效化疗药物被泵出,随后肿瘤细胞产生多药耐药。Turner等[11]研究表明ABCG2与多发性骨髓瘤患者多药耐药性及预后存在相关性。近年来,药物体内干预裸鼠移植瘤模型已成为新的耐药模型被广泛运用于多种肿瘤耐药机制的研究[12-14],其较体外耐药模型更好地说明临床耐药机制的形成。本研究通过建立肾上腺皮质癌SW-13细胞裸鼠皮下移植瘤模型,并予环磷酰胺腹腔注射干预,使肿瘤暴露于化疗药物作用环境。流式检测结果发现,ABCG2在环磷酰胺组肿瘤细胞中的表达阳性率高于对照组。免疫组化结果进一步证实环磷酰胺干预后移植瘤组织ABCG2的表达增加。以上结果提示,ABCG2很可能参与肾上腺皮质癌耐药。由于化疗的作用杀死ABCG2阴性表达即不具备耐药能力的肿瘤细胞,而在药物治疗的间隙存活的肿瘤细胞使其子代细胞不断增殖,表达ABCG2的细胞增多,进而行使其“药物泵”功能,导致肿瘤获得性耐药的形成。此外,本研究发现,ABCG2在对照组裸鼠移植瘤组织及原代培养的细胞亦有较高的表达,其高表达可能为肾上腺皮质癌原发性高度耐药的原因。ABCG2可能为肾上腺皮质癌的干预靶点,但ABCG2参与肾上腺皮质癌耐药相关机制仍需进一步研究。
[1]蒋 莉,罗佐杰,邝晓聪,等.人肾上腺皮质癌细胞株裸鼠移植瘤模型的建立及其意义[J].重庆医学,2010,39(11):1334-1335.
[2]Doyle LA,Yang W,Abruzzo LV,et al.A multidrug resistance transporter from human MCF-7 breast cancer cells[J].Proc Natl Acad Sci USA,1998,95(26):15665-15670.
[3]Hamada S,Satoh K,Hirota M,et al.The homeobox gene MSX2 determines chemosensitivity of pancreatic cancer cells via the regulation of transporter gene ABCG2[J].J Cell Physiol,2012,227(2):729-738.
[4]Hegedus C,Truta-Feles K,Antalffy G,et al.Interaction of the EGFR inhibitors gefitinib,vandetanib,pelitinib and neratinib with the ABCG2 multidrug transporter:implications for the emergence and reversal of cancer drug resistance[J].Biochem Pharmacol,2012,84(3):260-267.
[5]Jin Y,Bin ZQ,Liang C,et al.ABCG2 is related with the grade of glioma and resistance to mitoxantone,a chemotherapeutic drug for glioma[J].J Cancer Res Clin Oncol,2009,135(10):1369-1376.
[6]Jiang Y,He Y,Li H,et al.Expressions of putative cancer stem cell markers ABCB1,ABCG2,and CD133 are correlated with the degree of differentiation of gastric cancer[J].Gastric Cancer,2012,15(4):440-450.
[7]Shen WW,Zeng Z,Zhu WX,et al.MiR-142-3p functions as a tumor suppressor by targeting CD133,ABCG2,and Lgr5 in colon cancer cells[J].J Mol Med(Berl),2013,91(8):989-1000.
[8]Meyer zu Schwabedissen HE,Grube M,Dreisbach A,et al.Epidermal growth factor-mediated activation of the map kinasa cascade results in altered expression and function of ABCG2(BCRP)[J].Drug Metab Dispos,2006,34(4):524-533.
[9]朱言亮,陈龙邦,王靖华,等.ABC转运蛋白在SPC-A1细胞系中SP细胞多药耐药机制的研究[J].医学研究生学报,2009,22(7):692-700.
[10]Calcagno AM,Fostei JM,To KK,et al.Single step doxorubicinselected cancer cells overexpress the ABCG2 drug transporter through epigenetie changes[J].Br J Cancer,2008,98(9):1515-1524.
[11]Turner JG,Gump JL,Zhang C,et al.ABCG2 expression,function and promoter methylation in human multiple myeloma[J].Blood,2006,108:3881-3889.
[12]曹 渊,惠璐璐,秦 蓉,等.白血病多药耐药裸鼠荷瘤模型的建立[J].西安交通大学学报(医学版),2013,34(3):302-307.
[13]徐小方,刘 斌,吴军正,等.人黏液表皮样癌裸鼠耐药移植瘤模型的建立及其生物学特性[J].实用口腔医学杂志,2010,26(2):177-180.
[14]Cohen SM,Rockefeller N,Mukerji R,et al.Efficacy and toxicity of peritumoral delivery of nanoconjugated cisplatin in an in vivo murine model of head and neck squamous cell carcinoma[J].JAMA Otolaryngol Head Neck Surg,2013,139(4):382-387.

