实验性肺纤维化小鼠循环单核细胞亚群的动态变化及意义
马永强,姬文婕,郑春秀,张译丹,彭守春,胡道川,陈雪芬,周 欣,魏路清
0 引 言
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是慢性进行性纤维化型间质性肺炎,病程不可逆且预后极差,近年来IPF的发病率呈上升趋势[1-2]。目前其具体发病机制尚不清楚,但炎症和免疫机制的观点仍发挥重要作用[3]。单核细胞作为机体固有免疫细胞,在炎症及免疫反应中扮演重要角色。小鼠主要存在2种循环单核细胞亚群,分别为Ly6ChiCCR2+CX3CR1-和 Ly6CloCCR2-CX3CR1+亚群,Ly6Chi单核细胞为炎症性亚群[4]。单核细胞亚群的变化与疾病发展阶段有密切关系[5],本研究以博莱霉素诱导小鼠肺纤维化为模型,阐述在早期炎症和后期纤维化病理进程中,不同单核细胞亚群比例的变化特点,分析Ly6Chi单核细胞比例变化与早期炎症反应程度和后期纤维化指标的相关性,从而探讨单核细胞表型偏移在肺纤维化发病过程中的作用及意义,为肺纤维化的基础和临床研究提供初步的实验依据。
1 材料与方法
1.1 材料 健康SPF级C57BL/6J小鼠,雄性,6~8周龄(16~18g),购自解放军军事医学科学院实验动物中心,许可证号:SCXK-(军)2012-0004。小鼠在光照良好、通风、温度和湿度适宜的清洁级动物室内常规饲养。注射用盐酸平阳霉素(天津太河制药有限公司),Fluorescein isothiocyanate(FITC)anti-mouse Ly6C抗体、Phycoerythrin(PE)anti-mouse CD11b抗体(Biolegend公司),FITC anti-Rat IgG2c抗体,PE anti-Rat IgG2b抗体,RNAiso Plus(TaKaRa),M-MLV逆转录酶、dNTPs、Rnasin Inhibitor(Promega 公 司),SYBR Green Master(Roche公司),羟脯氨酸试剂盒(南京建成),其他试剂均为国产分析纯。
1.2 方法
1.2.1 动物模型的制备和标本的采集 100只雄性C57BL/6J小鼠按随机数字列表法分为博莱霉素组和等渗盐水组,每组50只。参照Lakatos等[6]经口咽吸入法制备肺纤维化模型,博莱霉素组小鼠缓慢注入40 μL博莱霉素A5(2 mg/kg),等渗盐水组小鼠注入相同体积无菌等渗盐水。分别于术后第1、3、7、14和21天,轻度麻醉后,放血处死,EDTA 抗凝血并进行流式细胞术检测;采集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)并进行细胞计数和分类;未灌洗小鼠右肺用于检测胶原Ⅰ、Ⅲ的mRNA表达水平,左肺行病理学检测;灌洗小鼠肺组织用于羟脯氨酸(hydroxyproline,HYP)含量的测定。
1.2.2 小鼠肺组织病理学检测 肺组织在真空负压条件下(15~20英寸汞柱,1英寸汞柱=3.386kPa)经4%多聚甲醛(pH 7.2 ~7.4)固定 24 h,常规脱水、透明、浸蜡及包埋,切片厚度为5 μm。按常规方法进行HE染色和Masson染色。参照Szapiel等[7]方法进行炎症评分,每只小鼠选取3张连续切片,10×10倍观察5个视野,避开大的支气管和血管进行评分,0分:正常组织,1分:炎性细胞浸润面积占肺组织面积比例<20%,2分:比例为20% ~50%,3分:比例 >50%。取其平均值作为炎症评分,代表肺组织的炎症程度。采用Image-Pro Plus 6.0软件对肺间质纤维化程度进行分析,胶原容积分数(collagen volume fraction,CVF)代表肺纤维化程度,计算公式如下:
CVF=胶原面积/(图像总面积-空白区域面积)
1.2.3 支气管肺泡灌洗液细胞计数和分类 BALF常规离心、重悬细胞,通过Count Star自动细胞计数仪计算细胞总数;常规甩片、固定及HE染色,光学显微镜(Nikon E600POL)下观察,计数200个细胞,计算巨噬细胞、淋巴细胞、中性粒细胞及嗜酸性粒细胞比例。
1.2.4 小鼠肺组织胶原Ⅰ、ⅢmRNA水平检测 液氮研磨肺组织,Trizol法提取肺组织总RNA,甲醛变性电泳法检测RNA完整性,逆转录为cDNA,SYBR Green法进行实时定量PCR反应,引物如下:胶原I(正义链:5'-CATGTTCAGCTTTGTGGACCT-3',反义链:5'-GCAGCTGACTTCAGGGATGT-3'),扩增产物长度为 94 bp。胶原Ⅲ(正义链:5'-TCCCCTGGAATCTGTGAATC-3',反义链:5'-TGAGTCGAATTGGGGAGAAT-3'),扩增产物长度为63 bp。β-actin(正义链:5'-CTAAGGCCAACCGTGAAAAG-3',反义链:5'-ACCAGAGGCATACAGGGACA-3'),扩增产物长度为104 bp。以上引物均由北京鼎国生物技术有限公司合成。用2-ΔΔCt法对结果进行分析。
1.2.5 小鼠肺组织HYP含量测定 小鼠肺组织称重,制备成组织匀浆,按照试剂盒说明书酸水解法水解肺组织,氯胺T法测定肺组织HYP含量。
1.2.6 流式细胞术检测小鼠循环单核细胞亚群比例新鲜 EDTA 抗凝血 100 μL 加入 0.25 μg FITC antimouse Ly6C和0.25μg PE anti-mouse CD11b抗体混匀,用相同体积的FITC anti-Rat IgG2c抗体及PE anti-Rat IgG2b抗体设置同型对照;室温避光孵育15 min;加入红细胞裂解液,混匀后避光静置10 min,流式细胞仪检测。流式细胞仪分析时的设门策略:首先在FSC-SSC散点图中,选定SSClo群,然后识别FSC/CD11b+细胞,最后根据该群Ly6C荧光强度划分为Ly6Chi和Ly6Clo。
1.3 统计学分析 采用GraphPad Prism 5.0软件进行统计分析。所有定量资料采用均数±标准差()表示,计量资料满足正态性及方差齐性,组间均数的比较采用单因素方差分析及SNK法两两比较。不满足正态性或方差齐性,以中位数、四分位间距描述原始数据,并采用非参数秩和Mann-Whitney检验。相关性采用Pearson相关分析,以P≤0.05为有统计学意义。
2 结 果
2.1 各组小鼠肺组织病理学变化 等渗盐水组小鼠肺组织HE染色均未见明显炎性细胞浸润,肺泡间隔基本正常,肺泡结构无破坏。而博莱霉素组第3天开始出现明显炎症反应,肺泡间隔增厚,第7天炎症反应加重,可见大量炎性细胞浸润,肺泡间隔明显增厚,炎症评分为(2.53±0.08)分,而后炎性细胞浸润减少,出现成纤维细胞增生和胶原沉积。Masson染色结果显示,等渗盐水组各时间点均未见明显胶原沉积。而博莱霉素组第7天出现少量蓝染的胶原纤维,第14天胶原纤维含量明显增多,后胶原沉积持续加重,直至第21天,可见大量致密的蓝色胶原纤维。见图1。
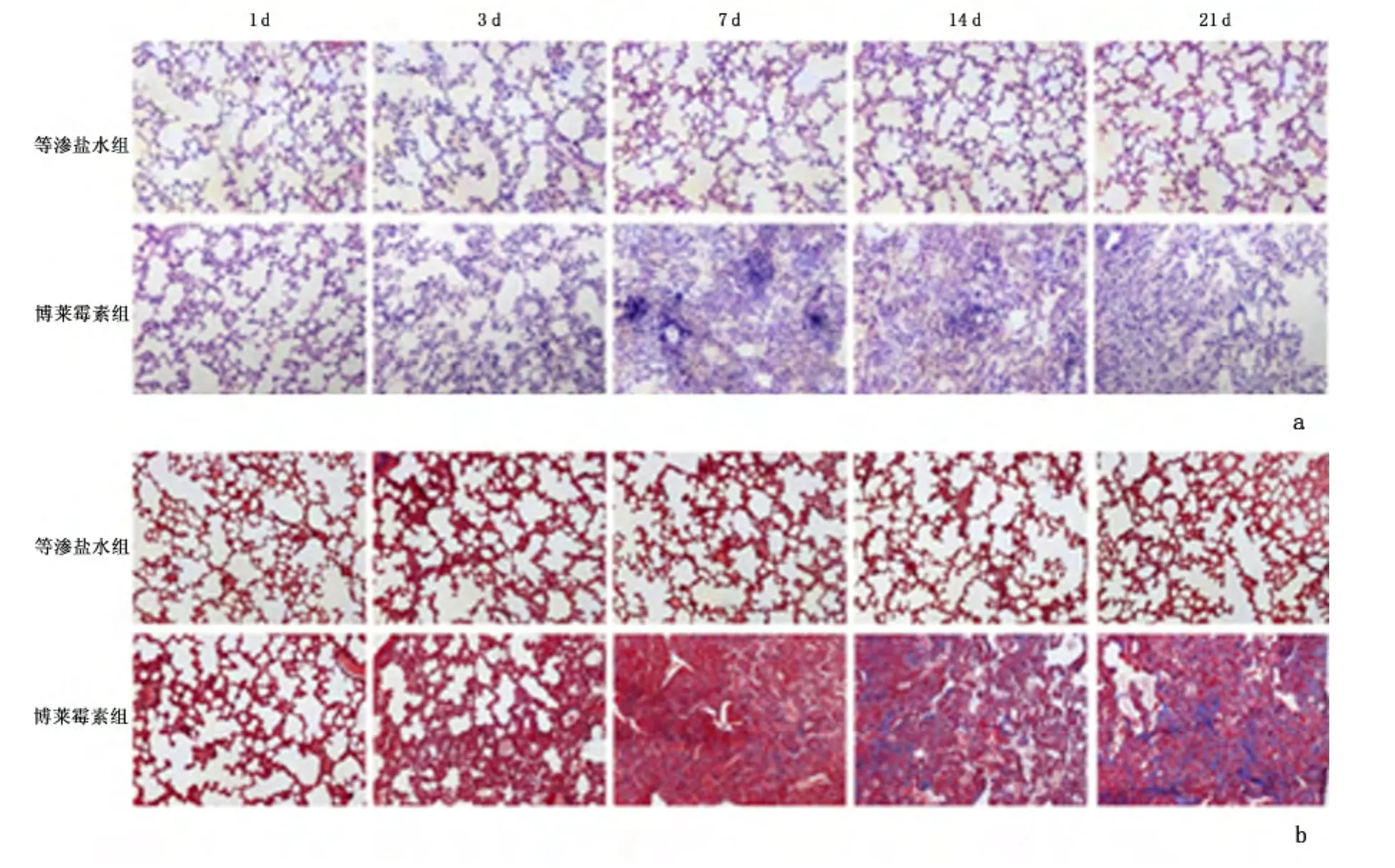
图1 各组小鼠不同时间点肺组织病理染色结果Figure 1 Results of pathological staining of the mouse lung tissue at different times
2.2 各组小鼠支气管肺泡灌洗液细胞总数和分类计数结果 等渗盐水组不同时间点BALF细胞总数和分类计数相比,差异无统计学意义(P>0.05)。与等渗盐水组相应时间点比较,博莱霉素组BALF细胞总数第3 天明显增多(25.18 ±2.06 vs 8.82 ±1.59,P <0.01),第7 天升至高峰(56.56 ±5.03 vs 3.68 ±0.79,P<0.01),后呈下降趋势,第14、21天细胞总数仍高于等渗盐水组(P<0.01);肺泡巨噬细胞比例的变化趋势与细胞总数相一致;与等渗盐水组相比,博莱霉素组中性粒细胞总数第1、3、7天显著高于等渗盐水组(9.086 ±1.268 vs 1.108 ±0.229、5.551 ±0.511 vs 0.315 ±0.100、8.093 ±0.922 vs 0.249 ±0.074),差异有统计学意义(P<0.01),而后呈下降趋势,第14、21天中性粒细胞数与等渗盐水组相比,差异无统计学意义(P >0.05)。见图2。
2.3 各组小鼠肺组织胶原Ⅰ、Ⅲ mRNA表达水平的变化 与等渗盐水组相比,博莱霉素组第14天和第21天胶原Ⅰ、ⅢmRNA相对表达水平显著升高,差异有统计学意义(P<0.05)。见图2。
2.4 各组小鼠肺组织HYP含量的变化 等渗盐水组不同时间点HYP含量相比较,差异无统计学意义(P>0.05)。与各组小鼠肺组织Masson染色胶原容积分数计算结果相一致,与等渗盐水组相比,博莱霉素组第7、14、21天HYP含量均升高,差异有统计学意义(P<0.01)。博莱霉素组内两两比较,差异有统计学意义(P <0.01)。
2.5 各组小鼠不同单核细胞亚群比例的变化 循环Ly6Chi单核细胞比例在博莱霉素致肺损伤后迅速升高,出现高峰时间(第3天)早于肺间质炎性细胞浸润及BALF细胞总数达到峰值的时间(第7天),在纤维化进展期Ly6Chi单核细胞比例较早期明显降低。与等渗盐水组比较,给予C57BL/6J小鼠博莱霉素干预后第1天Ly6Chi单核细胞比例明显升高(P<0.01),第3天达到高峰(P<0.01),而后逐渐下降,但第7、21天仍高于等渗盐水组(P<0.05)。博莱霉素组Ly6Clo单核细胞亚群比例变化与Ly6Chi变化趋势相反。等渗盐水组小鼠循环单核细胞Ly6Chi亚群比例占优势,不同时间点等渗盐水组小鼠循环单核细胞亚群比例变化幅度小,差异无统计学意义。见图3。
2.6 Ly6Chi单核细胞亚群与炎症和纤维化指标的相关关系 博莱霉素干预后,循环Ly6Chi单核细胞表现为快反应细胞群,第1天迅速升高,在炎症反应期维持较高水平。我们将各组小鼠Ly6Chi单核细胞比例分别与肺组织IS和CVF进行相关性分析,Ly6Chi亚群细胞比例变化与IS及CVF值均呈明显正相关(分别为 r=0.636,P <0.01;r=0.443,P=0.0013)。根据以上结果得知,博莱霉素组Ly6Chi的比例在第3 d达到峰值,而肺组织IS和CVF值分别于第7、21天最高,因此,将前者与后两者分别进行相关分析显示,Ly6Chi(3天)比例与IS(7天)呈明显正相关(r=0.934,P <0.01),Ly6Chi(3 天)比例与 CVF(21 天)呈明显正相关(r=0.983,P <0.01)。见图3。
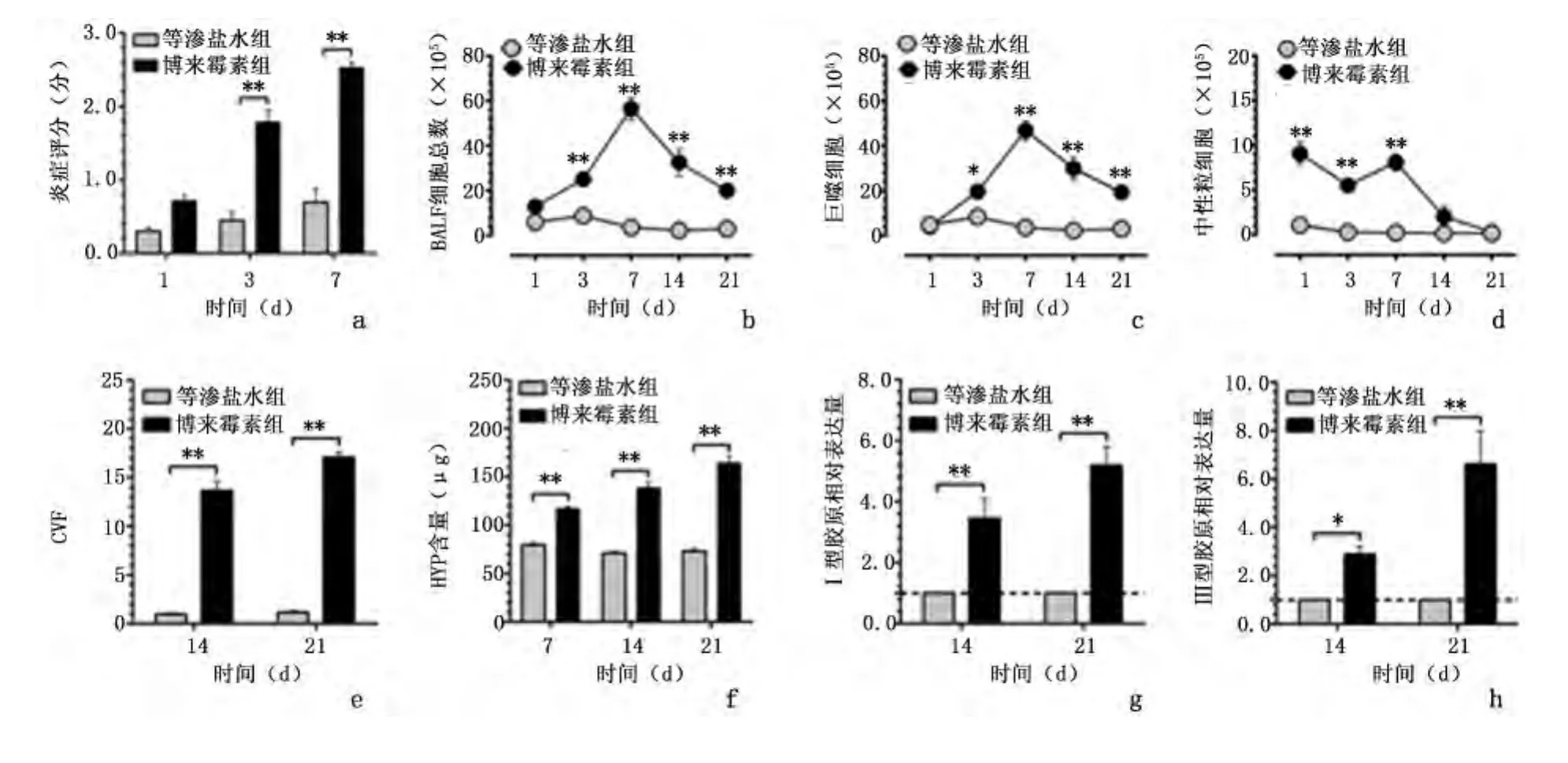
图2 各组小鼠不同时间点肺组织炎症评分、BALF细胞计数及肺纤维化不同指标变化结果Figure 2 Inflammation score,cell count in the BALF and changes of pulmonary fibrosis markers in the normal saline(NS)and bleomycin(BLM)groups at different times
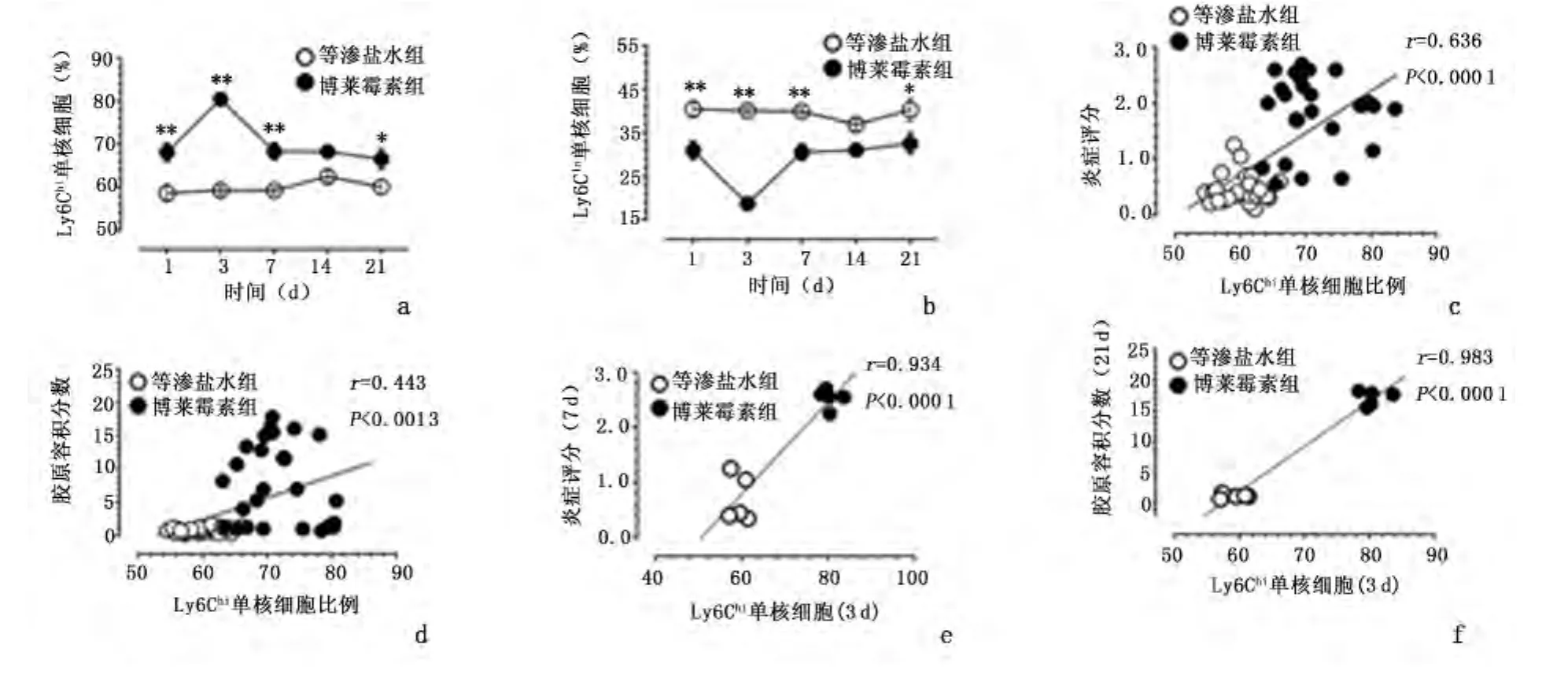
图3 流式细胞术检测各组小鼠不同时间点单核细胞亚群比例的变化及Ly6Chi亚群比例与炎症评分、胶原容积分数的相关性分析Figure 3 Monocyte subsets detected by flow cytometry and correlation of the percentage of Ly6Chimonocytes,with inflammation score and collage volume fraction in the normal saline(NS)and bleomycin(BLM)groups
3 讨 论
IPF是弥漫性肺间质纤维化中最常见的、致死性最高的一种。由于其发病过程的自身特点,很难找到有效的预防和治疗方法[8]。近年来,国内外学者从细胞因子水平干预及免疫调节等方面对博莱霉素致纤维化的发病机制进行了广泛探索,然而肺纤维化的确切发病机制尚未完全阐明[3,9]。大量研究表明炎症反应的异常调节在肺纤维化的发生发展中起至关重要的作用,目前IPF仍被认为是一种肺实质慢性炎症性疾病[3,10]。
循环单核细胞广泛参与了机体炎症反应、防御和组织重塑等过程。外周血中成熟单核细胞形态存在异质性,不同单核细胞亚群反映了具有不同生理功能的发展阶段[5]。人和小鼠血中存在2种主要的单核细胞亚群,并且有一定的相似性[11],在小鼠中一种为Ly6ChiCCR2+CD62L+CX3CR1low,因早期招募至炎症区域而被认为是促炎症表型,另一种Ly6CloCCR2-CD62L-CX3CR1hi亚群发挥巡察功能,并且可以补充组织固有巨噬细胞[12]。Ly6Chi单核细胞亚群的动态变化与炎症反应的不同阶段关系密切,有研究报道,小鼠体内C-C趋化因子水平的升高,促进了循环及二级淋巴组织中Ly6Chi单核细胞亚群比例选择性增高,在小鼠实验性肺纤维化模型中,纤维化进展期消除以Ly6Chi为主的循环单核细胞能够减轻纤维化程度[4,13]。
博莱霉素经口咽吸入途径作用于肺,循环中Ly6Chi单核细胞比例第1天明显升高,第3天达到最高点随后呈现下降趋势。与此相伴行,博莱霉素干预第3天,病理学结果证实肺间质炎性细胞的浸润、肺泡壁水肿等炎症表现,在第7天时最为显著,肺泡灌洗液的分类计数结果与肺组织病理检测相一致。Ly6Chi单核细胞比例的变化与炎症反应(以IS半定量法评价)呈明显正相关。而病理学方法、蛋白及核酸水平的检测表明,在博莱霉素干预后的不同时间点细胞外基质沉积程度在第21天达到最高。Ly6Chi单核细胞与后期纤维化指标存在明显的相关关系。炎症过程中,单核细胞在组织局部浸润并分化的巨噬细胞至少存在2种功能互补的亚群[14]。第1种由典型单核细胞(Ly6Chi亚群)分化产生,表现为典型活化状态(M1表型),第2种由非典型单核细胞(Ly6Clo亚群)分化而来,表现为替代活化状态(M2表型)。目前认为M1型巨噬细胞介导过度炎症反应、细胞外基质的破坏与肺纤维化的不良预后有关,M2型巨噬细胞以旁分泌的形式引起成纤维细胞细胞过度增殖、细胞外基质重塑及血管生成[15],研究证明,在啮齿类动物博莱霉素模型中,肺巨噬细胞被认为 TGF-β 的主要来源细胞[4],而TGF-β作为一种主要的促纤维化分子,其在不同器官纤维化病理过程中的作用机制较为明确[16-17]。此外,肺组织巨噬细胞来源的多种趋化因子(如IL-8,CXCL10,CCL5 等)、炎症因子(IL-1β、TNF-α、IL-6)等细胞因子及其与不同炎性细胞之间的共同作用,引起肺间质纤维细胞的过度增殖、细胞外基质沉积,逐渐发展为不可逆的肺间质纤维化。我们的实验结果与目前Ly6Chi单核细胞亚群在炎症调节中重要作用的结论相一致,但与博莱霉素诱导肺损伤中,炎症早期消除以Ly6Chi亚群为主的循环单核细胞对随后的纤维化进展无明显影响的观点不同[4,13],我们的结果表明,与肺组织炎症细胞渗出、浸润等病理进程相比,Ly6Chi单核细胞亚群应对肺组织损伤早期迅速升高,且该亚群单核细胞数量的增加与肺组织炎症及后期纤维化评分呈明显正相关。综上所述,在博莱霉素A5诱导的小鼠肺纤维化模型中,不同病理生理阶段外周血中 Ly6Chi、Ly6Clo单核细胞亚群比例处于动态变化,早期Ly6Chi单核细胞亚群比例的升高可能与肺组织炎症反应及后期纤维化程度存在密切的联系。进一步的研究将明确肺纤维化模型中循环及外周组织单核吞噬细胞功能表型的变化特点及相关关系,探讨以单核吞噬细胞系统为靶点干预肺纤维化的治疗策略。
[1]Raghu G,Collard HR,Egan JJ,et al.An official ATS/ERS/JRS/ALAT statement:idiopathic pulmonary fibrosis:evidencebased guidelines for diagnosis and management[J].Am J Respir Crit Care Med,2011,183(6):788-824.
[2]Nalysnyk L,Cid-Ruzafa J,Rotella P,et al.Incidence and prevalence of idiopathic pulmonary fibrosis:review of the literature[J].Eur Respir Rev,2012,21(126):355-361.
[3]Todd NW,Luzina IG,Atamas SP.Molecular and cellular mechanisms of pulmonary fibrosis[J].Fibrogenesis Tissue Repair,2012,5(1):11.
[4]Gibbons MA,MacKinnon AC,Ramachandran P,et al.Ly6Chi monocytes direct alternatively activated profibrotic macrophage regulation of lung fibrosis[J].Am J Respir Crit Care Med,2011,184(5):569-581.
[5]Gordon S,Taylor PR.Monocyte and macrophage heterogeneity[J].Nat Rev Immunol,2005,5(12):953-964.
[6]Lakatos HF,Burgess HA,Thatcher TH,et al.Oropharyngeal aspiration of a silica suspension produces a superior model of silicosis in the mouse when compared to intratracheal instillation[J].Exp Lung Res,2006,32(5):181-199.
[7]Szapiel SV,Elson NA,Fulmer JD,et al.Bleomycin-induced interstitial pulmonary disease in the nude,athymic mouse[J].Am Rev Respir Dis,1979,120(4):893.
[8]du Bois RM.Strategies for treating idiopathic pulmonary fibrosis[J].Nat Rev Drug Discov,2010,9(2):129-140.
[9]邱 慧,张德平.γ干扰素后期干预对大鼠肺纤维化影响[J].医学研究生学报,2006,19(10):888-891.
[10]Bringardner BD,Baran CP,Eubank TD,et al.The role of inflammation in the pathogenesis of idiopathic pulmonary fibrosis[J].Antioxid Redox Signal,2008,10(2):287-301.
[11]Ingersoll MA,Spanbroek R,Lottaz C,et al.Comparison of gene expression profiles between human and mouse monocyte subsets[J].Blood,2010,115(3):e10-e19.
[12]Ramachandran P,Pellicoro A,Vernon MA,et al.Differential Ly-6C expression identifies the recruited macrophage phenotype,which orchestrates the regression of murine liver fibrosis[J].Proc Natl Acad Sci,2012,109(46):E3186-E3195.
[13]Savino B,Castor MG,Caronni N,et al.Control of murine Ly6C(high)monocyte traffic and immunosuppressive activities by atypical chemokine receptor D6[J].Blood,2012,119(22):5250-5260.
[14]Murray PJ,Wynn TA.Protective and pathogenic functions of macrophage subsets[J].Nat Rev Immunol,2011,11(11):723-737.
[15]Laskin DL,Sunil VR,Gardner CR,et al.Macrophages and tissue injury:agents of defense or destruction?[J]Annu Rev Pharmacol Toxicol,2011,51:267-288.
[16]马南兰.结核性胸膜纤维化发病机制的研究进展[J].医学研究生学报,2013,26(7):762-765.
[17]陈艳军,高旭珍,张艳杰.高山红景天对肝纤维化大鼠Smad3 mRNA表达的影响[J].医学研究生学报,2013,25(12):1242-1246.

