葡聚糖硫酸钠诱导C57BL/6J小鼠急性结肠炎模型的建立与评价
徐丽红,肖 芳,兰小琴,何嘉怡,丁 强,田德安,郑 勇
0 引 言
我国炎症性肠病(inflammatory bowel disease,IBD)已属常见慢性肠道疾病,并以溃疡性结肠炎(ulcerative colitis,UC)多见。腹泻是UC最常见的临床症状,近年有学者提出肠道离子通道的功能受损所导致的水盐吸收分泌失衡与UC相关性腹泻关系密切,可能成为改善UC临床症状的治疗靶点[1]。葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的急、慢性结肠炎模型被广泛应用于IBD的研究[2-5],国内在运用此模型进行研究时多选用BALB/c小鼠[5],但其免疫学上表现为T细胞机能缺损,且免疫细胞活性随月龄增加而逐渐下降[6],在进行肠道免疫学研究时存在缺陷。C57BL/6J小鼠多数生物学特性与BALB/c小鼠相似,细胞免疫力随月龄增加较少降低,故国外研究多选择其进行肠道免疫学研究[2],而国内不多。本实验选用 C57BL/6J小鼠构建DSS诱导的急性结肠炎动物模型,旨在了解该模型中与腹泻相关的疾病表现和组织病理学改变及离子通道 SLC26A3蛋白表达的改变,为利用C57BL/6J小鼠开展IBD中离子通道在肠黏膜免疫中作用机制的研究建立基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 雌性健康 C57BL/6J小鼠,12只,6~8周龄,体重18~25 g,购自华中科技大学同济医院实验动物中心,实验动物合格证号:SCXK(鄂)2010-0007。饲养于华中科技大学实验动物中心SPF级屏障系统[SYXK(鄂)2010-0057],并使用华中科技大学实验动物中心提供的全价营养颗粒饲料饲养(蛋白22.8%、脂肪4.91%、纤维4.24%)。
1.1.2 主要试剂 DSS(购自 Sigma公司)相对分子质量35000~45000,硫磺含量为15.0%~20.0%;邻甲苯胺-冰醋酸、多聚甲醛(购自武汉鼎国生物科技有限公司);乙醇和橄榄油(购自北京化学试剂公司);苏木精、伊红(上海化学试剂厂产品)。蛋白提取试剂盒(Sigma公司产品),Western blot制胶试剂盒、蛋白酶抑制剂PMSF及蛋白BCA浓度检测试剂盒(购自武汉谷歌生物科技有限公司),SLC26A3兔抗原一抗(购自百奇生物科技有限公司),羊抗小鼠二抗(Santa Cruz公司产品)。
1.2 方法
1.2.1 急性结肠炎模型的制备 C57BL/6J小鼠按随机数字表法分为模型组(n=6)和对照组(n=6),模型组饮用浓度4%DSS(W/W,40 g/L)溶液7 d诱发急性溃疡性结肠炎,然后改正常饮水。对照组大鼠正常饮水。
1.2.2 测量指标和方法 饮DSS溶液第1天起每天使用千分位电子天平称量并记录小鼠的体重、新鲜粪便的质量和烘干后的质量以计算粪便含水量。邻甲苯胺-冰醋酸法行大便隐血试验,并观察记录粪便性状及肉眼血便情况。实验第8天用浓度1%戊巴比妥50~60 mg/kg腹腔注射麻醉,剖腹观察结肠外观,沿系膜侧剖开结肠,行组织学大体评分。取整段剪开结肠后冲洗干净,固定于硬塑胶平板上,用4%甲醛溶液固定1 h,做瑞士卷,用4%甲醛溶液固定24 h,切片,HE染色,行组织病理学观察。实验结束后断颈处死小鼠。
1.2.3 评分标准 结肠炎疾病活动指数(disease activity index,DAI)评分参考文献[7]。组织学大体评分参考文献[8]。组织黏膜改变和周围组织的黏连情况的评分总和为最后得分。组织病理学炎症评分参考文献[3]。
1.2.4 蛋白免疫印迹法检测结肠组织中SLC26A3的蛋白表达 2组各取3只小鼠结肠中远段组织置于去蛋白酶处理的1.5 mL EP管中。每管加入组织裂解液RIPA buffer 500μL(含终浓度1mmol/L的蛋白酶抑制剂PMSF),行组织研磨和超声破碎,使组织细胞充分裂解,提取组织总蛋白,BCA法测定蛋白浓度。取80μg组织蛋白行SDS-PAGE电泳,然后转膜至PVDF转印膜上,5%脱脂奶粉封闭,加入SLC26A3抗体(1∶200)和GAPDH 抗体(1∶5000),4℃孵育过夜,洗膜3次共25min,羊抗小鼠二抗(1∶3000),常温孵育1h,洗膜3次后增强化学发光法显色,曝光显影。
1.3 统计学分析 使用 SPSS 10.0软件行统计分析,定量资料采用均数±标准差()表示,两独立样本比较采用t检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1 小鼠粪便含水量、体重和DAI变化趋势 实验中,2组小鼠均无死亡。模型组饮用4%DSS,第3~4天开始出现急性结肠炎症状,粪便松散、隐血试验阳性最早于第3天出现,稀便和肉眼血便最早于第4天出现,粪便含水量在第3~4天开始明显增加,实验结束时模型组粪便含水量[(73.30±8.31)%]较实验开始时[(44.32±6.42)%]升高,差异有统计学意义(P=0.004);实验结束时对照组粪便含水量[(54.73± 3.69)%]较 实 验 开 始 时 [(48.42 ±9.69)%]差异无统计学意义(P=0.4);模型组DAI评分从第3天开始迅速上升,实验结束时DAI评分(3.50 ±0.87)较实验开始时(1.00 ±0.00)升高,差异有统计学意义(P=0.000);实验结束时对照组DAI值(1.0 ±0.00)较实验开始时(1.33 ±0.57)差异无统计学意义(P=0.06);模型组体重第5天开始明显下降,实验结束时小鼠体重[(13.5±0.90)g]较实验开始时[(16.90±0.49)g]明显下降,差异有统计学意义(P=0.001),对照组体重[(19.18 ±1.33)g]较实验开始时[(17.72 ±1.18)g]有所增加,差异有统计学意义(P=0.02)。见图1。饮用DSS过程中,模型组出现毛发色泽变暗、精神萎靡、活动减少、反应能力下降等表现。
2.2 组织学大体改变 实验第8天,剖腹见模型组结肠肠壁充血水肿,部分肠道组织与周围器官黏连,对照组小鼠的结肠肠壁光滑,排列整齐。取全段结肠,模型组小鼠的结肠长度[(4.8±0.8)cm]较对照组[(7.53±0.3)cm]短,差异有统计学意义(P=0.000),且模型组小鼠肠壁明显增厚,管壁僵硬,肠黏膜广泛充血、水肿,局部有糜烂、出血,可见浅溃疡,病变累及整段结肠,以中段和远段结肠为重。模型组组织学大体评分(4.50 ±0.84)较对照组(0.16 ±0.41)高,差异有统计学意义(P=0.000)。
2.3 组织病理学改变 模型组结肠黏膜呈明显的急性炎症反应,光镜下表现为部分表面上皮脱落,炎症主要累及黏膜、黏膜下层,炎性细胞以中性粒细胞和淋巴细胞为主,浆细胞少见,上皮内杯状细胞减少,隐窝破坏,见图2。模型组结肠组织病理学炎症评分(3.6 ±0.5)较对照组(0.33 ±0.5)升高,差异有统计学意义(P=0.002)。
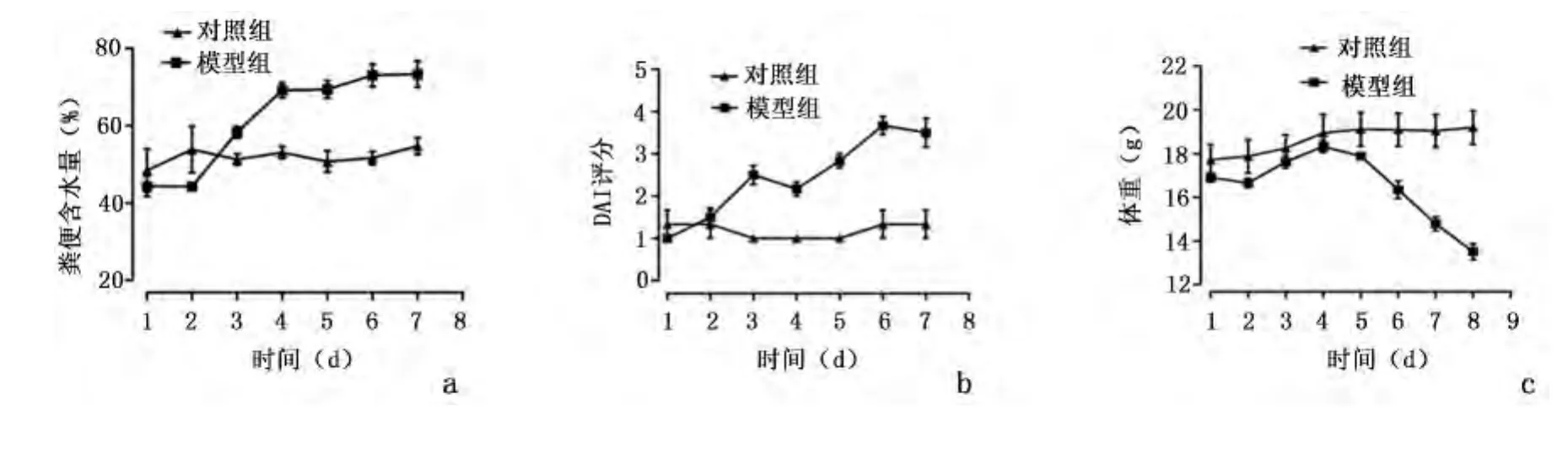
图1 模型组和对照组小鼠粪便含水量、体重和DAI变化趋势Figure 1 The water content in fecal,weight and DAI trends of two groups
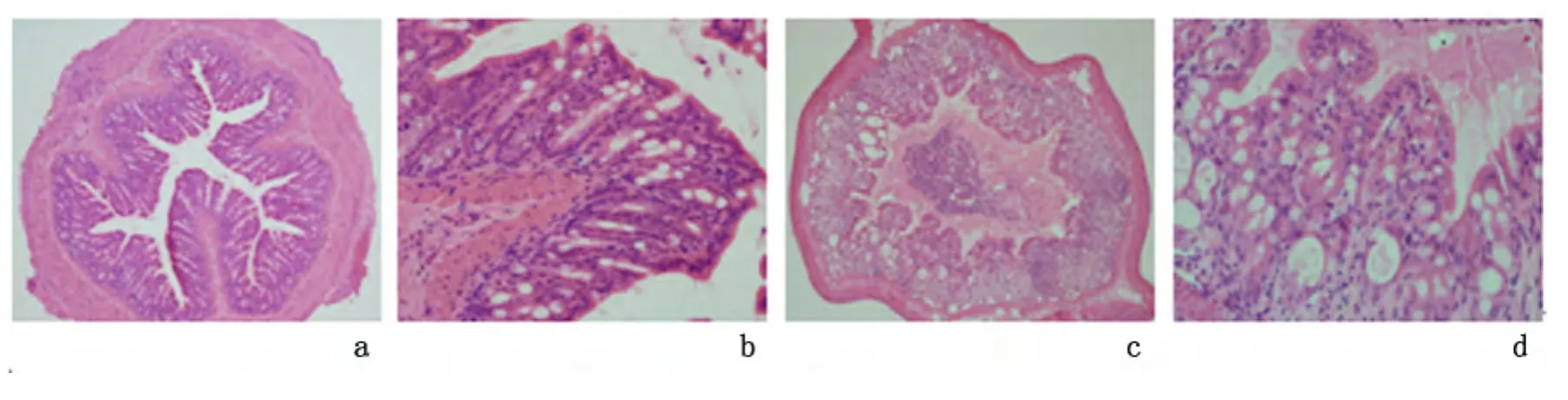
图2 模型组与对照组小鼠结肠组织病理学表现Figure 2 Histological results of two groups in mice of model group and control group
2.4 结肠组织SLC26A3的蛋白表达 蛋白免疫印迹实验检测结肠SLC26A3的蛋白表达,提示模型组较对照组结肠黏膜SLC26A3的蛋白表达量明显降低。见图3。
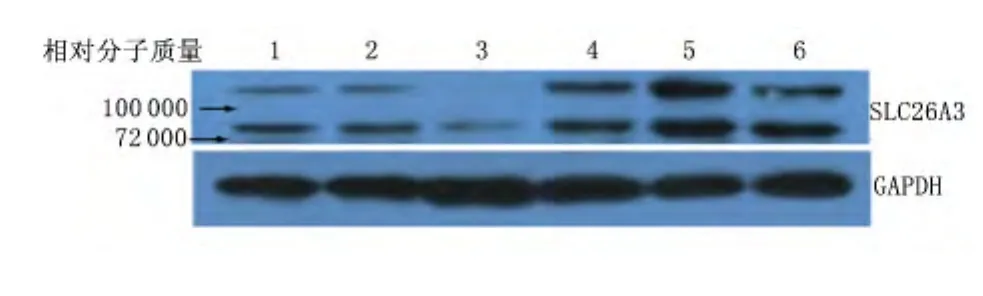
图3 模型组与对照组小鼠结肠组织中SLC26A3的蛋白表达Figure 3 Protein expression of SLC26A3 of colon in mice of model group and control group
3 讨 论
目前IBD的动物模型主要包括自发性模型、化学药物诱导模型、细胞移植模型、基因模型,这些模型各有其特征和独特作用,其中以化学药物诱导模型操作简单、时间短、重复性好、经济实用,应用最为广泛[3]。化学药物诱导模型中常用的药物包括乙酸、三硝基苯磺酸、噁唑酮、DSS、角叉菜胶、碘乙酰胺等。其中口服给药DSS模型,由于其造模炎症的轻重主要与DSS浓度有关而与小鼠摄入量关系不大[9]使造模过程相对容易控制,可行性较强。DSS结肠炎模型可用于各种大鼠、小鼠、仓鼠和豚鼠等,但动物种属之间对DSS的易感性和病变部位存在差异[4]。C57BL/6J小鼠对DSS中度敏感,病变以直肠和左半结肠为主,与人类UC的好发病变部位相似,其免疫系统相对稳定适宜用于涉及肠道免疫学研究的实验。此外,DSS急性结肠炎模型的炎症病变部位、病变进展过程和程度不仅与鼠的种属、DSS的浓度有关,还与鼠生存环境有关[4]。为建立适合本实验室的稳定的实验模型,本实验组曾参考文献[3-4,9],构建不同浓度的DSS诱导C57BL/6J小鼠模型,结果提示:6%浓度的DSS模型小鼠死亡率高,在实验第6天所有小鼠死亡。3%和4%浓度的DSS模型小鼠在实验结束时均存活,但前者肠道炎症表现不明显,部分小鼠至实验结束时才出现稀便和粪便隐血实验阳性,疾病进展过程不稳定,不利于后期的实验评估。4%浓度的DSS模型的小鼠不仅成模率高,存活率高,且小鼠个体之间差异较小,稳定性较好。故本研究选择以4%浓度DSS诱导的C57BL/6J小鼠急性结肠炎模型为观察对象。
人类UC的炎症病变局限于结肠黏膜及黏膜下层,多位于乙状结肠和直肠,临床主要表现为腹痛、腹泻、黏液脓血便。本组选择的4%DSS诱导的结肠炎模型的腹泻症状主要为粪便不成形及稀水样、血便,粪便含水量增加,在造模的第3~4天就达到高峰,并同时伴小鼠体重的迅速下降,DAI指数在造模的第6~7天达到高峰并伴小鼠出现明显的皮肤松弛,眼窝凹陷等脱水现象,与人类中-重度UC的临床表现极为相似。肉眼大体组织学观察显示,结肠炎症改变从肛门侧自下而上连续性发展,黏膜充血水肿,散在浅溃疡,多位于右半结肠和直肠,并伴结肠缩短;显微镜下病理组织学观察显示,炎症改变主要累及黏膜、黏膜下层,以中性粒细胞和淋巴细胞为主,隐窝破坏。上述特点与人类溃疡性结肠炎组织学改变的特点也极为相似。因此可以认为所选模型适用于关于UC黏膜炎症和腹泻的相关研究。
腹泻是IBD尤其是UC患者最常见的临床表现之一,其间涉及多种病理机制,多数研究者认为水电解质尤其是Na+和Cl-的肠道分泌吸收失衡是腹泻发生的最主要的病理过程[10]。SLC26A3是一种肠道Cl-/HCO3-离子转运体,在下消化道和Na+/H+转运体3协同调节NaCl的吸收,其基因缺陷可导致先天性失氯性腹泻[11]。关于IBD患者的人群研究证实SLC26A3主要在远端结肠表达并发挥离子调控功能,UC患者的肠道SLC26A3 mRNA表达下降并伴有结肠隐窝Cl-/HCO3-交换能力的下降[1]。关于致病性大肠埃希菌肠炎[12]和柠檬酸杆菌肠炎[13]的研究发现细胞病变性腹泻的发生亦与SLC26A3的黏膜表达下降有关。这些研究均提示SLC26A3的功能缺陷或表达受损是肠道炎症性腹泻的原因之一。本次试验结果证实,在DSS诱导的结肠炎模型中,伴随腹泻的发生,中远段结肠组织SLC26A3的蛋白表达明显减少,提示DSS诱导的结肠炎性腹泻亦和离子通道蛋白的表达受损具有相关性。
详细了解离子通道SLC26A3在炎症性腹泻进展中的病理生理过程可使改善SLC26A3功能和平衡SLC26A3的表达成为治疗肠道炎症性腹泻的新策略。近年有研究者提出在UC的发展过程中,SLC26A3、炎症因子和肠黏膜免疫系统之间存在相互作用[14-15],且肠道离子转运功能受损和肠道黏膜屏障受损往往平行存在[16],推测恢复受损SLC26A3的功能可能不仅有益于缓解UC患者的腹泻而且有利于缓解UC的进展。本组实验结果证实4%DSS诱导的C57BL/6J小鼠结肠炎模型与人类UC相比,不仅腹泻特征相似,而且SLC26A3蛋白表达改变也相似,结合既往分析该模型中炎症分子与免疫因子表达改变的文献[2,5],有理由相信该模型可用于离子通道、肠道炎症和肠黏膜免疫在肠道炎症性腹泻中相互作用机制的研究,既可为寻找缓解炎症性腹泻的新方法提供帮助,也有助于探索治疗UC的新策略。
[1]Farkas K,Yeruva S,Rakonczay Z Jr,et al.New therapeutic targets in ulcerative colitis:the importance of ion transporters in the human colon[J].Inflamm Bowel Dis,2011,17(4):884-898.
[2]Bento AF,Leite DF,Marcon R,et al.Evaluation of chemical mediators and cellular response during acute and chronic gut inflammatory response induced by dextran sodium sulfate in mice[J].Biochem Pharmacol,2012,84(11):1459-1469.
[3]Wirtz S,Neufert C,Weigmann B,et al.Chemically induced mouse models of intestinal inflammation[J].Nat Protoc,2007,2(3):541-546.
[4]Perse M,Cerar A.Dextran sodium sulphate colitis mouse model:traps and tricks[J]. J Biomed Biotechnol,2012,2012:718617.
[5]吴 瑛,汪芳裕,魏 娟,等.甘露糖结合凝集素在小鼠葡聚糖硫酸钠结肠炎发病中的机制研究[J].医学研究生学报,2010,23(2):141-144.
[6]冯仁田,潘宏志,何 维,等.Balb/C小鼠免疫系统结构与功能的增龄性变化[J].中华老年医学杂志,2000,19(3):174-177.
[7]Sutherland LR,Martin F,Greer S,et al.5-Aminosalicylic acid enema in the treatment of distal ulcerative colitis,proctosigmoiditis,and proctitis[J].Gastroenterology,1987,92(6):1894-1898.
[8]Butzner JD,Parmar R,Bell CJ,et al.Butyrate enema therapystimulates mucosal repair in experimental colitis in the rat[J].Gut,1996,38(4):568-573.
[9]Egger B,Bajaj-Elliott M,MacDonald TT,et al.Characterisation of acute murine dextran sodium sulphate colitis:cytokine profile and dose dependency[J].Digestion,2000,62(4):240-248.
[10]Wenzl HH.Diarrhea in chronic inflammatory bowel diseases[J].Gastroenterol Clin North Am,2012,41(3):651-675.
[11]Alper SL,Sharma AK.The SLC26 gene family of anion transporters and channels[J].Mol Aspects Med,2013,34(2-3):494-515.
[12]Gill RK,Borthakur A,Hodges K,et al.Mechanism underlying inhibition of intestinal apical Cl/OH exchange following infection with enteropathogenic E.coli[J].J Clin Invest,2007,117(2):428-437.
[13]Borenshtein D,Schlieper KA,Rickman BH,et al.Decreased expression of colonic Slc26a3 and carbonic anhydrase iv as a cause of fatal infectious diarrhea in mice[J].Infect Immun,2009,77(9):3639-3650.
[14]Manoharan P,Coon S,Baseler W,et al.Prostaglandins,not the leukotrienes, regulate Cl-/HCO3-exchange (DRA,SLC26A3)in villus cells in the chronically inflamed rabbit ileum[J].Biochim Biophys Acta,2013,1828(2):179-186.
[15]Lee JH,Nam JH,Park J,et al.Regulation of SLC26A3 activity by NHERF4 PDZ-mediated interaction[J].Cell Signal,2012,24(9):1821-1830.
[16]Lamprecht G,Gaco V,Turner JR,et al.Regulation of the intestinal anion exchanger DRA(downregulated in adenoma)[J].Ann N Y Acad Sci,2009,1165:261-266.

