加味六味地黄汤对UUO大鼠肾组织TGF-β1及EMT的影响*
黄仁发,梁群卿,吴金玉,向少伟,龙 韵,康 雷
(1.广西中医药大学附属瑞康医院,南宁 530011;2.广西中医药大学第一附属医院肾内科,南宁 530023;3.北京中医药大学东直门医院门诊办公室,北京 100700)
目前认为,肾小管上皮-间质细胞转分化(Epithelial-mesenchymal transformation,EMT)是肾间质纤维化(Renal interstitial fibrosis,RIF)形成最重要的病理过程[1]。我们的前期临床研究表明,六味地黄汤及其怡肾汤(六味地黄汤加桂枝、荆芥、大黄)能改善5/6肾切除大鼠肾脏病理,减少CKD患者的蛋白尿,改善肾功能,降低血清纤维连接蛋白、IV型胶原纤维等致纤维因子,改善CKD患者的免疫功能,抑制微炎症状态,有较好的抗肾纤维化作用[2~6]。但加味六味地黄抗肾纤维化的信号机制尚未完全清楚。本研究中,我们探讨该方对单侧输尿管梗阻(UUO)大鼠肾组织转化生长因子-β1(transforming growth factor-β,TGF-β1)及EMT 的影响。
1 材料与方法
1.1 实验动物
10~12周龄健康雄性清洁级 SD(Sprasue-Dawley)大鼠,体质量(210±34)g共45只,购自上海斯莱克景达实验动物有限公司(动物合格证号SCXK(湘)2009-0004),在广西中医药大学实验动物学部饲养,在室温18~25℃、相对湿度50% ~60%、人工12 h昼/夜循环照明环境中用全价营养、分笼饲养。每日定时清洗笼舍,大鼠能自由摄食及饮水。
1.2 主要仪器和试剂
BX-50生物光学显微镜、水平电泳槽、TGF-β1多克隆抗体(santa cruz,sc-146)、α-SMA多克隆抗体(santa cruz,sc-58670)、E-Cadherin 多克隆 抗 体(santa cruz,sc-31020)、SP 免疫组化试剂盒(北京中杉金桥生物技术有限公司)、蛋白提取试剂盒(上海申能博彩生物技术公司)、BCA蛋白定量试剂盒(江苏碧云天生物技术公司、PMSF(江苏碧云天生物技术公司)、PDVF膜(苏州广惠科技有限公司)。
1.3 加味六味地黄汤组成及制备
加味六味地黄汤组成:熟地黄10 g,山茱萸10 g,干山药 15 g,泽泻 10 g,茯苓 12 g,丹皮 10 g,大黄10 g,桂枝 10 g,丹参 15 g,黄芪 30 g,以上药物共132 g,均购自广西中医药大学附属瑞康医院药剂科。先将药材用相当于药材5倍的自来水浸泡2 h,煮沸后再微火煎煮30 min,过滤后收集煎液,原药渣加少量水煎煮得二煎液。两煎液混合,于水浴恒温器上浓缩至浓度为每毫升药液含生药1 g。
1.4 单侧输尿管结扎大鼠模型的建立
大鼠适应性饲养1周后,10%的水合氯醛(3 ml/kg)腹腔注射麻醉大鼠,然后将大鼠俯卧位固定于大鼠固定板上,鼠背部左肋下备皮,常规消毒,沿腋后线从左肋下向尾部方向剪开皮肤,钝性分离皮下肌层和组织,暴露左肾,沿肾蒂向肾下极方向寻找输尿管,在输尿管上段行双线(4号丝线)结扎,两结扎点间剪断输尿管,逐层缝合皮下组织和皮肤,假手术组除不结扎输尿管外其他手术步骤均相同。
1.5 分组给药
健康成年SD大鼠90只,按体质量随机分为假手术组(n=30)、模型组(n=30)、中药组(n=30),3组组内再分为7 d、14 d、28 d 3个时间点,每个时间点处死10只大鼠,假手术组和模型组每日给予生理盐水(2 ml/只/d)灌胃;中药组在造模后按上法制备加味六味地黄汤药液(2 ml/只/d)灌胃;留取各组大鼠血液及左肾组织检测相关指标。
1.6 指标检测
1.6.1 肾功能检测 收集血液,自动生化仪检测肾功能尿素氮(BUN)和肌酐(Scr)水平。
1.6.2 肾脏病理检测 取左侧1/2肾脏置于4%多聚甲醛磷酸缓冲液中,将标本按顺序脱水、石蜡包埋、切片、行HE染色和Masson染色,于光学显微镜下观察肾间质改变并摄像。按以下方法进行评估[7]:首先计算30个高倍视野(×400)肾皮质中发生损害(肾小管扩张、萎缩、管型、坏死或小管炎)的肾小管数目和总肾小管数,以损害的肾小管数占总肾小管数的百分比表示。肾间质纤维化程度进行半定量评估,分值为0~4分,0分为正常;1分为肾间质纤维化面积不超过视野25%;2分为25%~49%;3分为50%~75%;4分为超过75%。计算30个肾皮质高倍视野(×400),求和、取平均数,得该标本肾间质纤维化分值。
1.6.2 免疫组织化学法检测各组大鼠肾组织α-SMA、E-Cadherin蛋白的表达 切片常规脱蜡至水,3%H2O2阻断灭活内源性过氧化物酶,0.01M枸橼酸缓冲液煮沸修复抗原,羊血清工作液封闭,分别滴加α-SMA多克隆抗体(1∶150)、E-Cadherin多克隆抗体(1∶150),37℃ 孵育 30 min,4℃ 过夜。DAB显色5~20 min,显微镜下观察大鼠肾组织蛋白表达的量及部位,肾小管上皮细胞胞浆有棕黄色颗粒为阳性,不着色者为阴性。每个标本随机选取10个皮质及外髓不重叠高倍(200×)视野计算细胞阳性率。细胞阳性率=阳性细胞数/视野所有细胞数×100%,取平均值作为每只实验大鼠的检测值,然后通过统计学方法进行半定量分析。
1.6.3 Western blot法检测各组大鼠肾组织TGF-β1蛋白的表达 取保存的肾组织50~100 mg在冰上剪成碎片,加入蛋白裂解液提取组织总蛋白,BCA法检测蛋白浓度。按Western blot步骤进行电泳、转膜,进行 TGF-β1 多克隆抗体(1∶300)、β-actin多克隆抗体(1∶300)的免疫检测,蛋白条带用IPP图像分析软件检测其OD值,用β-actin蛋白作为内参照,通过计算比值(OD目的蛋白/ODβ-actin)即目的蛋白的表达量来分析TGF-β1蛋白相对表达水平。
2 结果
2.1 加味六味地黄汤对大鼠肾功能BUN和Scr水平的影响
表1显示,假手术组BUN和Scr水平正常,而模型组大鼠第7天开始出现BUN和Scr水平增高,之后逐渐升高,至28 d达到高峰。与假手术组同时间点比较,模型组大鼠BUN和Scr水平增高,差异有统计学意义(P<0.01);与模型组相同时间点比较,中药组大鼠BUN和Scr水平降低,差异有统计学意义(P<0.05)。
2.2 加味六味地黄汤对大鼠肾脏病理的影响
图1、2和表1显示,假手术组大鼠肾小管间质基本正常。而模型组大鼠第7天开始出现肾小管萎缩、间质纤维化,之后病变逐渐加重,至28天肾小管萎缩、间质纤维化达高峰。而经加味六味地黄汤干预后,肾小管萎缩、间质纤维化等病变明显改善。半定量评分结果表明,与假手术组相同时间点比较,模型组大鼠计分明显增高,差异有统计学意义(P<0.01);与模型组相同时间点比较,中药组大鼠肾小管间质评分降低,差异有统计学意义(P<0.05)。
表1 加味六味地黄汤对大鼠肾功能BUN和Scr水平的影响(±s,mg/dl)

表1 加味六味地黄汤对大鼠肾功能BUN和Scr水平的影响(±s,mg/dl)
注:与假手术组比较:*P<0.05,**P <0.01;与模型组比较:△P <0.05,△△P <0.01
组 别 例数Scr时间点BUN 10 7 d 14 d 28 d 7 d 14 d 28 d假 手 术 组 10 12.15± 4.24 11.96±3.98 12.07± 4.32 0.38±0.08 0.40±0.10 0.42±0.13模 型 组 10 42.56 ±10.64** 46.96 ±9.36** 48.67 ±10.25** 2.21 ±0.68** 2.76 ±0.36** 3.52 ±0.47**中 药 组 10 34.87± 8.72△ 38.21±6.63△ 39.31±10.86△ 1.60±0.45△ 2.10±0.58△ 2.83±0.69△

图1 HE染色(×400)
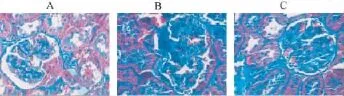
图2 Masson染色(×400)
表2 各组大鼠肾小管间质半定量评分比较(±s)

表2 各组大鼠肾小管间质半定量评分比较(±s)
注:与假手术组比较:*P<0.05,**P<0.01;与模型组比较:△P<0.05
组 别 例数7 d 14 d 28 d假手术组10 0.12±0.04 0.13±0.05 0.11±0.03模 型 组 10 1.87 ±0.68** 2.62 ±1.12** 4.12 ±1.64**中 药 组 10 1.28±0.52△ 1.95±0.68△ 3.31±1.84△
2.3 加味六味地黄汤对大鼠肾脏E-Cadherin、α-SMA蛋白的影响
假手术组大鼠肾小管可见较多的E-Cadherin阳性蛋白表达,极少量的α-SMA阳性蛋白表达;模型组大鼠第7天即可见到较多的α-SMA阳性蛋白表达,而E-Cadherin阳性蛋白表达减少,随时间延长α-SMA阳性蛋白表达增多,E-Cadherin阳性蛋白表达下调,至第 28天 α-SMA蛋白达高峰,而 ECadherin阳性蛋白最少,与假手术组相同时间点α-SMA和E-Cadherin蛋白表达比较,模型组表达差异均有统计学意义(P<0.01)。经加味六味地黄汤治疗后,肾小管α-SMA阳性蛋白表达下调,E-Cadherin阳性蛋白上调,与模型组相同时间点比较,差异均有统计学意义(P<0.01)。
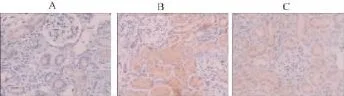
图3 各组大鼠肾组织α-SMA蛋白表达(免疫组化×200)
表3 各组大鼠肾小管α-SMA蛋白阳性细胞数表达(±s)

表3 各组大鼠肾小管α-SMA蛋白阳性细胞数表达(±s)
注:与假手术组比较:*P<0.05,**P<0.01;与模型组比较:△P<0.05
组 别 例数7 d 14 d 28 d假手术组10 8.72±2.06 9.18± 1.96 8.95± 2.14模 型 组 10 17.26±6.24** 28.58±10.36** 38.71±13.25**中 药 组 10 11.47±4.82△ 19.67±8.74△ 31.35±7.96△

图4 各组大鼠肾组织E-Cadherin蛋白表达(免疫组化×200)
表4 各组大鼠肾小管E-Cadherin蛋白阳性细胞数表达(±s)

表4 各组大鼠肾小管E-Cadherin蛋白阳性细胞数表达(±s)
注:与假手术组比较:*P <0.05,**P <0.01;与模型组比较:△P <0.05
组 别 例数7 d 14 d 28 d假手术组10 39.45±15.78 38.21±14.57 38.36±12.05模 型 组 10 30.17±14.22** 26.64±12.18** 21.35±12.56**中 药 组 10 36.21±10.45△ 32.39±13.66△ 28.47±10.81△
2.4 加味六味地黄汤对大鼠肾脏TGF-β1蛋白表达的影响
假手术组大鼠肾小管可见少量的 TGF-β1蛋白表达;模型组大鼠第7天即可见到较多的TGFβ蛋白表达,随时间延长二者表达增多,至第28天达高峰,与假手术组相同时间点比较,差异有统计学意义(P<0.01)。经加味六味地黄汤治疗后,肾组织TGF-β1蛋白表达下调,与模型组相同时间点比较,差异有统计学意义(P<0.01)。

图5 各组大鼠肾组织TGF-β1蛋白表达(western blot)
3 讨论
RIF是导致肾功能丧失最主要的病理生理过程之一。RIF形成分子机制复杂,目前认为肾小管上皮-间质细胞转分化(Epithelial-mesenchymal transformation,EMT)是 RIF形成最重要的病理过程[1]。EMT形成的标志是肾小管上皮细胞失去其上皮细胞表型E-钙黏蛋白(E-cadherin)和波形蛋白(vimentin),获得MyoF表型如 α-平滑肌动蛋白(α-SMA)[1],后者通过破坏的肾小管基底膜转位至肾间质,分泌III型胶原、IV型胶原等细胞外基质增多,从而引起RIF[8]。近年来,已有大量的实验研究证实,TGF-β1在RIF时EMT过程中起到重要的作用,被认为是最关键的致纤维化因子之一[8]。而抑制TGF-β1介导的EMT过程是减轻纤维化的重要手段。
表5 各组大鼠肾组织TGF-β1蛋白的表达(-x ± s,OD 目的/OD 内参)
中医理论虽无“肾纤维化”一词,但各种CKD最终可因久病伤正而导致正虚邪实、浊邪上逆,最终发展至水肿、癃闭、关格。在RIF的发生发展过程中,其本虚标实的病机特点已为大多数医家所认可,正不胜邪,“虚、瘀、湿、毒”是重要的四大病理因素,其中“虚”是RIF的根本,肾虚在RIF的整个病程中起至关重要的作用[10]。而“湿”、“瘀”是 RIF的病理基础,“毒”则是 RIF发展后期不可忽视的因素[11]。瘀血浊毒贯穿于纤维化整个病变过程中,是引起肾纤维化的主要因素[10]。因此,我们将中医药抑制RIF、延缓肾衰竭进程的切入点应放在补脾肾、祛湿、活血化瘀及排毒上。
六味地黄丸出自宋·钱乙《小儿药证直诀》,结合RIF时“虚、瘀、湿、毒”的四大病理因素及单味药研究结果,我们在六味地黄汤基础上加桂枝、大黄、黄芪、丹参,取桂枝通阳利水湿,大黄通便以排毒,黄芪益气健脾利水,丹参活血化瘀,取名加味六味地黄汤,全方共奏补益脾肾、利水活血、排毒的功能。本实验主要探讨六味地黄汤加味是否通过阻断TGF-β1的活化、抑制EMT过程,从而发挥延缓RIF的发生发展的作用。
我们的结果表明,加味六味地黄汤可改善肾小管间质病变及肾功能,提示具有较好的肾保护作用。进一步研究显示,随着RIF的程度加重,UUO大鼠肾小管 TGF-β1和 α-SMA表达增多,而 E-Cadherin蛋白表达减少,证实RIF过程中存在TGF-β1介导的EMT过程。而加味六味地黄汤可以下调肾小管TGF-β1和α-SMA的表达,上调E-Cadherin蛋白的表达,提示加味六味地黄汤抗RIF的机制可能与抑制TGF-β1介导的EMT过程有关,但加味六味地黄汤抗RIF的其他机制有待进一步研究。
[1]Strutz FM.EMT and proteinuria as progression factors[J].Kidney Int,2009,75:475-481.
[2]陈北阳,何泽云,龙若庭,等.怡肾汤对大鼠5/6肾切除术后残肾肾功能及组织形态学的影响[J].湖南中医学院学报,2005,25(3):11-13.
[3]黄仁发,史伟,吴金玉.怡肾汤治疗慢性肾衰竭的疗效观察及对免疫功能的影响[J].湖南中医药大学学报,2007,27(6):52-54.
[4]黄仁发,隆献,吴金玉.怡肾汤对3~4期CKD患者血清LN、CV-Ⅳ和SOD、MDA的影响[J].中国中西医结合肾病杂志,2009,10(5):421-422.
[5]康雷,黄仁发,向少伟.加味六味地黄汤对3~4期慢性肾脏病患者微炎症状态的影响[J].中国中医基础医学杂志,2011,10(12):1354-1359
[6]何泽云.六味地黄丸对5/6肾切除大鼠残肾肾小球化生的影响[J].湖南中医学院学报,2004,24(2):1-3.
[7]杨椹,宁建平,曾莹晖,等.糖尿病大鼠肾小管整合素连接激酶的表达及氯沙坦的干预作用[J].中国中西医结合肾病杂志,2007 ,8(4):199-201.
[8]Youhua Liu.New Insights into epithelial-mesenchymal transition in Kidney Fibrosis[J].J Am Soc Nephrol,2010,21:212-222.
[9]Yin Z,Xia Y,Luo C,et al.Effects of Silencing Transforming Growth Factor-β1by RNA Interference Plasmid on Rat Renal Allograft Fibrosis Using Smads Pathway[J].Urology,2011,77(3):762-767.
[10]卢祖礼,王小琴.浅析肾纤维化的中医病机[J].湖北中医杂志,2004,26(11):18-19.
[11]郭小雷,陈敏,王怡.肾间质纤维化的中医阐述与探微[J].辽宁中医药大学学报,2010,12(4):243-245.

