家蝇溶菌酶1基因的克隆、序列分析及原核表达
王梅梅,万 玲,孔令聪,裴志花,刘树明,马红霞,3*
(1.吉林农业大学生命科学学院,长春130118;2.吉林农业大学动物科学科技学院,长春130118;3.动物生产与产品质量安全教育部重点实验室(吉林农业大学),长春130118)
鸡致病性大肠杆菌是世界范围内影响家禽业发展的主要细菌病之一,可通过呼吸道和消化道传播,具有难治愈、死亡率高、易复发等临床特点,给我国家禽养殖业带来严重危害[1-2]。而传统抗生素的滥用加剧了其耐药性的不断产生,导致疾病不能被有效控制。抗菌肽作为新型药物,具有广谱、高效的抗菌活性,尤其是对耐药致病菌有良好的杀灭作用[3]。家蝇长期处在恶劣的环境中,其体表携带多种病原体,而自身却不感染,是缘于其体内存在的一种肽类生物活性物质即抗菌肽[4]。家蝇溶菌酶作为家蝇抗菌肽的重要成员对耐药菌株有明显的杀伤作用,且对正常生物体细胞无破坏作用[5]。本研究以鸡致病性大肠杆菌诱导家蝇三日龄幼虫抑制性消减文库中筛选出来的差异基因为基础,通过对家蝇溶菌酶1基因进行克隆及原核表达,为进一步研究其表达产物抗鸡致病性大肠杆菌的活性及其他免疫学活性奠定了基础。
1 材料与方法
1.1 材料
1.1.1 血清文库、菌株和质粒 大肠杆菌诱导家蝇幼虫SSH文库由吉林农业大学兽医药理实验室完成,大肠杆菌感受态菌株DH5α、BL21、原核表达载体pET-32a(+)均由本实验室保存。鸡致病性大肠杆菌为临床分离的耐药菌株,由吉林农业大学药理实验室留存。
1.1.2 试剂 Ex TaqTMDNA 聚合酶、EcoR I和BamH I限制性内切酶、T4 DNA连接酶、IPTG、DL 2000TMDNA Marker、λ - Hind III digest DNA Marker、pMD18-T载体试剂盒等,购自宝生物工程(大连)有限公司;SanPrep柱式DNA胶回收试剂盒购自生工生物(上海)工程有限公司;cDNA末端快速扩增试剂盒SMARTerTMRACE cDNA Amplification Kit购自Clontech公司。
1.2 方法
1.2.1 MdL1基因的筛选 通过鸡致病性大肠杆菌诱导3日龄家蝇幼虫,激活家蝇幼虫免疫应答反应产生差异基因,利用SSH技术构建了鸡大肠杆菌诱导家蝇幼虫的正向、反向cDNA文库,以PCR法和反向Northern点杂交法进行两次筛选,获取差异表达基因部分序列[4]。
1.2.2 家蝇幼虫总 RNA的提取及 cDNA的合成以三日龄家蝇幼虫为试验材料,用蘸有高致病性大肠杆菌菌液的诱导针刺幼虫腹部,诱导后放于智能人工气候箱中培养,用于总RNA的提取;总RNA的提取过程参照RNAisoTMPlus提取试剂盒说明书完成,并进行mRNA的分离及浓缩;然后进行反转录,合成单链3’-RACE-Ready cDNA和5’-RACE-Ready cDNA,操作过程参照 SMARTerTMRACE cDNA Amplification Kit说明书完成[4]。
1.2.3 cDNA末端快速扩增(RACE) 根据大肠杆菌诱导家蝇三日龄幼虫SSH文库[4]中筛选得到的MdL-1基因部分cDNA序列设计5’RACE和3’RACE特异性引物,GSP1:5’- TCCAGCCTTGTTGGG ACTTGATCTTG -3’,GSP2:5’- TGCCACTTGTCCTGTGACGCTTTGT -3’,送上海生工生物工程有限公司合成。扩增3’RACE和5’RACE按照SMARTTMRACE cDNA Amplification Kit试剂盒说明书进行[4]。RACE扩增产物回收纯化后,与pMD18-T载体连接,转化到大肠杆菌DH5α感受态细胞,将酶切验证为阳性的重组质粒测序分析。
1.2.4 MdL1全长基因扩增及克隆 根据扩增的3’RACE和5’RACE序列拼接得到完整的cDNA序列,并查找其ORF序列。根据该ORF序列设计特异性引物MdL1F和MdL1R,并于两5’端分别添加BamH I和EcoRⅠ酶切位点,MdL1F:5’-TCCGGATCCATGAAATTCTTCATTGTC -3’;MdL1R:5’-CGCGGAAT TCTTAA ACACAATCGTTG -3’。以三日龄家蝇幼虫5’-RACE-Ready cDNA为模板进行PCR扩增,PCR产物回收纯化后与pMD18-T载体连接,转化Ecoli DH5α,将双酶切验证为阳性的重组质粒,送生物公司测序并进行序列分析。该重组质粒命名为pMD18-T-MdL-1。
1.2.5 MdL-1基因的序列测定及生物信息学分析测序后的MdL-1基因利用ExPASy网站(http//:expasy.org)提供的ProtParam软件进行理化性质分析,利用 NCBI网站(http://www.ncbi.nlm.nih.gov/pubmed/)进行BLASTX分析,分析其功能区域及与Genbank中所登录的序列的同源性。
1.2.6 pET-32a- MdL1表达载体的构建 重组质粒pMD18-T-MdL-1和pET-32a(+)经EcoR I和BamH I进行双酶切回收后,连接并转化至Ecoli BL21(DE3),提取质粒进行双酶切鉴定,将获得的阳性质粒送去测序。将重组质粒命名为pET-32a-MdL-1。
1.2.7 重组质粒的诱导表达及SDS-PAGE分析将pET-32a-MdL-1阳性质粒转化至E.coli BL21(DE3)中,挑取单菌落接种于含Amp的5 mL液体培养基中,37℃振荡培养过夜后,取3 mL接种于300 mL液体培养基中扩大培养至OD600值在0.6~0.8之间,加入IPTG进行诱导表达。将诱导菌液进行超声波破碎后,分别取上清和沉淀进行SDS-PAGE电泳。
1.2.8 融合蛋白的亲和纯化及复性 用包涵体裂解液(50 mmol/L Tris-Hcl buffer,8 mmol/L urea,pH 8.0)裂解包涵体沉淀,室温振荡1~2 h,4℃ 12000 r/min离心30 min,收集上清,进行纯化,操作过程参照GE healthcare的His TrapTMHP说明书进行[6]。将纯化液装入透析袋中,4℃于复性缓冲溶液中进行尿素梯度透析。
1.2.9 生物活性检测 收集复性蛋白,利用牛津杯法,检测融合蛋白对大肠杆菌的生物活性[7]。取100 μL大肠杆菌菌液(105CFU/mL)均匀涂布于琼脂平板上,放入牛津杯,杯内加入100 μL蛋白,37℃过夜培养,观察抑菌圈大小。
2 结果
2.1 MdL1基因的筛选 将部分序列在NCBI数据库中BLAST比对分析后,筛选得到一个家蝇溶菌酶1基因。
2.2 家蝇幼虫总RNA的提取、纯化与质量鉴定提取得到家蝇幼虫总RNA后,1%琼脂糖凝胶电泳检测显示,总RNA有2条清晰条带,28S rRNA和18S rRNA,一条较浅的 5S rRNA条带(图1),OD260/OD280为1.98,提取、纯化的家蝇幼虫总RNA可满足实验要求。
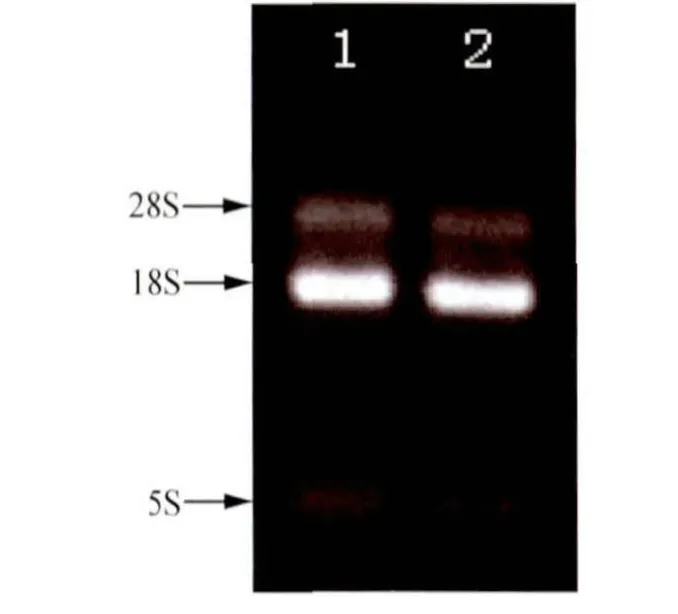
图1 总RNA的1.0%琼脂糖凝胶电泳图
2.3 RACE扩增MdL1基因 PCR产物经1% 琼脂糖电泳显示,3’-RACE得到大约为350 bp的片段,5’-RACE得到大约为450 bp的片段(图2)。重组质粒pMD18-T-3R和pMD18-T-5R经酶切验证,结果显示获得的条带与RACE PCR扩增得到的条带大小相符(图3)。
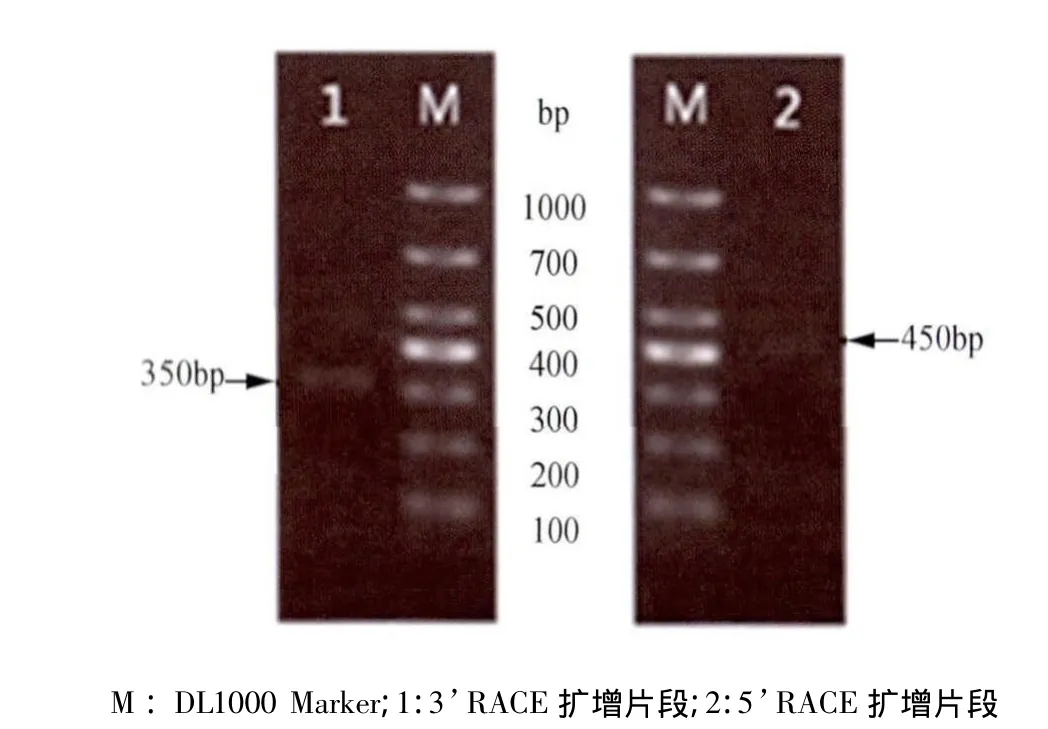
图2 MdL-1基因的3'和5'RACE扩增结果

图3 MdL-1基因3’R和5’R重组质粒酶切鉴定结果
2.4 MdL1全长基因的克隆 根据3’RACE和5’RACE序列拼接得到大小为537 bp的全长序列。MdL-1基因经PCR扩增,得到一条约为432 bp的片段。pMD18-T-MdL1重组质粒酶切验证显示,获得的条带与432 bp大小相符(图4)。
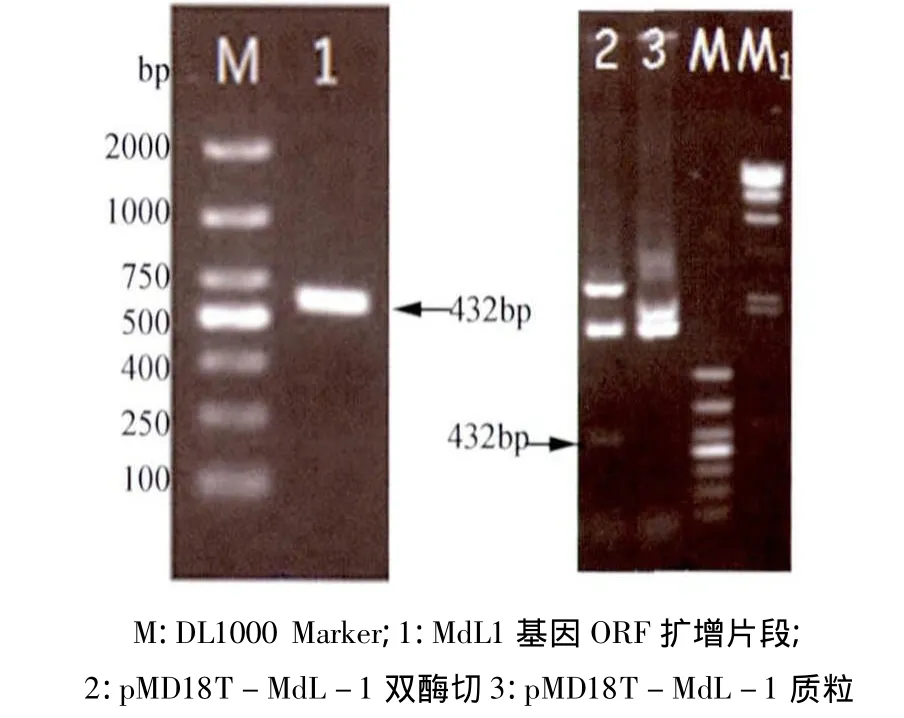
图4 MdL1基因ORF扩增结果和pMD18T-MdL-1双酶切鉴定图
2.5 序列分析 该基因全长为537 bp,ORF为432 bp,编码144个氨基酸,预测分子量为15.9 kD,等电点(pI)5.17。该序列与GenBank上部分核苷酸进行比较发现,与家蝇溶菌酶1基因的mRNA全序列(AY344589.1)同源性为96%。运用NCBI的CDD程序对MdL-1基因编码蛋白的保守区域进行搜索,结果显示扩增的MdL-1基因编码的蛋白质与溶菌酶家族保守区域一致(图5),并依此确定该基因为家蝇溶菌酶1基因。
2.6 pET-32a-MdL-1表达载体的构建 pET-32a-MdL-1重组质粒双酶切后,获得大小约为435 bp和5900 bp的片段(图6),分别为MdL-1和pET-32a(+)。表明MdL-1基因原核表达重组质粒构建成功。
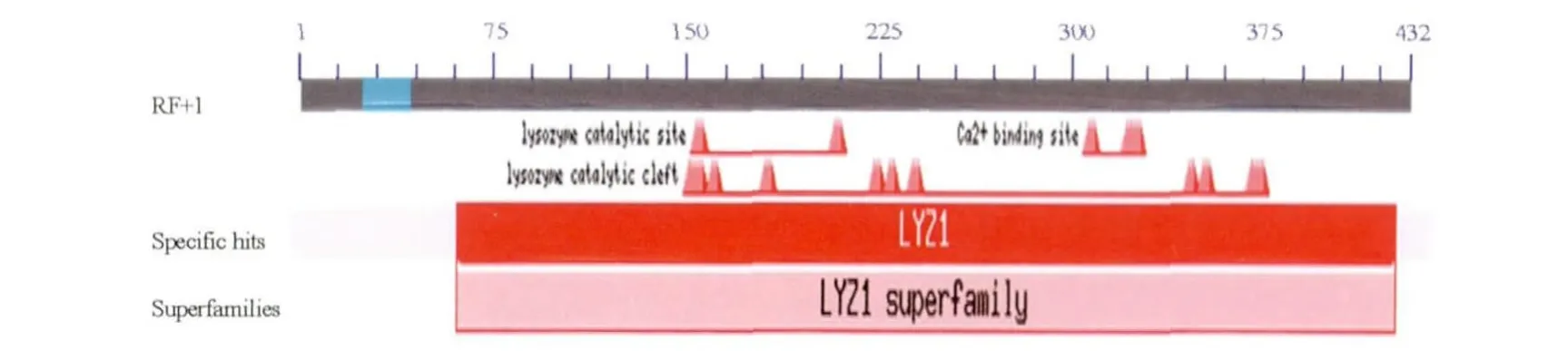
图5 MdL-1的保守结构域
2.7 材料重组质粒在大肠杆菌中表达产物的SDS-PAGE分析 MdL1的理论分子量约为15.9 kD,pET-32a(+)载体具有Trx标签蛋白,分子量约为18.4 kD。经过SDS-PAGE电泳检测,与空白对照菌株比较,在预期位置34 kD大小附近出现目的蛋白条带,超声波破碎后,电泳检测发现表达蛋白主要存在于沉淀中,以包涵体的形式存在,属于不溶性表达(图7)。

图6 MdL-1基因全长质粒重组体酶切鉴定结果

图7 重组质粒pET-32a(+)-MdL-1在大肠杆菌中的表达产物SDS-PAGE电泳分析
2.8 融合蛋白的纯化 纯化后的蛋白进行SDSPAGE电泳检测,得到分子量约为34 kD的融合蛋白条带(图8)。
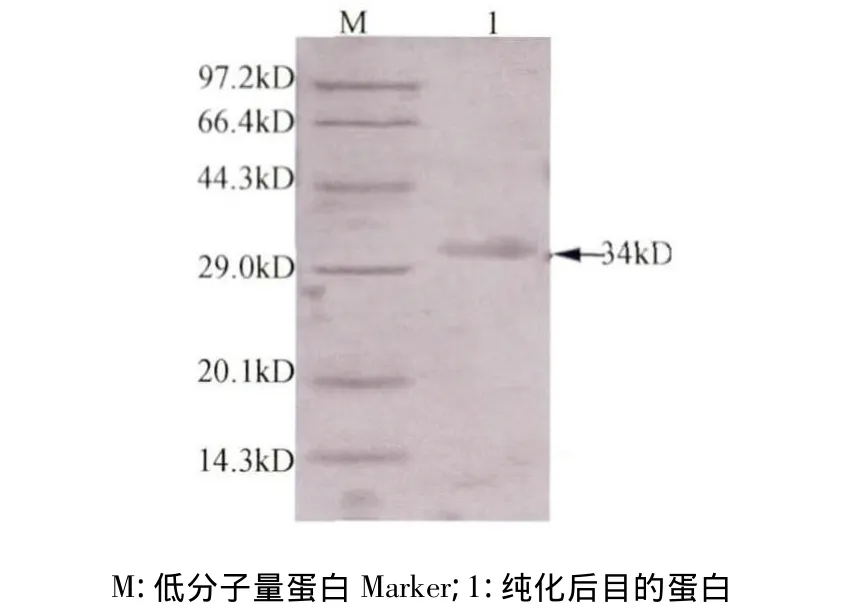
图8 纯化目的蛋白Trx-6His-MdL1
2.9 生物活性检测 实验以包涵体洗脱液为对照和纯化蛋白进行抑菌效果比较(图9)。

图9 纯化蛋白对大肠杆菌的抑菌试验
由图9可见,蛋白1对大肠杆菌的抑菌圈直径为11mm,而空白对照2没有抑菌圈,说明融合蛋白对大肠杆菌有一定的抑菌作用。
3 讨论
家蝇抗菌肽作为新型抗菌药物研究主要集中在家蝇防御素[8-9]、家蝇攻击素[10]、家蝇天蚕素[9]等方面,而对于家蝇溶菌酶的研究较少[11],对家蝇溶菌酶研究较多的是其消化作用方面[12]。Chimoy等从家蝇体内克隆得到溶菌酶基因MdL1(AY344589)和一条不完全的溶菌酶基因片段MdL2(AY344588),Cancado等利用毕赤酵母表达系统对MdL1和MdL2基因进行了重组表达并研究,认为这两种溶菌酶均与消化密切相关[13]。本文是对其抗菌活性和免疫活性进行研究。家蝇溶菌酶是生物体中非特异性免疫应答产物,对革兰氏阳性菌和革兰氏阴性菌均有较强的杀菌活性。本研究利用RACE技术,在5’和3’末端设计特异性引物,扩增出MdL1全长序列,与传统的克隆全长cDNA方法相比,不仅灵敏度高、特异性好、时间周期短,而且操作简单易懂[14]。MdL-1具有Lysozyme 1家族保守区域,其 ORF与GenBank中登录号为AY344589.1家蝇溶菌酶1基因同源性最高,达96%,存在5个氨基酸的差异。
大肠杆菌表达系统具有操作简单、外源基因表达产物水平高、培养周期短等特点,多被用于表达家蝇抗菌肽基因[15]。家蝇抗菌肽本身具有抗菌作用,在细菌中直接表达可能对宿主菌产生杀伤作用,因此多采用融合表达方式进行表达。pET-32a表达载体具有硫氧还蛋白(Trx)基因和6个组氨酸残基基因,可降低其对宿主菌的杀伤作用,提高目的蛋白表达量。本实验构建了家蝇溶菌酶1基因原核表达质粒pET-32a-MdL-1,并在大肠杆菌BL21中获得表达,蛋白主要以包涵体形式存在,避免了蛋白酶对其的降解作用,并且包涵体中杂蛋白含量较低。生物活性试验结果表明,表达产物对大肠杆菌具有一定的杀菌作用,为进一步研究MdL-1抗鸡致病性大肠杆菌活性及开发一种广谱高效的新型抗菌药物奠定了基础。
[1] Li Hongwei,Swerdlow D L,Jing H Q,et al.Study on diarrhea disease caused by enterohemorrhagic Eschirichia coli O157:H7 in Xuzhou city[J].Chin J Epidemiol,2002,23(2):119 -122.
[2] 刘栓奎,李 明,党荣理,等.致病性大肠杆菌和出血性大肠杆菌研究进展[J].现代预防医学,2011,38(24):5123 -5124.
[3] 周继章.抗菌肽抗病的研究进展[J].中国畜牧兽医,2012,39(7):204-208.
[4] 左红梅.大肠杆菌诱导家蝇幼虫抑制性消减文库构建及部分差异基因分析[D].长春:吉林农业大学,2011.
[5] Shimada J,Moon S K,Lee H Y,et al.Lysozyme M deficiency leads to an increased susceptibility to Streptococcus pneumoniainducedotitis media[J].Abmca Infect Dis,2008,8:134.
[6] 卢雪梅,金小宝,朱家勇,等.家蝇天蚕素-人溶菌酶融合蛋白的生物信息学分析[J].广东药学报,2012,28(2):192-195.
[7] 谢 慧.仿生鲶鱼抗菌肽的克隆、表达与活性检测[D].无锡:江南大学,2005.
[8] 王来城,王金星,赵小凡,等.家蝇防御素在大肠杆菌中的表达、纯化与抗体制备[J].动物学报,2005,51(2):327 -334.
[9] Rao X C,Li S,Hu J C,et al.A novel carrier molecule for high- level expression of peptide antibiotics in Escherichia coli.Protein Exp[J].Purif,2004,36:11 -18.
[10]柳峰松,孙玲玲,唐 婷,等.家蝇抗菌肽Attacin-2基因的克隆、序列分析和诱导表达[J].昆虫学报,2011,54(1):27-33.
[11]郑 立,李 娟,郭亚伟,等.家蝇溶菌酶2基因的克隆及其性质研究[J].四川动物,2011,30(5):705 -710.
[12] Lemons FJA,Ribeiro A F,Terra W A.A bacteria- digesting midgut-lysozyme from Musca domestica(Diptera)larvae purification,proper- ties and secretory mechanism[J].Insect Biochem Mol Biol,1993,23:533 -541.
[13] Cancado F C,Chimoy Effio P,Terra W R,et al.Cloning,purification and comparative characterization of two digestive lysozymes from Musca domestica larvae[J].Brazilian Journal of Medical and Biological Research,2008,41:969 -977.
[14] Diffenbach C W,Dveksler G S.PCR Primer:A Laboratory Manjual[M].New York:Cold Spring Harbor Laboratory Press,1995:268-288.
[15]夏丽洁,刘忠渊,许 岗,等.家蚕抗菌肽Cecropin-XJ的原核优化表达及活性检测[J].蚕业科学,2012,38(5):825 -831.

