恩诺沙星分子印迹聚合物的制备及表征
刘俊渤,王艳玲,唐珊珊,常海波,梁大栋
(吉林农业大学资源与环境学院,长春130118)
近年来,分子印迹聚合物(MIPs)因其具有良好的物理和化学稳定性[1],较高的亲合性和灵敏度[2-3],可从复杂基质中快速分离、纯化及富集待测物而被作为选择性固相萃取吸附剂材料应用于食品安全监测领域[4-6]。实际合成 MIPs过程中,模板分子与功能单体的结合过程是MIPs制备的关键步骤,尤其是两者的比例直接影响MIPs的吸附性及选择性[7-8]。目前,文献中恩诺沙星分子印迹聚合物(ENRO-MIPs)制备多采用甲基丙烯酸(MAA)作为功能单体,恩诺沙星(ENRO)与MAA的比例分别为 1∶4[9-10]、1∶6[11]或 1∶8[12-13],存在较大差异。因此本研究以ENRO为模板分子,MAA为功能单体,采用沉淀聚合法合成ENRO-MIPs,优化模板分子与功能单体的比例、溶剂种类及溶剂用量,并通过静态吸附法研究MIPs的吸附性与选择性。
1 材料与方法
1.1 试剂与仪器 ENRO、CIP和 OFL,纯度 >98%,上海源叶生物科技有限公司;MAA、偶氮二异丁腈(AIBN)、乙腈(ACN)、二甲基丙烯酸乙二醇酯(EDMA)、N,N-二甲基甲酰胺(DMF)、三氯甲烷、甲苯、甲醇、乙酸、磷酸,均为分析纯。T6新世纪紫外可见分光光度计、HH-S恒温水浴锅、THZ-82A型水浴恒温振荡器、KQ5200DE型数控超声波清洗器、FA2104N电子天平、DZF-6020真空干燥箱、JSM-6510扫描电子显微镜。
1.2 MIPs和NIPs的制备 称取一定比例的ENRO和MAA于溶剂中超声溶解,静置24 h,再加入一定量的EDMA(功能单体MAA与交联剂EDMA的摩尔比为1∶5)和50 mg的AIBN,超声30 min,充氮脱氧,密封,置于60℃水浴锅中反应24 h。反应结束后将聚合产物离心,用乙酸/甲醇(2/8,V/V)溶液索氏提取,直至洗脱的溶液中检测不到ENRO为止,再用甲醇洗至中性,处理完毕后50℃真空干燥至恒重,得到MIPs。
NIPs制备过程除不加模板分子ENRO外,其余过程与其MIPs制备条件相同。
1.3 MIPs和NIPs的静态吸附性试验 称取20.0 mg已洗脱、干燥的MIPs,置于50 mL具塞三角瓶中,加入5 mL不同浓度ENRO溶液,放入28℃恒温振荡器中振荡20 h,取上清液用0.22 μm的滤头过滤,稀释一定的浓度,用紫外分光光度计测定ENRO的游离浓度,根据结合前后ENRO浓度的变化计算MIPs对ENRO的结合量Q。NIPs的结合量Q的变化测定方法与MIPs一致。
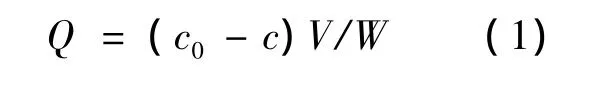
其中,Q为MIPs(或NIPs)对ENRO的吸附量(mg/g),c0、c分别为ENRO的初始浓度和吸附后的浓度(mg/L),V为吸附溶剂的体积(mL),W为MIPs(或NIPs)微球的质量(mg)。
1.4 MIPs和NIPs的选择性试验 称取20 mg洗脱、干燥后的纳米聚合物(MIPs或NIPs),分别加入到5 mL初始浓度为100 mg/L的CIP、OFL与ENRO的溶液中,28℃恒温水浴振荡器中振荡20 h。吸附平衡后用0.22 μm的滤头过滤,稀释一定的浓度,在不同吸光度条件下测定溶液中CIP、OFL与ENRO的游离浓度(OFL在295 nm,CIP在275 nm,ENRO在278 nm)。平行测定3次,取平均值。
1.5 MIPs循环利用试验 称取20.0 mg的MIPs,置于50 mL具塞三角瓶中,加入5 mL不同浓度ENRO-磷酸溶液,放入28℃恒温振荡器中振荡,20 h后用紫外分光光度计测定平衡浓度,并将达到饱和的MIPs回收,用乙酸/甲醇(2/8,V/V)溶液洗脱,再用甲醇洗至中性,处理完毕后50℃真空干燥至恒重。重复上述步骤,研究MIPs的使用寿命以及反复利用的吸附效果。
1.6 MIPs和 NIPs的表征 用甲醇将 MIPs(或NIPs)溶液稀释到一定浓度,超声30 min,滴于硅片上,自然烘干后喷金,采用JSM-6510扫描电镜观测MIPs(或NIPs)微球的大小及形貌,并用Nano Measurer 1.2软件统计微球粒径。同时采用Spectrum 100红外光谱仪对制备的MIPs(或NIPs)进行表征。
2 结果与讨论
2.1 MIPs的制备
2.1.1 模板分子与功能单体比例的优化 固定其他条件,改变模板分子与功能单体的比例分别为1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7 和1∶8,测定不同比例MIPs的吸附量,见图1。图1可以明显看出模板与功能单体比例为1∶4的MIPs吸附量最大。这说明分子印迹过程中模板分子与功能单体比例的选择非常重要,它不仅影响印迹分子的键合速度与释出,而且还制约着MIPs的吸附性。ENRO与MAA最佳结合比例为1∶4的MIPs结构见图2。
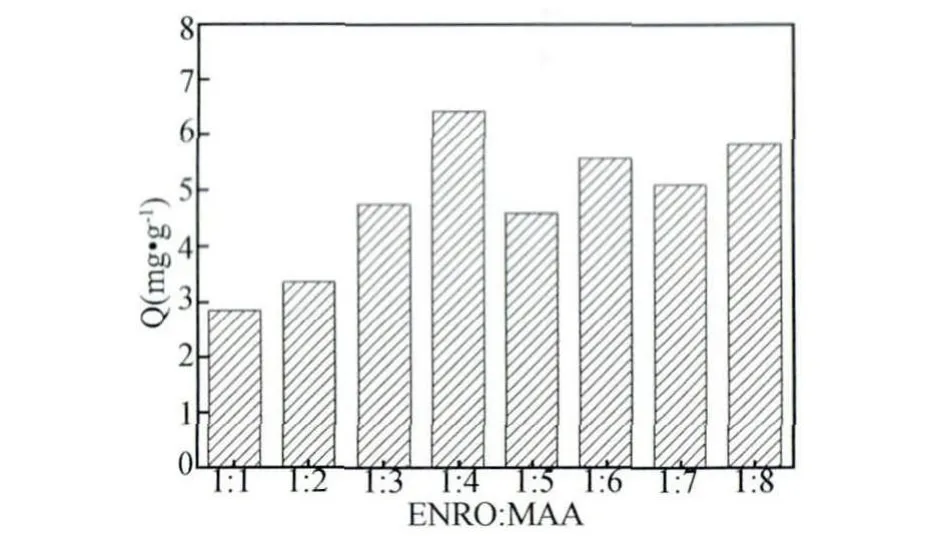
图1 ENRO与MAA不同比例MIPs的吸附量
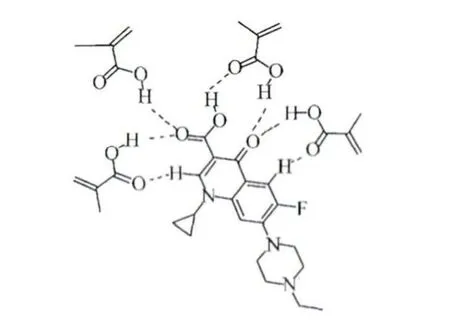
图2 ENRO与MAA1∶4比例的MIPs结构
2.1.2 溶剂种类及用量的优化 试验讨论了甲苯、三氯甲烷、DMF及ACN四种溶剂对微球形态与粒径大小的影响。试验结果显示:甲苯对于ENRO溶解性极差,以三氯甲烷为溶剂得到油状MIPs,以DMF为溶剂生成的MIPs呈凝胶状态,而以ACN为溶剂制备的MIPs体系为分散均匀、稳定,体系粘度低的乳液。沉淀聚合制备MIPs过程中,溶剂对MIPs微球形态与粒径大小起关键作用[14-15]。所选用的溶剂必须能溶解功能单体、模板分子、交联剂等,但对MIPs不溶才能使MIPs沉淀成核,而所选用的溶剂对MIPs的溶解性太好或者太差都会导致MIPs形成微凝胶或者不规则微粒。
沉淀聚合的机理决定了反应溶剂的体积对MIPs的形成起到关键作用[16],溶剂量少会导致MIPs结块,即本体聚合;溶剂量太大,会导致聚合度过低不能形成微球沉淀或者微球形态不均。试验改变ACN的用量(15、30、45 mL)制备 ENROMIPs,其扫描电镜见图3。当 ACN用量为15 mL,MIPs(图3A)分散性不好,粘连度高,几乎成块状,微粒不规则且粒径大,其吸附量为4.02 mg/g;当ACN用量为30 mL,MIPs(图3B)分散性好,大小均一,近似球形,且粒径小,吸附量增加,为6.28 mg/g;当ACN用量为45 mL,MIPs(图3C)微球大小不均,粒径范围较宽(130~270 nm),合成率低,其吸附量为4.78 mg/g。所以,在试验的条件下,优化ACN的最佳用量为30 mL。

图3 MIPs在不同溶剂ACN用量条件下的扫描电镜图
2.2 MIPs和NIPs的电镜表征 利用扫描电子显微镜对制备得到的MIPs(图4A)和NIPs(图4B)进行表征。通过Nano Measurer1.2软件统计,MIPs的粒径范围是190~290 nm,而NIPs的粒径在120~230 nm。这说明模板分子ENRO占有一定的空间,洗脱之后留下特异性识别的孔穴。

图4 MIPs和NIPs的扫描电镜照片
2.3 红外分析 红外光谱可反映MIPs的结构信息,MIPs和NIPs红外光谱见图5。从图中可以看出,MIPs和NIPs红外光谱相近,但单体MAA特征基团C=O、O-H振动峰的位置、宽度和强度有明显差别。1740 cm-1处是C=O振动吸收峰,ENRO模板分子加入形成ENRO-MIPs后,上述谱带红移至1729 cm-1处,这是因MAA分子中的C=O与ENRO的质子给体C-H或O-H形成氢键,使C=O键弱化所致(图2)。图5还可看到,NIPs在3450 cm-1处有羧酸中O-H的伸缩振动吸收峰,而MIPs中OH的吸收峰在3436 cm-1,其吸收峰不仅加宽、增强且谱带向低频率方向红移了14 cm-1,这表明单体MAA分子中的质子给体O-H与模板ENRO分子的质子受体C=O可形成较强的氢键(图2)。

图5 MIPs和NIPs的红外图谱
2.4 ENRO-MIPs的吸附性能 使用静态吸附法测定MIPs和NIPs对不同浓度的ENRO的吸附等温线,见图6。从图6可以看出,在ENRO的初始浓度为800 mg/L时,无论是MIPs还是NIPs都达到最大饱和吸附量。MIPs最大饱和吸附量为25.07 mg/g,NIPs最大饱和吸附量为13.05 mg/g。随着ENRO浓度的增加,MIPs和NIPs对ENRO的吸附量逐渐增加,且在相同初始浓度下单位质量MIPs的吸附量远大于单位质量NIPs的吸附量,这表明MIPs对ENRO具有较好的印迹效果。两者吸附量的差别主要是因为MIPs纳米微球中存在特异的结合位点,选择了在氢键作用活性位点、分子大小及空间结构互补的印迹分子ENRO,因此吸附主要以特异性吸附为主,而NIPs只能依靠非特异性吸附,吸附能力较弱。
在分子印迹的研究中,通常用Scatchard来分析制备的MIPs的结合性能,Scatchard方程式为:

其中c为溶液吸附平衡浓度(mg/L),Q为平衡吸附量(mg/g),Qmax最大饱和吸附量,Kd为平衡离解常数。
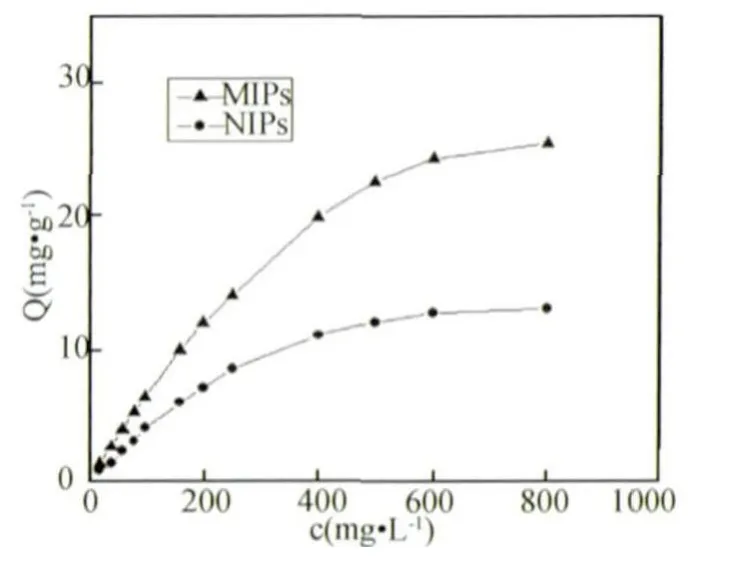
图6 MIPs和NIPs对ENRO的静态吸附性
以Q为横坐标,Q/c为纵坐标作图,得到Scatchard分析图(图7)。由图7可以看出,Q/c对Q呈非线性关系,表明在所研究的ENRO浓度范围内,MIPs主要存在两个结合位点。其拟合的线性方程分别为Q/c=150.2547-4.3228Q和Q/c=98.3218-1.7119Q,由直线的斜率和截距可以得到高亲和性位点的离解常数为Kd1=0.2313 g/L,最大表观结合量Qmax1=34.7540 mg/g;低亲和性位点的离解常数为Kd2=0.5841 g/L,最大表观结合量 Qmax2=57.4298 mg/g。与已有文献[17]相比,该条件下制备的MIPs具有更好的结合性。

图7 MIPs对ENRO的Scatchard分析图
2.5 选择吸附性能研究 为了进一步研究制备的MIPs和NIPs对ENRO的选择吸附性。本试验选择了与ENRO结构相似的CIP和OFL作为底物,利用等温平衡吸附的方法测定MIPs和NIPs对ENRO、CIP和OFL的吸附量,结果如图8。
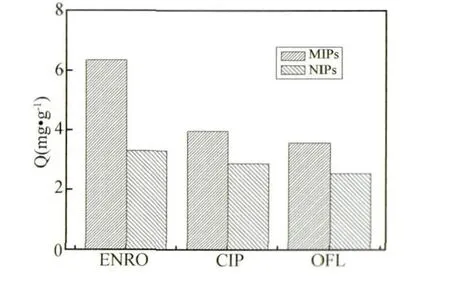
图8 MIPs与NIPs对ENRO、CIP和OFL的选择吸附性
从图8可以看出,MIPs对ENRO的吸附性明显高于MIPs对CIP、OFL的吸附性,表现出较强的特异吸附行为。而NIPs对ENRO、CIP、OFL三者的吸附量很接近,表明其吸附是广泛的,没有选择性。MIPs和NIPs的这种差异表明它们之间的结构显著不同,原因在于MIPs中存在着与模板分子ENRO空间结构和官能团的结合位点相互补的孔穴。这些孔穴对模板分子ENRO表现出特异的吸附能力,而在NIPs合成时没加模板分子,也就没有空间结构互补的孔穴,所以只表现出一般的吸附性。
2.6 MIPs的循环使用性能 采用相同的洗脱处理方法,经过反复的吸附-洗脱试验研究了MIPs循环使用性能,表1为MIPs的使用次数、MIPs对ENRO的吸附量以及MIPs的回收损失率。在使用四次后MIPs的吸附率为92.05%,说明MIPs可以反复使用。
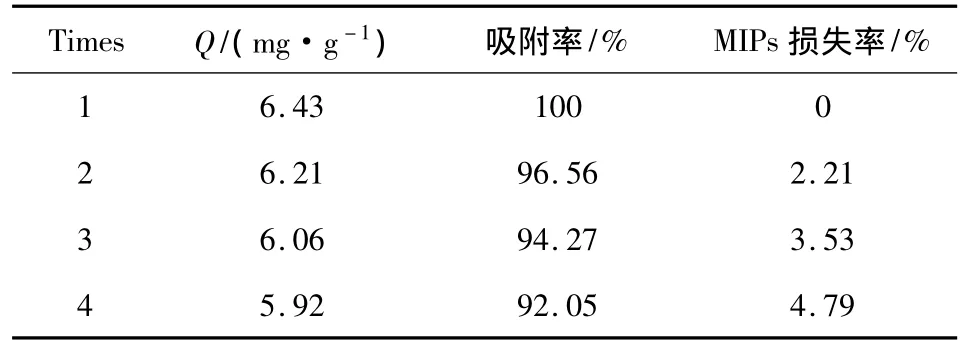
表1 MIPs的循环使用性
3 结论
采用沉淀聚合法合成ENRO-MIPs,优化模板分子与功能单体的比例、溶剂种类及溶剂用量。按最佳比例1∶4合成的MIPs对ENRO模板分子表现较强的特异性吸附能力,且离解平衡常数和最大表观结合量分别为 Kd1=0.2313 g/L、Qmax1=34.7540 mg/g、Kd2=0.5841 g/L、Qmax2=57.4298 mg/g,且具有较好的循环使用性。本研究为ENRO-MIPs的选择性分离、富集和检测复杂基质食品样品中的ENRO提供了参考依据。
[1] Li X X,Bai L H,Wang H,et al.Preparation and characterization of enrofloxacin-imprinted monolith prepared with crowding agents[J].J Chromatogr A,2012,1251:141 -147.
[2] Kryscio D R,Peppas N A,Critical review and perspective of macromolecularly imprinted polymers[J].Acta Biomaterialia,2012,8(2):461-473.
[3] Blasco C,Picó Y.Development of an Improved Method for Trace Analysis of Quinolones in Eggs of Laying Hens and Wildlife Species Using Molecularly Imprinted Polymers[J].J Agric Food Chem,2012,60:11005-11014.
[4] Xu Z X,Gao H J,Zhang L M,et al.The biomimetic immunoassay based on molecularly imprinted polymer:a comprehensive review of recent progress and future prospects[J].J Food Sci,2011.76(2):R69-R75.
[5] Blasco C,Picó Y,Development of an Improved Method for Trace Analysis of Quinolones in Eggs of Laying Hens and Wildlife Species Using Molecularly Imprinted Polymers[J].J Agric Food Chem,2012,60:11005-11014.
[6] Fuchs Y,Soppera O,Haupt K.Photopolymerization and photost ructuring of molecularly imprinted polymers for sensor applications-A review[J].Analytica Chimica Acta,2012,717:7 -20.
[7] Liu J B,Sun J N,Tang S S,et al.Theoretical researches on the recognizing characteristics of atrazine imprinted polymers with different functional monomers[J].Chinese J Struct Chem,2012,31(12):1794-1802.
[8] Zhang Z C,Cheng Z Q,Zhang C F,et al.Precipitation Polymerization of Molecularly Imprinted Polymers for Recognition of Melamine Molecule[J].J Appl Polym Sci,2012,123(2):962 -967.
[9] Recillas Mota J J,Bernad Bernad M J,Mayoral- Murillo J A,et al.Synthesis and characterization of molecularly imprinted polymers with metallic zinc center for enrofloxacin recognition[J].React Funct Polym,2013,73(8):1078-1085.
[10] Lu Y K,Liu Y,Bian C,et al.Preparation and evaluation of molecularly imprinted monolithic column for liquid chromatographic determination of enrofloxacin in eggs[J].CJI,2009,11(5):26.
[11]汪雪雁,檀华蓉,祁克宗,等.分子印迹固相萃取-高效毛细管电泳法检测鸡肉中的恩诺沙星残留[J].色谱,2010,28(11):1107-1110.
[12] Caro E,Marc’e R M,Cormack P A G,et al.Novel enrofloxacin imprinted polymer applied to the solid-phase extraction of fluorinated quinolones from urine and tissue samples[J].Anal Chim Acta,2006,562(2):145-151.
[13] Ton X A,Acha V,Haupt K,et al.Direct fluorimetric sensing of UV-excited analytes in biological and environmental samples usingmolecularly imprinted polymer nanoparticles and fluorescence polarization[J].Biosens Bioelectron,2012,36(1):22 -28.
[14] Dong W G,Yan M,Liu Z,et al.Effects of solvents on the adsorption selectivity of molecularly imprinted polymers:Molecular simulation and experimental validation[J].Sep Purif Technol,2007,53(2):183-188.
[15]侯彦飞,陈 萍,任常菲.雌二醇分子印迹聚合物的合成及其吸附性能研究[J].中国兽药杂志,2011,45(11):12-15.
[16] Cormack P A G.,Elorza A Z.Molecularly imprinted polymers:synthesis and characterisation[J].J Chromatogr B,2004,804(1):173-182.
[17]张 毅,董襄朝.活性/可控自由基聚合制备恩诺沙星印迹微球及识别性能研究[J].分析测试学报,2008,27(10):1025-1030.

