超高效液相色谱-串联质谱法研究克伦特罗在绒山羊体内消除规律
王丽娜,刘 凯,李延山,杜柏林,张 明
(辽宁省兽药饲料畜产品质量安全检测中心,沈阳110016)
克伦特罗添加到饲料中,能有效地促进畜禽蛋白质合成和肌肉组织生长,减少皮下脂肪的沉积,提高瘦肉率和饲料转化率[1],在畜禽养殖中具有可观的经济效益。由于利益的驱动,在畜牧养殖环节出现了以克伦特罗为代表的β-受体激动剂(俗称“瘦肉精”)的滥用,导致其在动物体内蓄积残留,消费者购买带有药物残留的畜禽产品就会引起急性中毒[2]。近年来,国内外发生了多起由于食用了瘦肉精饲喂的动物产品而导致的中毒事件,中毒事件的不断发生使得各国相继出台禁令。农业部于1997年3月[农牧发(1997)]3号文严令禁止克伦特罗等β-激动剂在动物生产中的应用。目前有文献[1]报道猪体内克伦特罗的残留消除规律,尚未见克伦特罗在绒山羊体内消除规律研究的报道。本研究建立了检测绒山羊尿液、肝脏、肾脏、肺脏、肌肉中克伦特罗的UPLC-MS/MS方法,并对克伦特罗在绒山羊体内的消除规律进行了系统研究。
1 材料与方法
1.1 实验动物与样品采集 参照文献[3-5]报道,选取体重约为(30±4.8)kg绒山羊60只,随机分为2组(A、B组),每组30只。常规饲养,自由饮水,饲料为配合日粮。A组给药浓度为150 μg/kg b.w.,B 组给药浓度为300 μg/kg b.w.。连续给药25 d后停药。停药后第1天、第3天、第5天、第7天、第10天、第15天 、第20天、第25天、第30天、第40天每组每个测试时间点随机取3只宰杀,每只动物取上述4种组织样品(肝脏、肺、肾脏、肌肉)。每组随机取8只绒山羊,每天对其尿液进行监测。
1.2 仪器与材料 液相色谱-串联质谱仪:Waters Quattro premierXE;高速冷冻离心机(Biofuge STRATOS Centrifuge);均质器(PRO250);氮吹仪(OASYS);MilliQ超纯水器(美国Millipore公司);甲醇、甲酸、氨水、高氯酸、MCX固相萃取小柱。
1.3 仪器条件 根据文献[6-7]方法,仪器条件如下。色谱柱:BEH C18(50 mm ×2.1 mm,1.7 μm)。流动相A:甲醇;B:0.1%甲酸水溶液;流速0.3 mL/min。梯度洗脱程序,0~5.0 min,4%A 线性变化至 60%,5.0 ~5.1 min,60%A 线性变化至40%A,5.1~6.0 min维持4%A。柱温40 ℃,进样量10 μL。
电喷雾正离子扫描(ESI+);监测方式:多反应监测(MRM);电压3.2 kV;源温120℃;雾化气温度350℃;锥孔气流速50 L/h;雾化气流速650 L/h;定性定量离子对及锥孔电压、碰撞能量见表1。

表1 克伦特罗及其内标定性、定量离子对及碰撞电压、锥孔电压表
1.4 溶液的配制
1.4.1 标准溶液的配制 精密称取克伦特罗对照品,以甲醇为溶剂配成浓度各约1 mg/mL标准储备液,2~8℃冷藏保存。准确吸取适量上述标准储备液,用0.2%甲酸水溶液稀释成浓度为10 μg/L对照品标准工作液。
1.4.2 内标溶液配制 精密称取克伦特罗-D9同位素内标,以甲醇为溶剂配成浓度约为10 mg/mL的同位素内标储备液。取同位素内标储备液,用0.2%甲酸水溶液稀释成浓度为40 μg/L对照品标准液,2~8℃冷藏保存,有效期1个月。
1.5 样品的提取与净化[3]
1.5.1 提取 取尿液5.0 mL(组织2.00 g)于50 mL离心管中,添加内标工作液100 μL,充分混匀。加入40 μL β-葡萄糖醛酸-芳基硫酸酯酶,15 mL 0.2 mol/L 醋酸铵缓冲溶液(pH 5.2),37.0 ℃震荡水浴16 h,加入0.5 mL高氯酸,涡旋混匀,10000 r/min离心5 min。
1.5.2 净化 固相萃取小柱用3 mL甲醇、3 mL水、3 mL 2%甲酸水溶液活化,将上述提取液全部过柱,3 mL 2%甲酸水溶液,3 mL甲醇淋洗。空气抽干。5 mL 5%氨水甲醇溶液洗脱。收集洗脱液,40℃氮气吹干后,1.0 mL 0.2%甲酸水溶液溶解,经 0.22 μm 水系微孔滤膜过滤后,供UPLC-MS/MS分析。
2 结果与讨论
2.1 分析条件的优化 β-受体激动剂在C18柱上的保留性较好,本研究比较了几种类型的C18色谱柱 ACQUITY UPLC BEH C18 1.7 μm、ACQUITY UPLC HSS C18、ACQUITY UPLC HSS T3 柱的分析结果,结果显示,ACQUITY UPLC BEH C18上的保留时间及分离度均比较理想,因此选择该柱为分析柱。先后采用乙腈和水、甲醇和0.1%甲酸溶液[6]、乙腈和0.1%甲酸溶液[7]、甲醇和水、甲醇和5 mmol/L乙酸铵几种流动相进行分析,结果显示流动相为甲醇和0.1%甲酸溶液时灵敏度最高、重复性最好。因此选择甲醇和0.1%甲酸溶液为流动相。
用500 μg/L的激动剂标准溶液以流动注射的方式分别用ESI+和ESI-模式进行全扫描,发现克伦特罗在ESI+电离模式下响应值大大高于ESI-模式下的响应值,因此采用ESI+电离模式。对毛细管电压进行优化,结果在3.2 kV响应值最大,对母离子产生的子离子及碰撞能量进行优化,从中选出丰度较高的子离子作为定性和定量离子。
2.2 方法学考察
2.2.1 方法专属性考察 对照品溶液色谱图见图1。取空白样品,按1.5项操作,得图2~图6。在上述条件下,样品杂质无干扰,专属性良好。
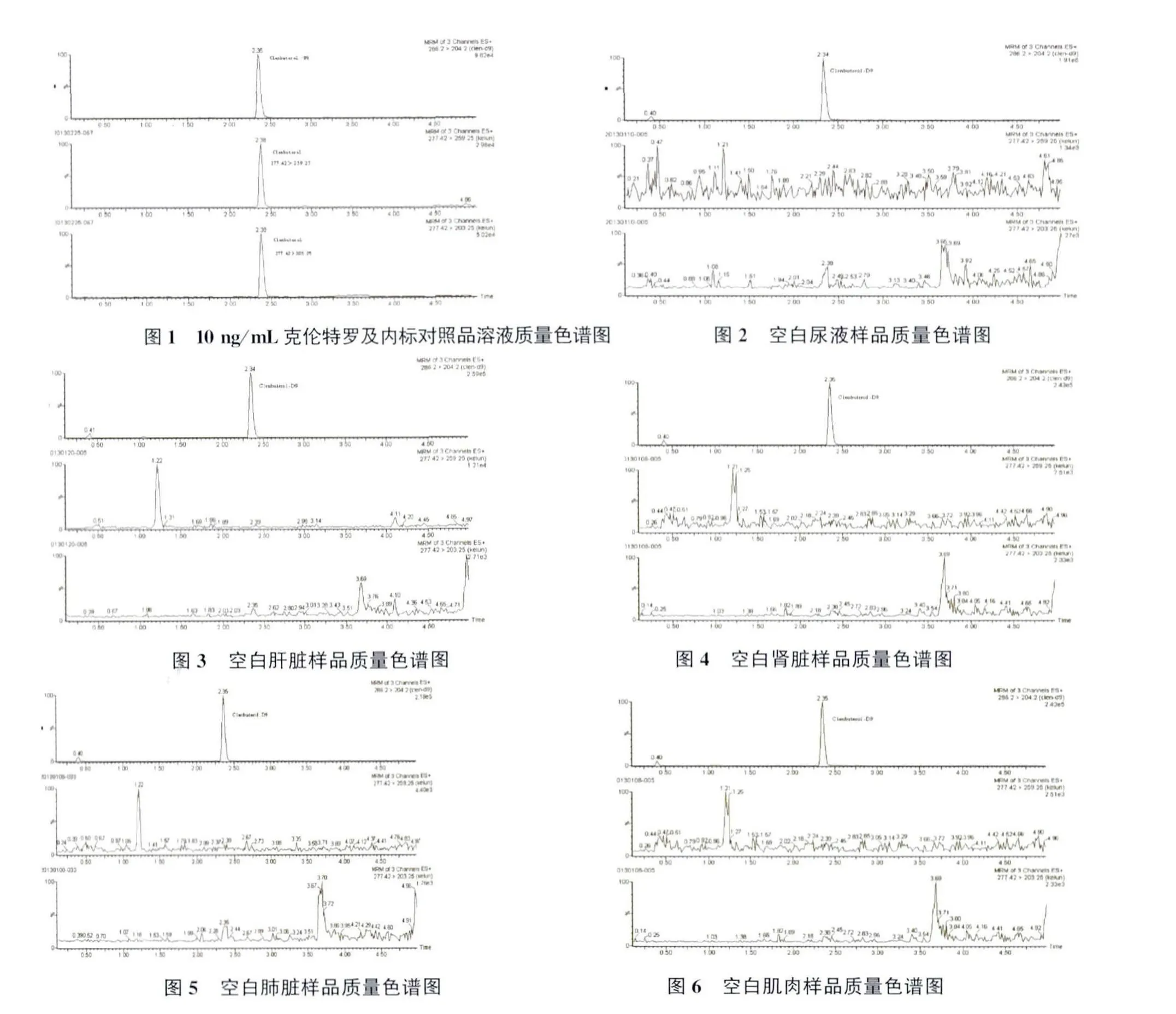
2.2.2 线性范围、检出限、定量限 配置标准曲线,浓度分别为 0.5、1、5、10、25、50、100 μg/L,以待测物浓度为横坐标(X,μg/L),以标准溶液中被测组分峰与内标面积的比值为纵坐标(Y),进行回归运算。Y=1.168X+1.346,r2=0.998(n=2)。当添加0.1 μg/L 克伦特罗时,信/噪(S/N)比大于3,检测限为0.1 μg/L。取空白样品制备添加浓度0.2 μg/L 样品(n=6),信/噪(S/N)比均大于 10,因此定量限为 0.2 μg/L(图7、图8)。
2.2.3 方法的精密度 按1.5项操作,制备低、中、高三个浓度水平,分别为 0.2、0.4、2(尿液为μg/L,其他组织为μg/kg)的质量控制(QC)样品,每一浓度进行6样本分析,根据当日的标准曲线,进行样品的浓度测定。结果表明,精密度在2.5%~18.9%(表2)之间。
2.2.4 回收率试验 按1.5项操作,制备低、中、高三个浓度水平,分别为0.2、0.4、2(尿液为 μg/L,其他组织为μg/kg)的质量控制(QC)样品,每一浓度进行6样本分析,根据当日的标准曲线,进行样品的浓度测定。结果表明,回收率在87.5% ~116.1%(表2)之间。
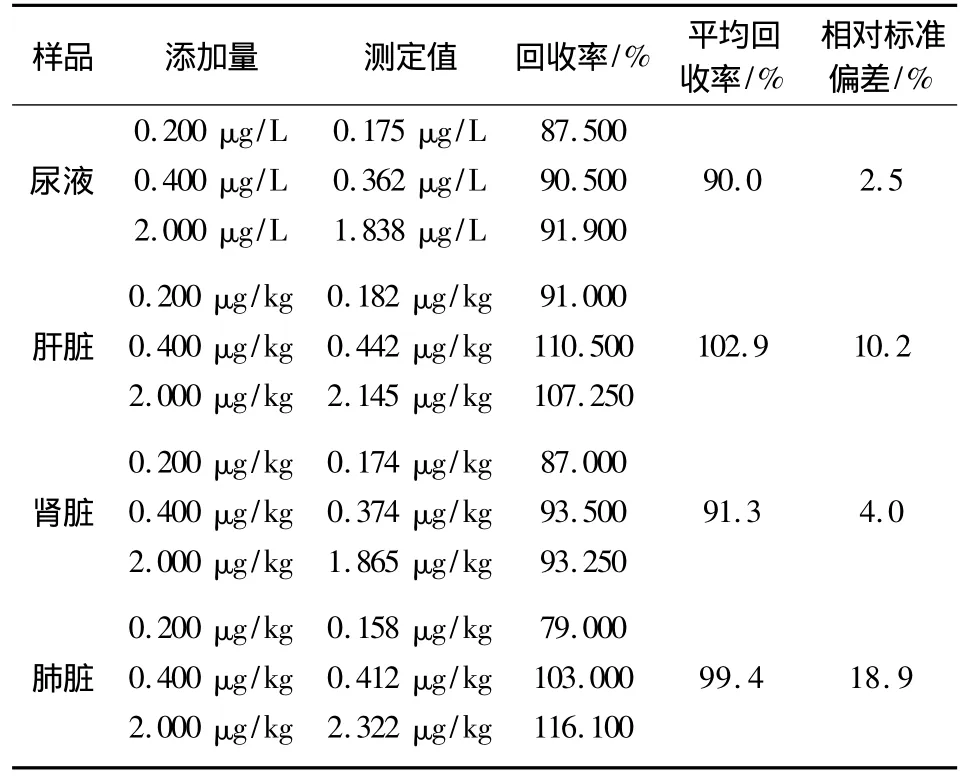
表2 尿液与组织添加回收率结果(n=6)
2.3 消除规律研究
2.3.1 绒山羊给药阶段盐酸克伦特罗在尿液中消除规律 A组给药后24 h内能在尿液中检测到克伦特罗,而且浓度高达289 ng/mL。随着给药次数的增加,通过尿液排出的克伦特罗含量持续升高,直到给药后第11天,达到第一次峰值,为5313 ng/mL,随后尿液中克伦特罗浓度呈较平稳的变化趋势,直到给药后第22天,尿液中克伦特罗浓度达到第二次峰值,为3825 ng/mL。B组给药后24 h内在尿液中检测到克伦特罗,浓度高达1323 ng/mL,直到给药后第9天,尿液中克伦特罗浓度达到第一次峰值,为11378 ng/mL,随后尿液中克伦特罗浓度呈较平稳的变化趋势,直到给药后第23天,尿液中克伦特罗浓度达到第二次峰值,为6890 ng/mL。A、B两组代谢规律见图9(n=8,RSD≤48.7%),数据浓度偏差较大可能是由于绒山羊个体差异以及饲喂方式导致。
2.3.2 绒山羊停药阶段盐酸克伦特罗在尿液中消除规律 停药后尿液中残留的克伦特罗浓度持续降低,降至第40天后A组尿液残留浓度约9 μg/L,B组尿液残留浓度约6 μg/L。出现A组尿液中部分克伦特罗残留浓度大于B组,以及数据浓度偏差较大,可能是由于绒山羊个体差异以及饲喂方式导致。残留趋势线见图10(n=3,RSD≤54.3%)。
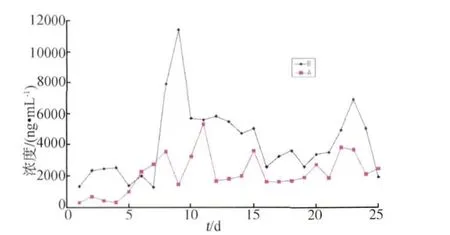
图9 饲喂阶段羊尿液中克伦特罗含量(n=8)
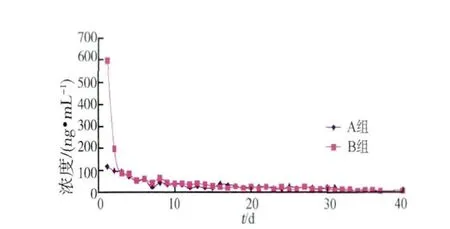
图10 停药阶段羊尿液中克伦特罗含量(n=3)
2.3.3 绒山羊停药后盐酸克伦特罗在组织中消除规律 停药后第1天、第3天、第5天、第7天 、第10天、第15天 、第20天、第25天、第30天、第40天每组每个测试时间点随机取3只宰杀,每只动物取上述4种组织样品(肝脏、肺脏、肾脏、肌肉)。各组织残留数据见表3。

表3 绒山羊停药阶段各组织中盐酸克伦特罗残留浓度
结果表明绒山羊肝脏、肌肉、肺脏、肾脏中均能检测到克伦特罗残留。不同组织中克伦特罗残留浓度不同。停药1 d,各组织中残留浓度依次为肝脏>肾脏>肺脏>肌肉。由于克伦特罗在不同的组织中消除速率不同,停药第15天后,A组肝脏浓度下降了约8倍,肾脏浓度下降了约68倍,肺脏浓度下降了约26倍,肌肉浓度下降了约16倍;B组肝脏浓度下降了约12倍,肾脏浓度下降了约108倍,肺脏浓度下降了约41倍,肌肉浓度下降了约15倍,从而得出各组织消除速率为肾脏>肺脏>肌肉>肝脏。克伦特罗在羊肝脏中消除最慢,在肾脏中消除最快。
3 结论
本试验建立了专属、灵敏的UPLC-MS/MS检测方法,并研究了克伦特罗在绒山羊尿液及各组织中的消除规律。结果显示,绒山羊的尿液、肝脏、肌肉、肺脏、肾脏中均能检测到克伦特罗残留,并在停药后需较长时间消除。停药后尿液中残留的克伦特罗浓度持续降低,降至第40天后A组尿液残留浓度约9 μg/L,B组尿液残留浓度约6 μg/L。出现A组尿液中部分克伦特罗残留浓度大于B组,可能是由于绒山羊个体差异以及饲喂方式导致。停药40 d后,A、B两组肝脏、肾脏均能检测到克伦特罗残留,肺脏和肌肉未检出。
[1] 方炳虎,陈杖榴,黄显会.克伦特罗在猪体内的生物利用度及药物动力学研究[J].畜牧兽医学报,1997,28(3):233 -237.
[2] 张园园,吴永宁.克伦特罗的毒性作用及其中毒机制[J].卫生研究,2002,31(4):328-330.
[3] 杨 静.肉羊组织中盐酸克伦特罗检测方法及代谢残留规律的研究[D].北京:中国农业科学院,2011.
[4] 吕 燕,鲍伟华,余小华,等.GC-MS法研究猪体内克仑特罗的残留消除规律[J].中国兽药杂志,2009,43(11):26 -29.
[5] 吴泽君,龙凌云,郭世明.高效液相色谱-串联质谱法研究猪毛发中克仑特罗和莱克多巴胺的残留及代谢规律[J].中国兽药杂志,2010,44(8):22 -26.
[6] 农业部1063号公告-3-2008.动物尿液中11种β—受体激动剂的检测 液相色谱-串联质谱法[S].
[7] 农业部1025号公告-18-2008.动物源性食品中β-受体激动剂残留检测液相色谱-串联质谱法[S].

