血管抑素和内皮细胞抑制素在血管增生性皮肤病中的表达及意义
张平 李琳 李凯 程杨 姜砚 王向东 陈柳青 王玮蓁
血管抑素和内皮细胞抑制素在血管增生性皮肤病中的表达及意义
张平 李琳 李凯 程杨 姜砚 王向东 陈柳青 王玮蓁
目的分析不同类型血管增生性皮肤病中血管抑素(AS)和内皮细胞抑制素(ES)的表达情况。方法选取毛细血管瘤、海绵状血管瘤、蔓状血管瘤、化脓性肉芽肿病理切片43份,新鲜组织19份,正常皮肤作为对照,分别作免疫组化及荧光定量PCR检测AS与ES在不同组织中的分布与表达水平。结果AS、ES在各组织血管内皮细胞胞质及胞膜上均有一定的表达,毛细血管瘤中AS和ES的阳性细胞率分别为(15.77±5.92)%,(19.35±7.81)%,基因表达量分别是正常皮肤的2.4和2.7倍;其他各型血管增生性病变与正常组织的表达量比较,差异无统计学意义。结论AS、ES在毛细血管瘤内高表达,提示二者可能通过特异性作用于增殖活跃的血管瘤内皮细胞,在血管瘤的发病机制中发挥一定的生物学作用。
血管抑素类;内皮抑素类;血管瘤,毛细管;血管瘤,海绵状;肉芽肿,脓性
作者单位:430022武汉市第一医院皮肤科
血管增生性皮肤病常见的有血管瘤、血管畸形、化脓性肉芽肿等,其病因、发病机制、治疗方式以及转归各不相同,组织病理均以血管内皮细胞异常增殖、血管形成为特点。血管形成受促血管生长因子和抗血管生成因子、血流动力学等多种因素调节,血管抑素(angiostatin,AS)和内皮细胞抑制素(endostatin,ES)是近年发现的血管生长抑制因子。人AS是血浆纤溶酶原的内源片段,有rK1~rK4袢样结构,能特异性抑制血管内皮细胞增殖,其中rK1-3的抑制作用最强[1-2]。ES是另一种内源性血管生长抑制因子,由组织蛋白酶L和金属蛋白酶通过水解ⅩⅧ型胶原C末端而产生[3]。两者都能特异性阻断新生血管的形成,但其作用机制、作用靶点以及抑制作用的强弱在不同组织中存在较大差异。本研究采用免疫组化和实时荧光定量PCR检测AS与ES在不同类型血管性皮肤病中的分布及表达量,比较分析二者在血管增生性皮肤病发生、发展过程中的作用。
一、资料与方法
1.组织来源:选择2011年5月至2012年12月本院病理科经HE染色确诊的石蜡块43例,其中毛细血管瘤17例(鲜红斑痣除外),平均年龄0.91岁,男女比例7:10;海绵状血管瘤16例,平均年龄15.6岁;蔓状血管瘤3例,化脓性肉芽肿7例,正常皮肤组织切片做对照。选取2013年皮肤科及儿外科手术新鲜组织标本19例,年龄71 d至42岁,术后病理确诊为毛细血管瘤5例,海绵状血管瘤7例,蔓状血管瘤2例,化脓性肉芽肿5例,各组间年龄、性别差异无统计学意义。19例患者术前均未服用糖皮质激素或普萘洛尔,未进行激光、冷冻和局部注射治疗,取幼儿包皮组织6例做对照,收集所有新鲜组织立即-80℃冻存。
2.主要试剂:兔抗人AS/ES多克隆抗体产自美国Proteintech Group公司,抗兔通用型免疫组化试剂盒REALTMEnVision+/HRP RABBIT由丹麦Dako Denmark A/S公司生产。反转录酶(M-MLV)、dNTP、Olig(dT)、2×Top Green qPCR Mix、TransScript First-Strand cDNA Synthesis SuperMix均产自中国Transgen公司,Trizol产自美国Invitrogen公司;PCR引物上海由生工生物工程技术服务有限公司合成。
3.SP免疫组化:取43例皮肤血管病变组织及4例正常皮肤组织蜡块切片、烤片,二甲苯脱脂,乙醇水化,抗原修复,SP免疫组化测定,盐酸二氨基联苯胺(DAB)显色,苏木素复染,中性树胶封片。用已知的AS/ES阳性表达的人肝细胞为阳性对照,以磷酸盐缓冲液(PBS)代替一抗为阴性对照。
4.实时荧光定量PCR:19例血管增生性皮肤病新鲜组织标本及6例正常组织总RNA提取。Primer5软件设计引物,AS上游引物:5'-CCAGTGCCAGC AGACCCTT-3',下游引物:5'-CTCCGAATCTCGCCCTCTAG-3',扩增片段为245 bp。ES上游引物:5'-GACCACGGCTCGATT TCTCC-3',下游引物:5'-CAG ATGGCCTTGTGCTGAGTG-3',扩增片段176 bp。以β肌动蛋白为内参照,反应在美国ABI公司ABI7300荧光定量PCR仪上进行。反应条件:94℃预变性3min,94℃变性10 s,56℃退火20 s,72℃延伸20 s,共40个循环。20 g/L琼脂糖凝胶电泳鉴定AS、ES产物分别在245 bp及176 bp。
5.统计学处理:SPSS 11.5统计软件进行原始数据汇总和数据分析。AS和ES表达水平采用±s表示,采用双尾t检验比较两组间差异,P<0.05为差异有统计学意义。
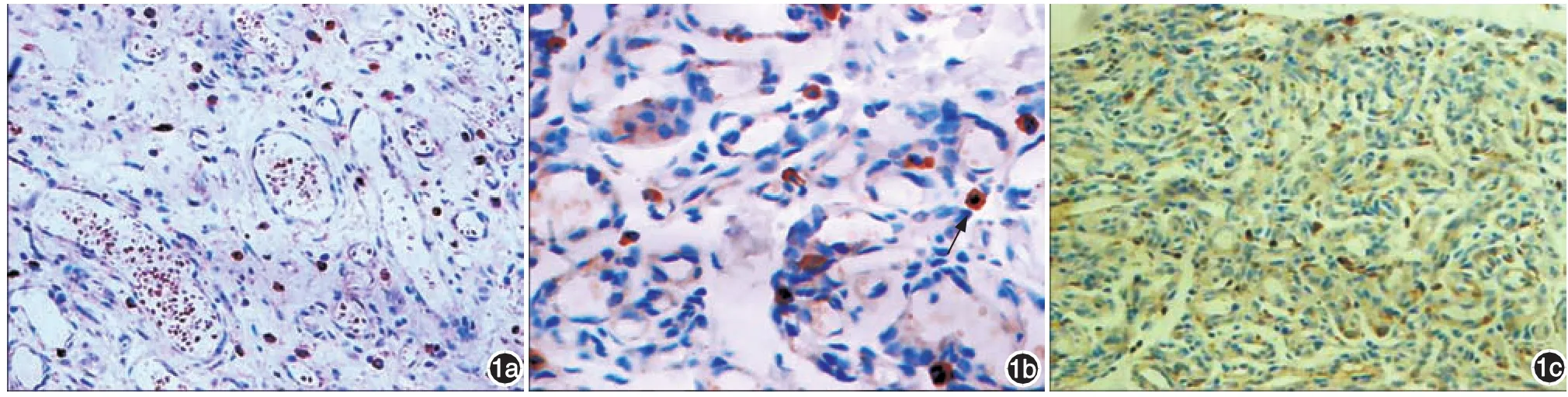
图1 毛细血管瘤免疫组化结果(SP) 1a,1c:大量增殖活跃的血管内皮细胞呈团块状,细胞团中央形成含红细胞的小腔隙(×200);1b:内皮细胞胞质丰富、透明,可见较大深染的细胞核及正常的核分裂象,较多内皮细胞胞质内和胞膜上有棕黄色颗粒沉积(×400)

图2 海绵状血管瘤(SP×200) 血管内皮细胞无异常增殖,排列成薄壁管腔,管周见正常网状结缔组织。部分内皮细胞胞质和包膜上见棕黄色颗粒沉积。2a:血管抑素;2b:内皮抑制蛋白

图3 蔓状血管瘤(SP×200) 镜下见直径较大、壁厚、不规则的小动脉及静脉。个别血管内皮细胞胞质中有棕黄色颗粒沉积。3a:血管抑素;3b:内皮抑制蛋白

图4 化脓性肉芽肿(SP×200) 镜下见丰富的新生毛细血管,大量血管内皮细胞增生,形成薄壁管腔,内皮细胞无核分裂相。小部分内皮细胞胞质内、胞膜上见棕黄色颗粒沉积。4a:血管抑素;4b:内皮抑制蛋白
二、结果
1.免疫组化染色:以细胞质和胞膜内出现棕黄色颗粒为阳性表达,用目镜测微网光学显微镜下人工计数,每张切片随机选取5个视野(×400),每个视野计数100个细胞,计算阳性细胞百分比。AS与ES在各类型血管性皮肤病及正常皮肤组织的血管内皮细胞均有表达,弥散分布于内皮细胞的胞质、胞膜,极少数分布在周细胞中(图1~4)。毛细血管瘤中AS、ES阳性细胞百分比均高于其他组(表1),差异有统计学意义;海绵状血管瘤与蔓状血管瘤组织中大部分血管内皮细胞处于退化期或静止状态,可见较大血管腔隙,两者与正常皮肤间差异无统计学意义;化脓性肉芽肿以新生毛细血管为主,AS/ES阳性细胞百分比与正常组织间差异无统计学意义。
2.RT-PCR反应:紫外分光光度计测定总RNAA260/A280比值在1.71~2.06之间,依据PCR扩增曲线及熔解曲线分析扩增效率好,产物单一,能得到可靠的相对定量结果。毛细血管瘤组AS、ES的表达水平分别是正常皮肤组织的2.363 3和2.732 3倍,其他各组AS和ES的表达均略低于正常对照组(表2)。
表1 各类血管性皮肤病中AS与ES阳性细胞率比较(±s)

表1 各类血管性皮肤病中AS与ES阳性细胞率比较(±s)
注:AS:血管抑素;ES:内皮细胞抑制素
组别 例数 AS(%) t值 P值 ES(%) t值 P值正常皮肤 4 3.46±1.77 4.27±1.88毛细血管瘤 17 15.77±5.92 4.04 <0.01 19.35±7.81 3.77 <0.01海绵状血管瘤 16 5.09±2.31 1.31 >0.05 6.32±3.27 1.19 >0.05蔓状血管瘤 3 1.78±1.23 1.39 >0.05 2.58±1.43 1.29 >0.05化脓性肉芽肿 7 4.14±2.89 0.42 >0.05 4.79±2.25 0.39 >0.05
表2 各类血管性皮肤病中AS、ES的表达水平(±s)
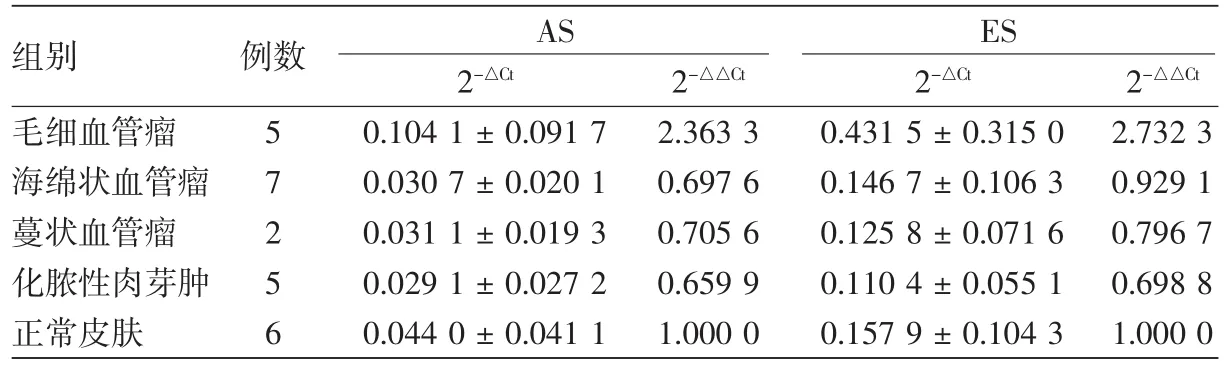
表2 各类血管性皮肤病中AS、ES的表达水平(±s)
注:AS:血管抑素;ES:内皮细胞抑制素
毛细血管瘤 5 0.104 1±0.091 7 2.363 3 0.431 5±0.315 0 2.732 3海绵状血管瘤 7 0.030 7±0.020 1 0.697 6 0.146 7±0.106 3 0.929 1蔓状血管瘤 2 0.031 1±0.019 3 0.705 6 0.125 8±0.071 6 0.796 7化脓性肉芽肿 5 0.029 1±0.027 2 0.659 9 0.110 4±0.055 1 0.698 8正常皮肤 6 0.044 0±0.041 1 1.000 0 0.157 9±0.104 3 1.000 0组别 例数 AS ES 2-△Ct 2-△△Ct 2-△Ct 2-△△Ct
三、讨论
AS、ES是近年发现的最有潜力的血管生成抑制因子,二者在抑制肿瘤血管新生治疗中的作用被广泛认同,已明确AS/ES对增殖活跃的内皮细胞作用显著,而对正常成熟的、静止状态的内皮细胞及其他细胞无影响[4-5]。我们推测,AS与ES在血管增生性皮肤病的发病过程中也可能发挥一定的作用,且对血管瘤、血管畸形及化脓性肉芽肿的作用机制存在差异。
本研究应用免疫组化及RT-PCR对不同类型血管增生性皮肤病中的AS与ES的表达进行了分析,发现AS与ES在毛细血管瘤、海绵状血管瘤、蔓状血管瘤及化脓性肉芽肿的血管内皮细胞中均有不同程度表达,特别是在毛细血管瘤中二者表达量明显升高,为正常皮肤组织和其他型血管病变的2~3倍,该结果说明AS和ES可能在血管瘤的发生、发展过程中发挥一定的生物学作用。AS与ES在蔓状血管瘤和处于静止状态的海绵状血管瘤、化脓性肉芽肿及正常皮肤中的表达量无明显差异,进一步说明AS/ES能选择性作用于增殖活跃的血管瘤内皮细胞,而对静止状态及正常成熟血管内皮细胞无影响,其作用具有特异性。AS/ES可能影响血管瘤的形成,而与血管畸形的发病无相关性,这与ISSVA对血管瘤和血管畸形的特点的概括相符。AS与ES对血管生成的抑制作用一致,但机制不同。研究表明,AS可以和肿瘤新生血管内皮细胞表面的多种受体结合,包括三磷酸腺苷(ATP)合成酶α/β亚单位(抑制内皮细胞表面ATP的代谢,下调内皮细胞的增殖和迁移[6])、angiomotin、整合素 αvβ3(干扰血管生成过程中所依赖的αvβ3介导的信号转导[7])等,从而抑制新生血管的形成[8]。ES可通过肝素结合位点,激活酪氨酸激酶信号转导系统,减少处于S期细胞比例,促进血管内皮细胞凋亡;通过抑制抗凋亡蛋白Bcl-2和Bcl-XL的表达,阻断VEGF及基质金属蛋白酶MMP的活性等多种途径抑制新生血管形成[9]。AS与ES在血管瘤的发生、演变过程中的作用机制、作用靶点是否与抗肿瘤新生血管的机制相同,两者在抑制血管生成的作用中是否具有协同作用,尚需进一步研究。
[1]O'Reilly MS,Holmgren L,Shing Y,et al.Angiostatin:a novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma[J].Cell,1994,79(2):315-328.
[2]Radziwon-Balicka A,Ramer C,Moncada de la Rosa C,et al.Angiostatin inhibits endothelial MMP-2 and MMP-14 expression:a hypoxia specific mechanism of action[J].Vascul Pharmacol,2013,58(4):280-291.
[3]Wenzel D,Schmidt A,Reimann K,et al.Endostatin,the proteolytic fragment of collagen XVIII,induces vaso relaxation[J].Circ Res,2006,98(9):1203-1211.
[4]Ribatti D.Endogenous inhibitors of angiogenesis:a historical review[J].Leuk Res,2009,33(5):638-644.
[5]Soff GA,Wang H,Cundiff DL,et al.In vivogeneration of angiostatin isoforms by administration of a plasminogen activator and a free sulfhydryl donor:a phase I study of an angiostatic cocktail of tissue plasminogen activator and mesna[J].Clin Cancer Res,2005,11(17):6218-6225.
[6]Moser TL,Kenan DJ,Ashley TA,et al.Endothelial cell surface F1-F0 ATP synthase is active in ATP synthesis and is inhibited by angiostatin[J].Proc Natl Acad Sci U S A,2001,98(12):6656-6661.
[7]Tarui T,Miles LA,Takada Y.Specific interaction of angiostatin with integrin alpha(v)beta(3)in endothelial cells[J].J Biol Chem,2001,276(43):39562-39568.
[8]Wahl ML,Kenan DJ,Gonzalez-Gronow M,et al.Angiostatin's molecularmechanism:aspectsofspecificityand regulation elucidated[J].J Cell Biochem,2005,96(2):242-261.
[9]Kim YM,Jang JW,Lee OH,et al.Endostatin inhitbis endothelial and tumor cellular invasion by blocking the activation and catalytic activity of matrix metalloproteinase[J].Cancer Res,2000,60(19):5410-5413.
2013-07-26)
(本文编辑:尚淑贤)
Expressions of angiostatin and endostatin in vascular proliferative skin diseases and their clinical implications
Zhang Ping,Li Lin,Li Kai,Cheng Yang,Jiang Kun,Wang Xiangdong,Chen Liuqing,Wang Weizhen.Department of Dermatology,Wuhan First Hospital,Wuhan 430022,China
Wang Weizhen,Email:weizhenwang2007@aliyun.com
ObjectiveTo investigate the expressions of angiostatin and endostatin in different vascular proliferative skin diseases.MethodsThis study included 43 paraffin-embedded and 19 fresh skin tissue specimens from the lesions of patients with vascular proliferative skin diseases(such as capillary hemangioma,cavernous hemangioma,hemangioma racemosum,and pyogenic granuloma)as well as 6 fresh skin tissue specimens from the foreskin of infants.Immunohistochemistry and real-time qPCR were used to determine the expression pattern and levels of angiostatin and endostatin in these specimens.ResultsBoth angiostatin and endostatin were expressed to a certain extent in the membrane and cytoplasm of vascular endothelial cells in these specimens of vascular proliferative skin diseases.The expression rates of angiostatin and endostatin in capillary hemangioma tissue specimens were 15.77%±5.92%and 19.35%±7.81%respectively,with their relative expression levels being 2.4 and 2.7 times those in the normal control skin specimens.No significant differences were observed in the expression level of angiostatin or endostatin between the normal control skin and lesions of the other vascular proliferative skin diseases(allP>0.05).ConclusionsAngiostatin and endostatin are highly expressed in capillary hemangioma tissue,suggesting that they play biological roles in the pathogenesis of hemangioma via specifically acting against actively proliferating vascular endothelial cells.
Angiostatins;Endostatins;Hemangioma,capillary;Hemangioma,cavernous;Granuloma,pyogenic
10.3760/cma.j.issn.0412-4030.2014.06.022
武汉市卫生局科研项目(WX11C07)
王玮蓁,Email:weizhenwang2007@aliyun.com

