LC-MS/MS法测定Beagle犬血浆中盐酸莫西沙星的含量及其药动学
褚奇星,褚延乐
(1.平顶山市第一人民医院 药学部,河南 平顶山467000;2.郑州大学 药学院,河南 郑州 450001)
研究论文
LC-MS/MS法测定Beagle犬血浆中盐酸莫西沙星的含量及其药动学
褚奇星1*,褚延乐2
(1.平顶山市第一人民医院 药学部,河南 平顶山467000;2.郑州大学 药学院,河南 郑州 450001)
目的建立一种灵敏、快速、专属性好、选择性强的HPLC-MS/MS分析法用于测定Beagle犬血浆样品中盐酸莫西沙星的含量,研究其药动学。方法用HPLC-MS/MS法测定血浆中盐酸莫西沙星的含量;以环丙沙星为内标,色谱柱为XTerra@MS C18 5 μm, 2.1 mm×150 mm分析柱,流动相为甲醇-水(50∶50,v/v),水相中含0.1%甲酸;流速为0.2 mL/min,进样10 μL。检测离子对分别为:莫西沙星m/z 402.1→m/z 384.3,内标环丙沙星m/z 332.2→m/z 314.2。结果莫西沙星在10 μg/L~2 000 μg/L的范围内线性良好,最低定量限10 μg/L,准确度在87.8%~111.6%之间,日内、日间精密度(RSD)均≤11.6%,提取回收率gt;80%。犬口服给药,血浆中盐酸莫西沙星药时曲线呈两室模型,药动学参数t1/2、tmax、AUC0-t、AUC0-∞、CL分别为10.7 h、2.1 h、3 943 μg/L·h、4 177 μg/L·h和10.5 L/h/kg。结论分析方法操作简便、专属性强、灵敏度高,适用于Beagle犬血浆中盐酸莫西沙星含量测定及药动学研究。
盐酸莫西沙星;LC-MS/MS;Beagle犬;药动学
盐酸莫西沙星(moxifloxacin hydrochloride)为德国Bayer公司研制而成的第四代广谱喹诺酮类抗菌药[1-2]。通过抑制细菌DNA螺旋酶A亚单位和拓扑异构酶IV的活性从而阻断DNA复制,以发挥抗菌效果,具有广谱、低毒、高效、生物利用度高及不良反应少等优点[3]。适用于敏感菌所致的呼吸道感染,包括慢支急性发作,轻度或中度获得性肺炎,急性鼻窦炎等[4]。
目前,生物样品中盐酸莫西沙星的含量测定,主要采用紫外、荧光以及质谱检测法[5-6],由于灵敏度与操作繁琐程度的限制,都不能很好的为其药动学研究提供灵敏、便捷的方法。本研究采用HPLC-MS/MS法测定Beagle犬血浆中盐酸莫西沙星的含量并用于其药动学研究,阐明了盐酸莫西沙星的药动学特征,为其临床药动学和生物利用度研究提供了快速、灵敏、准确的分析方法和理论依据。
1 材料与方法
1.1 试剂
盐酸莫西沙星片(规格400 mg/片,批号:BJ09953,拜耳医药保健有限公司),盐酸莫西沙星对照品,纯度99.6%,(拜耳医药保健有限公司,批号:BXR 5E2A)(图1),环丙沙星对照品,纯度99.8%,(中国药品生物制品检定所,批号:0125-7609)(图2),甲醇(色谱纯,天津四友精细化学品有限公司),其他试剂均为分析纯。Milli-Q超纯水系统(Millipore公司)。

图1 盐酸莫西沙星结构式Fig 1 Chemical structure of Moxifloxacin hydrochloride

图2 环丙沙星结构式Fig 2 Chemical structure of Ciprofloxacin
1.2 动物
普通级成年Beagle犬6只,雌雄各半,体质量10~12 kg,北京斯玛特实验动物有限公司,实验动物合格证号:SCXK (京)20120007。
1.3 色谱条件
色谱柱为XTerra@MS C18 5 μm, 2.1 mm×150 mm分析柱,预柱为XTerra@MS C18 5 m,2.1 mm×20 mm预柱,流动相为甲醇-水(50∶50,v/v),水相含0.1%甲酸,流速为0.2 mL/min,进样量10 μL,柱温25 ℃。
1.4 质谱检测参数
离子源: 电喷雾离子化源(ESI),正离子检测模式;毛细管电压:4.0 kV;脱溶剂气(N2) 温度:350 ℃;雾化器(N2)压力: 0.24 MPa;干燥气流速为10 L/min;扫描方式为多重反应离子监测(MRM);莫西沙星的离子对为m/z 402.1→m/z 384.3 毛细管出口电压(fragmentor)120 V;碰撞能量:CE=25 ev,内标环丙沙星的离子对为m/z 332.2→m/z 314.2,毛细管出口电压为135 V,用于分析的离子碰撞能量:CE=20 ev。
1.5 溶液的配制
盐酸莫西沙星标准溶液的配制:精密称取盐酸莫西沙星对照品10 mg,置50 mL容量瓶中,甲醇溶解并定容至刻度,得浓度为200 mg/L的盐酸莫西沙星对照品储备液;以甲醇:水(50∶50,v/v)稀释储备液,配制成盐酸莫西沙星浓度为 0.1、0.2、0.5、1、2、5、10和20 μg/mL的标准溶液,4 ℃保存备用。
内标溶液的配制:精密称取定量环丙沙星,置100 mL容量瓶中,方法同莫西沙星标准溶液配制,配得5 mg/L的内标溶液,4 ℃保存备用。
1.6 血浆样品前处理
精密吸取100 μL犬血浆置于5mL离心管中,加入100 μL饱和NaHCO3,涡旋混合30 s,加入10 μL内标溶液(盐酸环丙沙星,5 mg/L),涡旋混合30 s,加入乙酸乙酯1 mL,涡旋混合3 min,15 000×g离心10 min,取上清液800 μL于另一离心管中,真空浓缩仪40 ℃浓缩挥干,残渣以100 μL流动相复溶,上清液LC-MS/MS进样分析,进样量10 μL。
1.7 药动学实验
犬6只,雌雄各半,依次称重,按照给药剂量20 mg/kg,口服给予盐酸莫西沙星片,于给药前及给药0.083、0.167、0.5、1、2、4、6、8、10、12、24、36和48 h后于前肢隐静脉取血1mL,血样置于肝素抗凝的离心试管中,5 000×g离心5 min,取血浆100 μL,-20 ℃储存至分析。
1.8 统计学分析

2 结果
2.1 方法学验证
2.1.1 分析方法专属性:在上述色谱条件下,盐酸莫西沙星(图3)和内标物环丙沙星(图4)的保留时间分别是:2.32 min和1.62 min;得到犬空白血浆、空白血浆加盐酸莫西沙星和内标(环丙沙星)标准品以及受试犬给药后血浆样品的典型色谱图(图5)。

图3 莫西沙星质谱图Fig 3 MS/MS product-ion spectra of[M+H]+ of Moxifloxacin

图4 环丙沙星质谱图Fig 4 MS/MS product-ion spectra of[M+H]+ of Ciprofloxacin
2.1.2 标准曲线和定量限:取5mL带塞离心试管8只,分别加入不同浓度的盐酸莫西沙星对照品溶液各10 μL,按“血浆样品前处理”项下操作,配制成盐酸莫西沙星血浆浓度分别为10、20、50、100、200、500、1 000和2 000 μg/L的样品,得到色谱图(图6);以标准待测物浓度为横坐标,标准待测物与内标的峰面积比Ai/As为纵坐标,采用最小2乘法线性回归,求出标准曲线方程y=0.0008x+0.0544(r2gt;0.99),得到标准曲线图(图7),线性范围10 μg/L~2000 μg/L。定量下限为10 μg/L,S/n=10;以S/n=3做为检测限,检测限达到了3 μg/L。
2.1.3 准确度与精密度:按“1.6”项下方法制备成莫西沙星的血浆浓度分别为20.0,200和1 600 μg/L的质控(QC)样品,每浓度5个样本,连续测定3 d,计算质控样品的检测浓度,计算方法的准确度(accuracy)与日内、日间精密度(RSD)(表1),符合相关指导原则要求。
2.1.4 提取回收率:按照标准曲线的制备方法,制备20、200和1 600 μg/L血浆样品各5份。记录莫西沙星的峰面积(As)及其与内标物的峰面积比值(R),将测定结果的峰面积(As)与相同浓度对照品溶液直接进样得到峰面积(A)按下式计算提取回收率(%)=As/A×5/4×100%计算3种浓度的提取回收率(extraction recoveries)分别为(80.3±6.9)%、(89.1±5.6)%和(85.5±4.4)%,内标环丙沙星的回收率为(89.4±7.2)%。

A.blank dog plasma; B.blank dog plasma spiked with Moxifloxacin at LLOQ (10 μg/L) and IS (500 μg/L); C.plasma sample taken at 1 hour after oral administration; tR 2.32 min, moxifloxacin; tR 1.62 min IS

图5 典型色谱图Fig 5 Typical chromatograms
2.1.5 稳定性:样品在处理前后及放置过程中的稳定性检测(表2),在上述条件下RSD均小于10%。
2.2 药动学结果
本方法被成功地应用于Beagle犬体内盐酸莫西沙星药动学研究,以20 mg/kg的剂量口服给予盐酸莫西沙星后,得到Beagle犬体内血药浓度(c)时间(t)曲线(图8)和主要药动学参数(表3)。
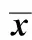
表2 血浆样品盐酸莫西沙星稳定性试验结果Table 2 Stability of Moxifloxacin hydrochloride during sample storage, preparation and determination(±s, n=5)

A~H.10 μg/L~2 000 μg/L图6 标准曲线各浓度点色谱图FIg 6 Chromatograms of Moxifloxacin in the 8-point standard curve of Beagle dog plasma

图7 Beagle犬血浆样品标准曲线Fig 7 8-point standard curve of Moxifloxacin hydrochloride in dog plasma

compoundparametervaluemoxifloxacinhydrochloridet1/2hours10.7±1.7tmax/h 2.1±0.9AUC(0-t)μg/L·h3943±151AUC(0-∞)μg/L·h4177±227MRT(0-t)h 7.9±0.3MRT(0-∞)h 9.9±0.7CLsL/h·kg10.5±1.2VL/kg135±42.6
3 讨论
本实验采用灵敏度高、特异性强的HPLC-MS/MS法用于莫西沙星在犬体内的药动学研究,目前国内尚未见报道。在以上色谱及质谱条件下,内源性物质不干扰样品测定,盐酸莫西沙星和内标物与内源性物质能充分分离,方法快速、简便,方法学验证结果均符合生物样品测定要求。

图8 Beagle犬口服盐酸莫西沙星后经时平均血药浓度曲线Fig 8 Mean plasma concentration-time profile of Moxifloxacin hydrochloride in plasma after oral administration to six Beagle dogs(n=6)
Beagle犬口服给药盐酸莫西沙星后体内药动学结果显示,盐酸莫西沙星药时曲线符合两室开放模型,与人体药动学情况一致[7]。本研究建立高效的液质联用分析法,实现了体内莫西沙星的快速、准确测定,为其临床药动学以及生物利用度研究提供了参考依据,并为在PK/PD基础上优化莫西沙星临床给药方案的研究[8]提供了简便的研究方法和可靠的理论依据。
[1] 黄道秋, 李柏群. 莫西沙星的药理作用特性与应用概况[J]. 中国医院用药评价与分析, 2007, 7: 93-95.
[2] 贺德辉,余江平. RP-HPLC法测定人血浆中莫西沙星的浓度[J]. 中国药房, 2007, 18: 2506-2510.
[3] Keating GM, Scott LJ. Moxifloxacin: A review of its use in the management of bacterial infections [J]. Drugs, 2004, 64: 2347-2377.
[4] 刘九雨,郭惠元. 广谱高效的新喹诺酮类抗菌药莫西沙星[J]. 国外医药抗生素分册, 2002, 23: 274-279.
[5] 孙丽. 高效液相色谱-荧光法测定盐酸莫西沙星血药浓度方法的建立[J]. 天津医科大学学报, 2009, 15: 675-682.
[6] Vishwanathan K, Bartlett MG, Stewart JT. Determination of moxifloxacin in human plasma by liquid chromatography electrospray ionization tandem mass spectrometry [J]. J Pharm Biomed Anal, 2002, 30: 961-968.
[7] 徐玉红, 李玉珍, 李东, 等. 盐酸莫西沙星片的人体药动学研究[J]. 中国药房, 2010, 21: 898-901.
[8] 王小均, 刘春涛, 余勤, 等. 盐酸莫西沙星的全身和肺部药代动力学比较研究[J]. 中国呼吸与危重监护杂志, 2008, 7: 88-92.
Determination of moxifloxacin hydrochloridein beagle dog plasma by LC-MS/MS and its application to pharmacokinetics
CHU Qi-xing1*, CHU Yan-le2
(1.Pharmaceutical Department, the First Peoples’ Hospital of Pingdingshan, Pingdingshan 467000;2.College of Pharmacy, Zhengzhou University, Zhengzhou 450001, China)
ObjectiveTo establish a sensitive and specific LC-MS/MS method for the determination of moxifloxacin hydrochloride in Beagle dog plasma and to evaluate the pharmacokinetic profile.MethodsThe concentration of Moxifloxacin Hydrochloride was determined by LC-MS/MS with XTerra@MS C18 column (5 μm, 2.1 mm×150 mm). The mobile phase consisted of methanol-water (50∶50, v/v) with the flow rate of 0.2 mL/min. The injection volume was 10 μL. Ions of moxifloxacin and ciprofloxacin were m/z 402.1→m/z 384.3 (F=120 V, CE=25), m/z 332.2→m/z 314.2(135 V, CE=20).ResultsStandard calibration graph for moxifloxacin hydrochloride was linear over a curve range of 10 μg/L~2 000 μg/L(R2gt;0.99) and the low limit of quantification was 10 μg/L using a plasma sample of 100 μL. The intra-day and inter-day precision (RSD) were in line with analysis of the biological samples. RSD were less than 11.6%, the extraction recoveries were greater than 80%. The concentration-time curves of moxifloxacin hydrochloride were best fitted to a two compartment model. The main pharmacokinetic parameters of t1/2,tmax, AUC0-t, AUC0-∞and CL were 10.7 h, 2.1 h, 3 943 μg/L·h, 4 177 μg/L·h and
10.5 L/h·kg respectively.ConclusionsThe method was specific and suitable for the determination of moxifloxacin hydrochloride in Beagle dog plasma and to study the pharmacokinetic character.
moxifloxacin hydrochloride; LC-MS/MS; beagle dog; pharmacokinetics
2013-09-06
2013-12-23
*通信作者(correspondingauthor):pdscqx@126.com
1001-6325(2014)05-0684-06
R 969.1
A

