内质网应激反应通路小分子抑制剂协同抗癌药物对宫颈癌细胞的抑制作用
聂 萌,李 闯,游 燕,崔全才,王 林*
研究论文
内质网应激反应通路小分子抑制剂协同抗癌药物对宫颈癌细胞的抑制作用
聂 萌1,李 闯1,游 燕2,崔全才2,王 林1*
(1.中国医学科学院 基础医学研究所 北京协和医学院 基础学院 生理系,北京 100005;2.北京协和医院 病理科,北京 100730)
目的探讨UPR信号通路中重要小分子的抑制剂EerI和4μ8C在宫颈癌中的作用。方法用免疫组化法检测GRP78/BiP、P97、Ubiquitin和IRE1α在正常宫颈鳞状上皮组织及不同临床分期宫颈癌组织中的表达;不同浓度的小分子抑制剂EerI和4μ8C处理宫颈癌HeLa细胞,MTS法检测细胞增殖,流式细胞仪检测细胞凋亡;抗癌药物硼替佐米(BTZ)和顺铂(CDDP)分别联合抑制剂4μ8C和EerI处理HeLa细胞,MTS法检测细胞的增殖。结果GRP78/BiP、P97、Ubiquitin和IRE1α在不同分期宫颈癌癌巢部位的表达水平较正常宫颈鳞状上皮细胞有显著升高(Plt;0.05),且随临床分期的不同其表达也存在一定差异;抑制剂EerI和4μ8C呈剂量依赖的方式抑制HeLa细胞生长,促进其凋亡(Plt;0.05);与单独用药处理相比,抑制剂EerI和4μ8C分别与BTZ和CDDP的联合作用均可显著提高HeLa细胞对两种抗癌药物的敏感性(Plt;0.05)。结论UPR通路小分子抑制剂与抗癌药物BTZ和CDDP联用具有协同抗癌活性,这为抗癌新药研发和逆转肿瘤耐药性提供了新的思路。
内质网应激反应;宫颈癌;小分子抑制剂;联合用药
在许多生理和病理条件下,如实体肿瘤核心部分细胞遇到缺氧、低酸和营养成分缺失等,这些都会诱导未折叠蛋白或错误折叠蛋白在内质网腔内聚集并导致细胞内钙稳态失衡,引发未折叠蛋白反应(unfolded protein response,UPR)的激活,也称内质网应激(endoplasmic reticulum stress,ERS)[1]。UPR通过IRE1α-XBP1、PERK-eIF2α 和ATF6通路调控肿瘤细胞的生存或凋亡[2]。有报道表明,在胃癌[3]、肝癌[4]和乳腺癌[5]等肿瘤中发现内质网中分子伴侣GRP78/BiP表达被激活。此外,内质网相关性蛋白降解(ER-associated protein degradation,ERAD)通路中重要的功能分子Valosin-Containing Protein(VCP,又名P97)在食管癌[6]、结肠癌[7]和前列腺癌[8]中表达上调。本研究探讨宫颈癌(cervical cancer)中UPR通路小分子抑制剂的抗癌活性及其与抗癌药物硼替佐米(Bortezomib,BTZ)和顺铂(Cisplatin,CDDP)的协同作用,为宫颈癌的治疗和抗癌新药的研究提供靶点。
1 材料与方法
1.1 临床资料
使用北京协和医院妇科宫颈癌患者的手术标本,年龄为28~56岁。选取不同临床分期(0、Ⅰ和Ⅱ期)宫颈癌患者的典型病例。所有标本均经病理证实。所有患者术前未接受放疗,化疗及激素等治疗。所获标本均征得患者知情同意。
1.2 主要试剂
宫颈癌HeLa细胞(北京协和医学院基础所蒋澄宇教授课题组惠赠);免疫组织化学试剂盒(北京中杉金桥有限公司);兔抗人IRE1α多克隆抗体和鼠抗牛Ubquitin单克隆抗体(Santa Ctuz公司),p97/Cdc48 (哥本哈根大学Dr.Hartmann Peterson惠赠),兔抗人GRP78/BiP多克隆抗体(巴傲德生物科技有限公司);硼替佐米(Bortezomib,BTZ)(Selleck Biochemicals公司);顺铂(Cisplatin,CDDP),P97抑制剂Eeyarestatin-Ⅰ (EerI)和IRE1α抑制剂4μ8C(EMD Millipore公司);MTS一步法细胞活力检测试剂盒(Promega公司);凋亡检测试剂盒(BD公司)。
1.3 免疫组织化学染色法
将临床标本用甲醛固定和石蜡包埋,切取厚度为4 μm。严格按照免疫组化试剂盒说明书的步骤进行操作,其中一抗的浓度依次是IRE1α(1∶50)、P97(1∶500)、Ubiquitin(1∶500)和GRP78/BiP(1∶50)。使用PBS代替一抗做阴性对照。最终经DAB显色,由苏木精复染。
1.4 MTS法检测HeLa细胞增殖活性
培养HeLa细胞至对数增殖期,调整细胞浓度为3×104/mL。细胞悬液接种于96孔培养板,每孔加100 μL 高糖DMEM培养基,置于37 ℃、5% CO2的孵箱中培养24 h。随后加入不同药物处理,每组重复4次,设二甲基亚砜(DMSO)为实验对照组。分别于0、24、48、72和96 h后,加入20 μL MTS,于孵箱放置2 h。在酶联免疫检测仪上读取波长为490 nm处的吸光度值。实验至少重复3次,结果取稳定值。
1.5 流式细胞术检测HeLa细胞的凋亡及病死率
HeLa细胞在相应药物处理一定时间后,收集其上层培养液于离心管,冷PBS清洗2次,胰蛋白酶消化细胞并转移至离心管,调整细胞浓度为1×106/mL。按照试剂盒说明书进行操作,使用流式细胞仪检测。实验至少重复3次,结果取稳定值。
1.6 统计学分析
2 结果
2.1UPR和ERAD通路中重要调控分子在宫颈癌组织中的表达
GRP78/BiP、IRE1α、P97和Ubiquitin定位在胞质,呈棕黄色颗粒状,在宫颈癌组织中呈强阳性表达,而在正常宫颈鳞状上皮组织中呈阴性表达。此外,在不同临床分期(0、Ⅰ和Ⅱ期)的宫颈癌组织中,GRP78、IRE1α、p97和Ubiquitin的阳性表达情况存在一定的差异(图1)。
2.2P97和IRE1α的小分子抑制剂对宫颈癌HeLa细胞增殖的抑制作用
不同浓度的P97抑制剂EerI以及IRE1α抑制剂4μ8C作用于宫颈癌HeLa细胞48 h,其增殖均受到明显抑制(Plt;0.05)。并且,两种抑制剂对HeLa细胞的生长抑制率随着其作用浓度的升高而增加,呈剂量依赖性(图2)。
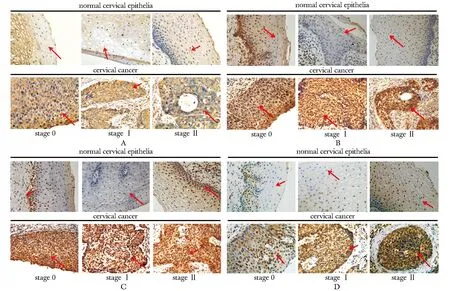
A.elevated GRP78/BiP levels in cervical cancer;B.elevated P97 levels in cervical cancer;C.elevated Ubiquitin levels in cervical cancer;D.elevated IRE1α levels in cervical cancer
图1宫颈癌组织和正常宫颈鳞状上皮中GRP78/BiP、P97、Ubiquitin和IRE1α的阳性表达
Fig1ExpressionlevelofGRP78/BiP,P97,UbiquitinandIRE1αincervicalcancerandnormalcervicalepithelia(×400)
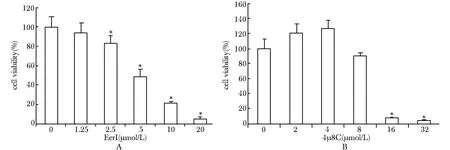
A.dose dependent effect of EerI on the viability of HeLa cells;B.dose dependent effect of 4μ8C on the viability of HeLa cells;*Plt;0.05 compared with control
图2小分子抑制剂EerI和4μ8C对宫颈癌HeLa细胞增殖的抑制作用
Fig2ThegrowthinhibitionofEerIand4μ8CtoHeLacells
2.3P97和IRE1α的小分子抑制剂对宫颈癌HeLa细胞凋亡的诱导作用
不同浓度的P97抑制剂EerI和IRE1α抑制剂4μ8C分别处理HeLa细胞48 h,其中,细胞凋亡率随EerI浓度的升高而增加,呈剂量依赖性。5 μmol/L和10 μmol/L的EerI可使细胞凋亡率分别达50%和80%以上(Plt;0.01)(图3A)。32 μmol/L 4μ8C处理组的细胞凋亡率显著增加,约达50%(Plt;0.05)(图3B)。
2.4P97和IRE1α的小分子抑制剂影响宫颈癌HeLa细胞对抗癌药物的敏感性
随培养时间的增加,CDDP分别与2.5 μmol/L EerI和16 μmol/L 4μ8C联用处理HeLa细胞,细胞存活率较CDDP、EerI和4μ8C单用处理组有明显降低(Plt;0.05),其中,4μ8C与CDDP联用处理可使HeLa细胞存活率在48 h降低至20%(Plt;0.01)(图4A,B)。此外,BTZ与2.5 μmol/L EerI和16 μmol/L 4μ8C联用处理组的HeLa细胞存活率比BTZ、EerI和4μ8C单用处理组也有显著降低(Plt;0.01)(图4C,D)。值得注意的是,与CDDP相比,相同浓度的EerI和4μ8c更能提高HeLa细胞对BTZ的敏感性。
3 讨论
UPR可以提高肿瘤细胞对周围有害环境的适应能力,促进肿瘤的生长[9]。同时,抑制UPR信号通路的激活或者降低内质网分子伴侣GRP78/BiP的表达,可以有效阻碍肿瘤的生长[10-11]。因此,运用UPR信号通路分子(如IRE1α和GRP78/BiP)的抑制剂,或者阻碍ERAD通路的蛋白降解过程,将成为肿瘤治疗的新靶点并为逆转肿瘤耐药性提供新的思路。

A.dose dependent apoptosis-inducing effect of EerI on HeLa cells;B.dose dependent apoptosis-inducing effect of 4μ8C on HeLa cells;*Plt;0.05,**Plt;0.01 compared with control
图3小分子抑制剂EerI和4μ8C对宫颈癌HeLa细胞凋亡的诱导作用
Fig3ApoptosisinducedbyEerIand4μ8CofHeLacells

A.EerI sensitized growth inhibition of HeLa cells by CDDP;B.4μ8C sensitized growth inhibition of HeLa cells by CDDP;C.EerI sensitized growth inhibition of HeLa cells by BTZ;D.4μ8C sensitized growth inhibition of HeLa cells by BTZ;*Plt;0.05,**Plt;0.01 compared with control
图4小分子抑制剂EerI和4μ8C在不同程度上增强宫颈癌HeLa细胞对CDDP和BTZ的敏感性
Fig4EerIand4μ8CsensitizedHeLacellstoCDDPandBTZtodifferentextent
宫颈癌是全世界严重危害妇女健康的三大恶性肿瘤之一,其发病率仅次于乳腺癌。发展中国家是宫颈癌的高发区,发病率占全球宫颈癌患者的85%,而病死率则位于妇科恶性肿瘤第二位[12]。
本研究首先发现,相对于正常宫颈鳞状上皮细胞,IRE1α、P97、Ubiquitin和GRP78/BiP在不同分期宫颈癌癌巢部位表达水平均显著升高,提示在宫颈癌发生发展过程中伴随了UPR和ERAD的发生,即ERS被激活。随后检测不同浓度P97的抑制剂EerI以及IRE1α的抑制剂4μ8C对HeLa细胞增殖和凋亡的影响。结果显示,小分子抑制剂EerI和4μ8C均呈剂量依赖的方式抑制HeLa细胞生长,同时伴随有细胞的凋亡。
抗肿瘤药物CDDP和BTZ均由于两者的耐药现象限制了其进一步广泛应用。因此为检测小分子抑制剂EerI和4μ8C对抗癌药物BTZ和CDDP潜在的协同作用,本研究选择一定浓度的EerI和4μ8C分别联合BTZ和CDDP处理HeLa细胞48h,结果显示,与单独用药处理相比,HeLa细胞生长抑制增强并且细胞凋亡率明显上升。同时发现,与CDDP相比,4μ8C和EerI更能提高HeLa细胞对BTZ的敏感性。
综上所述,对UPR和ERAD信号通路小分子抑制剂抗癌活性及其增强抗肿瘤药物敏感性特性的揭示,将为抗癌药物的研发提供新的靶点和方向。
[1] Wang G, Yang ZQ, Zhang K. Endoplasmic reticulum stress response in cancer: molecular mechanism and therapeutic potential[J]. Am J Transl Res, 2010, 2:65-74.
[2] Park SW, Ozcan U. Potential for therapeutic manipulation of the UPR in disease[J]. Semin Immunopathol, 2013, 35:351-373.
[3] Zhang LJ, Chen S, Wu P,etal. Inhibition of MEK blocks GRP78 up-regulation and enhances apoptosis induced by ER stress in gastric cancercells[J]. Cancer Lett, 2009, 274:40-46.
[4] Su R, Li Z, Song H,etal. Grp78 promotes the invasion of hepatocellular carcinoma[J]. BMC Cancer, 2010, 10:20-24.
[5] Miao YR, Eckhardt BL, Cao Y,etal. Inhibition of established micrometastases by targeted drug delivery via cell surface-associated GRP78[J]. Clin Cancer Res, 2013,19:2107-2016.
[6] Yamamoto S, Tomita Y, Hoshida Y,etal. Expression level of valosin-containing protein (P97) is associated with prognosis of esophageal carcinoma[J]. Clin Cancer Res, 2004, 10:5558-5565.
[7] Yamamoto S, Tomita Y, Hoshida Y,etal. Expression of valosin-containing protein in colorectal carcinomas as a predictor for disease recurrence and prognosis[J]. Clin Cancer Res, 2004, 10:651-657.
[8] Tsujimoto Y, Tomita Y, Hoshida Y,etal. Elevated expression of valosin-containing protein (P97) is associated with poor prognosis of prostate cancer[J]. Clin Cancer Res, 2004, 10: 3007-3012.
[9] Jäger R, Bertrand MJ, Gorman AM,etal. The unfolded protein response at the crossroads of cellular life and death during endoplasmic reticulum stress[J]. Biol Cell, 2012, 104:259-270.
[10] Li HD, Zhao S, Zhao L,etal. The cell surface GRP78 facilitates the invasion of hepatocellular carcinoma cells[J]. Biomed Res Int, 2013, 2013. doi: 10.1155/2013/917296
[11] Li Z, Zhao C, Li Z,etal. Reconstructed mung bean trypsin inhibitor targeting cell surface GRP78 induces apoptosis and inhibits tumor growth in colorectal cancer[J]. Int J Biochem Cell Biol, 2013, 47: 68-75.
[12] Pimenta JM, Galindo C, Jenkins D,etal. Estimate of the global burden of cervical adenocarcinoma and potential impact of prophylactic human papillomavirus vaccination[J]. BMC Cancer, 2013,13:553. doi:10.1186/1471-2407-13-553.
The combination of small-molecule inhibitors targeting the key proteins in theER stress response and anticancer drugs shows the inhibition effects to HeLa cells
NIE Meng1, LI Chuang1, YOU Yan2, CUI Quan-cai2, WANG Lin1*
(1.Dept. of Physiology, Institute of Basic Medical Sciences, CAMS amp; PUMC, Beijing 100050;2.Dept. of Pathology, PUMC Hospital, Beijing 100730, China)
ObjectiveTo investigate the therapeutic potential Eeyarestatin-Ⅰ (EerI) and 4μ8C, the small-molecule inhibitors of UPR signaling pathway in the cervical cancer.MethodsThe protein expression of GRP78/BiP, P97, Ubiquitin and IRE1α in normal cervical epithelia and cervical cancer were examined by immunohistochemistry. The effect of EerI and 4μ8C on HeLa cell proliferation and apoptosis were measured by MTS assay and flow cytometry, respectively. The combined antiproliferative effects of small-molecule inhibitors were carried out in combination of Bortezomib (BTZ) and Cisplatin (CDDP), respectively.ResultsGRP78/BiP, P97, Ubiquitin and IRE1α were significantly up-regulated in cervical cancer compared with normal cervical epithelia and displayed variability in the cervical cancer of different clinical stages (Plt;0.05). EerI and 4μ8C inhibited HeLa cell proliferation in a dose-dependent manner and induced HeLa cell apoptosis in a similar fashion (Plt;0.05).MTS assays in-dicated that combination treatment significantly enhanced the antiproliferative effect of single chemotherapy drugs (Plt;0.05).ConclusionsSmall-molecule inhibitors targeting at the key players of UPR show synergistic effects with other anticancer drugs suggesting a new therapeutic strategy towards cervical cancer.
endoplasmic reticulum stress; cervical cancer; small-molecule inhibitor; drug combination
2014-01-15
2014-03-13
国家自然科学基金(81372201);中国医学科学院基础医学研究所院所长启动基金(2010RC01)
*通信作者(correspondingauthor): lin.wang@ibms.pumc.edu.cn
1001-6325(2014)05-0638-06
R 33
A

