新型CD20核酸适配体的筛选及鉴定
张李钰,胡 燕,曹蓓蓓,段金虹,刘 喆,杨先达*
(1.中国医学科学院 基础医学研究所 病理生理系,北京 100005;2.北京协和医学院 北京协和医院 临床遗传学实验室,北京 100005)
研究论文
新型CD20核酸适配体的筛选及鉴定
张李钰1,胡 燕1,曹蓓蓓1,段金虹1,刘 喆2,杨先达1*
(1.中国医学科学院 基础医学研究所 病理生理系,北京 100005;2.北京协和医学院 北京协和医院 临床遗传学实验室,北京 100005)
目的研发能特异性识别CD20分子的DNA适配体,使其作为肿瘤靶向分子为非霍奇金淋巴瘤的新型靶向治疗提供依据。方法体外合成含有21个随机寡核苷酸、全长为59个碱基的DNA文库,以CD20胞外表位肽为靶标,利用指数富集的配体系统进化技术(SELEX),从文库中筛选CD20适配体;利用流式细胞术评估适配体的富集程度、适配体与CD20多肽,适配体与CD20阳性细胞的结合特性;用MFold软件预测适配体预计结构。结果经多轮筛选获得了能识别CD20结构的全新DNA适配体CE4-1;它能特异性地识别CD20阳性淋巴瘤细胞,与白蛋白及CD20阴性细胞的结合较弱,与经胰蛋白酶处理的CD20阳性细胞的结合也减弱。结论该新型适配体能选择性识别CD20结构及CD20阳性细胞,在CD20阳性淋巴瘤的靶向诊疗方面具有应用潜能。
适配体;SELEX;CD20
非霍奇金淋巴瘤(non-Hodgkin’s lymphoma, NHL)是最常见的淋巴系统恶性肿瘤[1],发病率和病死率逐年上升[2]。靶向治疗有可能改善肿瘤的治疗效果,在NHL治疗中得到重视[3]。靶向治疗需要靶标蛋白,CD20分子在95%以上的B细胞淋巴瘤中特异表达,而85%的NHL源于B细胞[4-5],故CD20是治疗多数NHL的理想靶点[6]。现有CD20靶向治疗的抗体药物(美罗华)有耐药性等弊端,故需研发新的靶向分子[7]。核酸适配体(aptamer)是一类短链核酸分子,以较高特异性和亲和力与靶标结合,并易合成、低成本、易穿透肿瘤组织,是一类具有重大应用潜能的肿瘤靶向分子[8]。而目前国内外尚未研发出针对CD20的核酸适配体。本文以CD20胞外一段表位肽为靶标,通过SELEX技术筛选得到了一种全新的CD20适配体(CE4-1),并在体外分析了其结合特性。
1 材料与方法
1.1 主要试剂
胎牛血清(FBS Hyclone公司); 1640干粉(Gibico公司);血清白蛋白(BSA,Tbdscience公司);单链DNA文库 (Invitrogen公司),由59个碱基构成,两端为固定序列,中间为21个碱基的随机序列:5′-TGCGTGTGTAGTGTGTCTG-N21-CTCTTAG GGATTTGGGCGG-3′;引物P1:5′-TGCGTGTGTAGTG TGTCTG-3′、P2:5′-CCGCCCAAATCCCTAAGAG-3′、异硫氰酸荧光素(FITC)标记引物P1 和生物素(Biotin)标记引物P2(Invitrogen 公司); Taq 酶,10×PCR 缓冲液,dNTP(Genestar 公司); CD20多肽(NIYNCEPANPSEKNSPSTQYCYSIQ,欣百诺生物公司);脲醛树脂磁性微球Affimag UF(表面基团为-COOH)(天津倍思乐公司); 链霉亲和素分离磁珠(Promega公司); 碳二亚胺盐酸盐(EDC·HCl)(Sigma公司); pEASY-T1 克隆载体试剂盒(全式金公司)。其余药品、试剂均为国产分析纯等级。
1.2 细胞系
Raji和Ramos(均人B细胞淋巴瘤细胞系)及Jurkat(人T细胞淋巴瘤细胞系)(均中国医学科学院基础医学研究所细胞中心)。所有细胞培养于含有10% 胎牛血清的1640培养基中,培养环境为37 ℃、5% CO2。实验所用细胞均处于增殖期细胞。
1.3 SELEX过程
1.3.1 CD20多肽与UF磁珠偶联:将5×105个UF磁珠在碳二亚胺EDC/N-N-羟基琥珀酰亚胺NHS(0.1 mol /L)作用下室温催化激活15 min。PBS洗2遍,将1 μg CD20多肽与已激活的磁珠混合,室温震摇2 h。PBS洗2次,重悬,4 ℃保存备用。血清白蛋白BSA与磁珠连接方法与CD20一致。
1.3.2 适配体筛选:取50 pmol DNA文库,用缓冲液PBS稀释到100 μL,95 ℃变性5 min,立刻放于冰上10 min。将预处理的DNA文库与靶标包被的磁珠孵育,振荡30 min。利用磁场分离磁珠,弃上清液,PBS洗涤磁珠,重悬后在95 ℃热水中加热5 min,回收上清液。
1.3.3 PCR扩增富集:将上清液作为模板,优化PCR条件,硫氰酸荧光素FITC标记引物P1和生物素标记引物P2扩增双链(95 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,共25个循环)。
1.3.4 单链DNA的获得:将PCR产物按照说明书与链霉亲和素磁珠孵育,在碱性条件下得到单链DNA,用于下一步筛选或者检测。
1.4 流式细胞仪检测并分析筛选进程
将每轮筛选所得带有FITC标记的ssDNA库与靶标磁珠室温孵育30 min,PBS洗涤2次,流式细胞仪检测单链DNA与磁珠结合的荧光强度变化。
1.5 克隆测序
将富集的DNA文库用未修饰的引物扩增成双链DNA。将1 μL PCR产物与1 μL克隆载体轻轻混匀,25 ℃反应5 min。将连接产物于50 μL Trans1-T1感受态细胞中混匀,冰浴20~30 min。42 ℃热激30 s,立即置于冰上2 min。加250 μL室温的SOC/LB,37 ℃孵育1 h。取200 μL菌液铺板,培养过夜。挑取边缘光滑的白色克隆至0.5 mL含氨苄和卡纳霉素的细菌普通培养基中,过夜培养。用分离的单链产物和靶标磁珠反应,流式细胞仪检测其与靶标的结合能力,选择结合能力强的克隆送公司测序。
1.6 适配体CE4-1二级结构的预测
使用MFold 软件预测适配体CE4-1的二级结构。
1.7适配体CE4-1与多肽靶标特异性结合的检测
将FITC标记的核酸适配体CE4-1分别与靶标以及血清白蛋白包被的磁珠孵育,室温振荡30 min,洗2遍。用流式细胞仪分析磁珠表面的荧光强度。
1.8适配体CE4-1与CD20阳性细胞特异性结合的检测
将FITC标记的核酸适配体CE4-1分别与CD20阳性细胞Raji、Ramos以及CD20阴性细胞Jurkat孵育,摇床振荡30 min,洗2遍。用流式细胞仪分析细胞的荧光强度。
1.9CD20阳性细胞表面CD20蛋白量对CE4-1与细胞结合的影响
FITC标记的CE4-1分别与经胰酶消化10 min的CD20阳性细胞以及未经过胰蛋白酶处理的同种细胞进行孵育,洗2遍后以流式检测细胞荧光强度变化。
2 结果
2.1 筛选富集过程
经过SELEX筛选富集后,随着筛选的进程,富集库中ssDNA对CD20结合增强,曲线右移。将最后一轮筛选库进行克隆,从96个克隆中筛选到一个对CD20有较强结合的适配体CE4-1(图1)。其序列为5′-TGCGTGTGTAGTGTGTCTGTTTTTTATCTTC TTTTATCTACTCTTAGGGATTTGGGCGG-3′。图2为利用MFold软件预测的CE4-1的二级结构。
2.2 适配体CE4-1与CD20的结合特异性评估
CE4-1与CD20结构的结合远高于与裸磁珠的结合(图3A)。而CE4-1与血清白蛋白的结合与裸磁珠相似,明显弱于与CD20的结合(图3B)。

图1 流式细胞技术检测筛选过程中适配体库的富集Fig 1 Flow cytometry histograms for monitoring the enrichment of aptamers during the selection process
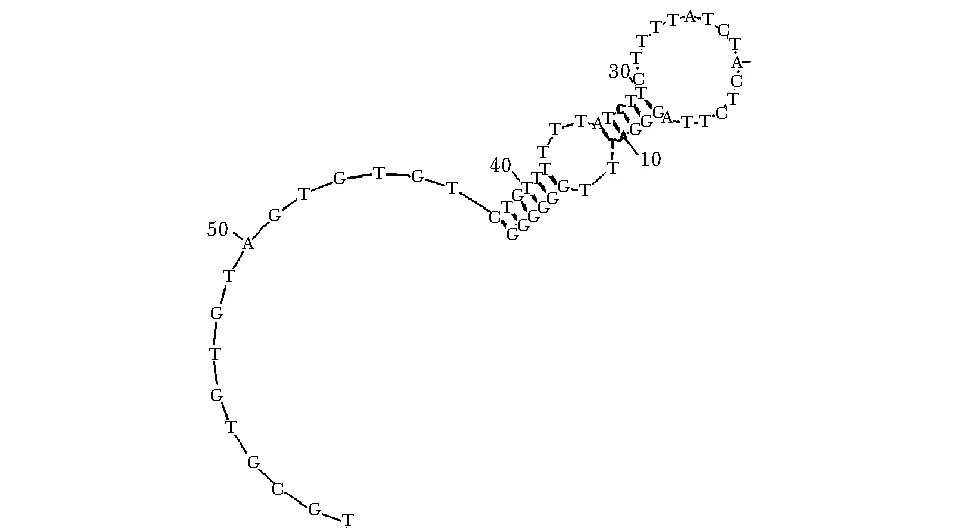
图2 MFold软件预测适配体CE4-1的二级结构Fig 2 Predicted secondary structure of the aptamer CE4-1 by MFold software
比较各组平均荧光强度值可见,CE4-1与CD20结合的平均荧光强度明显高于与血清白蛋白的结合(图3C)。

图3 流式细胞技术检测适配体CE4-1与CD20多肽(A)和血清白蛋白(B)的结合
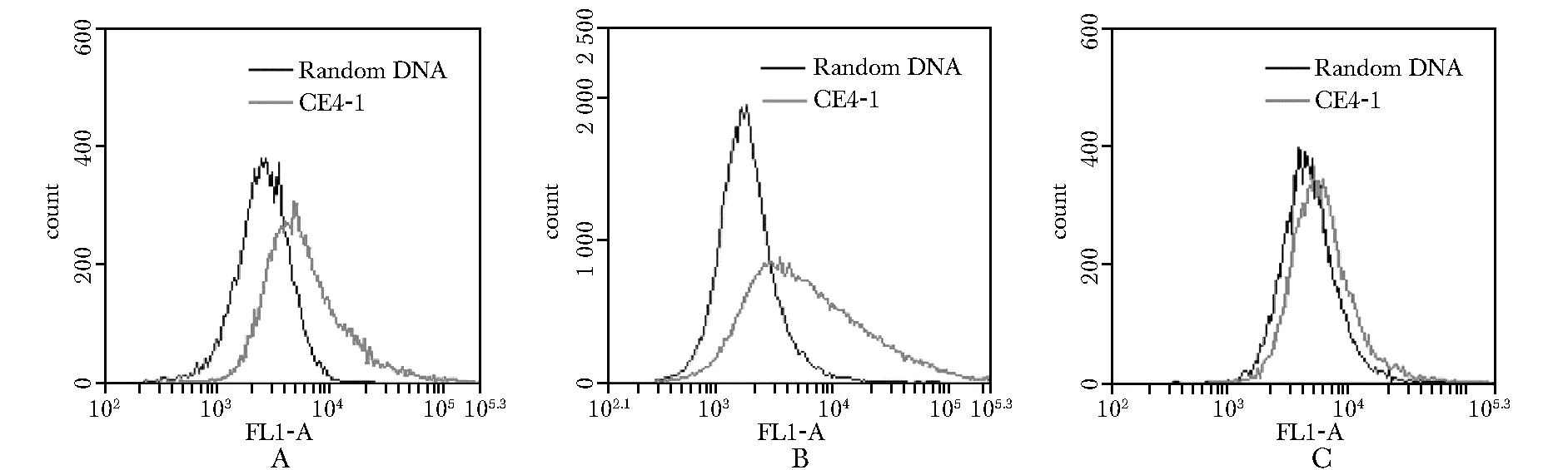
A.CD20-positive cells Raji incubated with FITC-labeled CE4-1(gray curve) and random DNA(black curve); B.CD20-positive cells Ramos incubated with FITC-labeled CE4-1(gray curve) and random DNA(black curve); C.CD20-negative cells Jurkat incubated with FITC-labeled CE4-1(gray curve) and random DNA(black curve)
图4流式细胞技术检测适配体CE4-1与CD20阳性细胞和CD20阴性细胞的结合
Fig4FlowcytometryprofilesofCE4-1andrandomDNA’sbindingtotheCD20-positivecellsandCD20-negativecells
2.3适配体CE4-1与CD20阳性细胞结合特异性的评估
CE4-1与CD20阳性细胞Raji(图4A)和Ramos(图4B)的结合较强,远高于随机DNA与两种细胞的结合。而CE4-1与CD20阴性细胞的结合与随机DNA相似,明显弱于与CD20阳性细胞的结合(图4C)。
2.4胞膜外CD20蛋白对适配体CE4-1结合的影响
适配体CE4-1与经过胰蛋白酶处理的CD20阳性细胞的结合,明显低于其与未经处理同种细胞的结合(图5)。
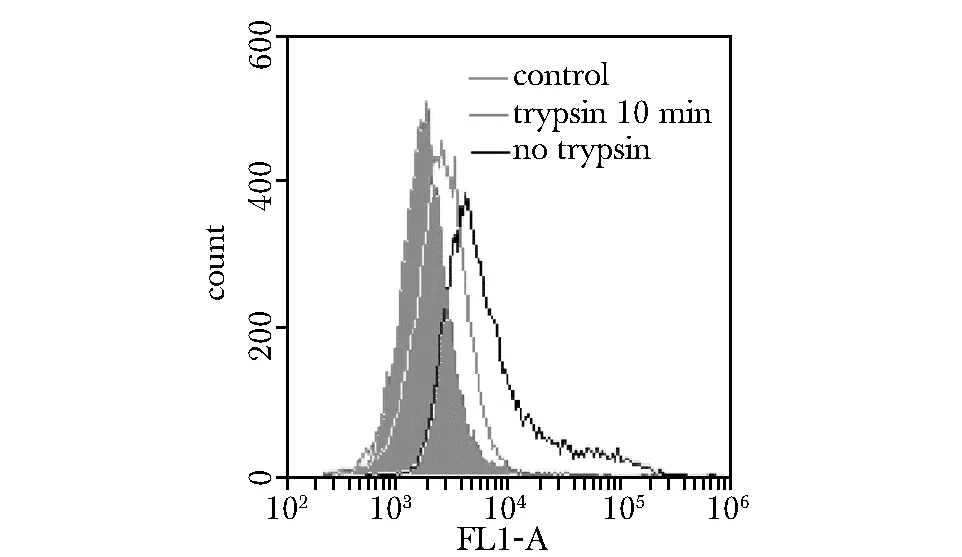
Flow cytometry profiles of CE4-1’s binding to untreated Raji cells (black curve), and Raji cells treated with trypsin for 10 min (grey curve); the filled histogram represents the control fluorescent signals generated by FITC-labeled random DNA from the library pool图5 胞膜外CD20蛋白对适配体CE4-1与细胞结合的影响Fig 5 The influence generated by CD20 protein in the binding between aptamer CE4-1 and cells
3 讨论
CD20是治疗NHL的理想靶点之一[4-9];与传统化疗相比,CD20单克隆抗体靶向药物美罗华可改善NHL的治疗效果。然而,临床治疗中发现一部分病人对美罗华不敏感,且很多患者会产生耐药性[10],所以目前亟需研发新型的CD20靶向治疗。核酸适配体在肿瘤的靶向治疗方面拥有良好的应用前景[8-11],但迄今为止文献中尚未见关于CD20适配体的报道。本研究进行了CD20适配体的筛选,随着SELEX筛选圈数的推进,成功富集到能够结合靶标CD20多肽的核酸适配体。经克隆测序后,从富集库中获得了一种能结合CD20靶标的适配体CE4-1。CE4-1能结合CD20结构,但与BSA的结合很弱,表明该适配体与CD20的结合具有一定的特异性。同时,CE4-1与CD20阳性淋巴瘤细胞Raji和Ramos有较强结合,而与CD20阴性细胞的结合较弱,表明CE4-1能特异性地识别CD20阳性淋巴瘤细胞。然而,如将CD20阳性细胞用胰酶处理,CE4-1与细胞的结合明显减弱,说明该适配体与细胞的结合位点是胞膜蛋白。
上述结果显示,除抗体以外,适配体也可用于识别CD20。本研究研发的适配体CE4-1能够结合CD20阳性的淋巴瘤细胞,如将CE4-1连接于载药脂质体或纳米颗粒,则有可能构建出针对NHL的新型靶向治疗系统。未来研究可注重于改进该适配体的性能,使之在NHL的靶向诊疗方面具有更好的应用潜能。
[1] Datta S, Chatterjee S, Policegoudra RS,etal. Hepatitis viruses and non-Hodgkin’s lymphoma: A review [J]. World J Virol, 2012, 1: 162-173.
[2] Boffetta P. Epidemiology of adult non-Hodgkin lymphoma [J]. Ann Oncol, 2011, 22 Suppl 4: 27-31
[3] Hu Y, Duan J, Zhan Q,etal. Novel MUC1 aptamer selectively delivers cytotoxic agent to cancer cellsinvitro[J]. PLoS One, 2012, 7: e31970, 10.1371/journal.pone.0031970.
[4] Lim SH, Beers SA, French RR,etal. Anti-CD20 monoclonal antibodies: historical and future perspectives [J]. Haematologica, 2010, 95: 135-143.
[5] Hiddemann W. Non-Hodgkin’s lymphomas—current status of therapy and future perspectives [J]. Eur J Cancer, 1995, 31: 2141-2145.
[6] Perosa F, Favoino E, Caragnano MA,etal. CD20: a target antigen for immunotherapy of autoimmune diseases [J]. Autoimmun Rev, 2005, 4: 526-531.
[7] Rezvani AR, Maloney DG. Rituximab resistance[J]. Best Pract Res Clin Haematol, 2011, 24: 203-216.
[8] Ray P, Viles KD, Soule EE,etal. Application of aptamers for targeted therapeutics [J]. Arch Immunol Ther Exp (Warsz), 2013, 61: 255-271.
[9] Van Meerten T, Hagenbeek A. CD20-targeted therapy: the next generation of antibodies [J]. Semin Hematol, 2010, 47: 199-210.
[10] Jazirehi AR, Bonavida B. Development of rituximab-resistant B-NHL clones: aninvitromodel for studying tumor resistance to monoclonal antibody-mediated immunotherapy [J]. Methods Mol Biol, 2011, 731: 407-419.
[11] Tan W, Wang H, Chen Y,etal. Molecular aptamers for drug delivery. Trends Biotechnol [J]. Trends Biotechnol, 2011, 29: 634-640.
Selection and identification of a novel DNA aptamer against CD20 molecule
ZHANG Li-yu1, HU Yan1, CAO Bei-bei1, DUAN Jin-hong1, LIU Zhe2, YANG Xian-da1*
(1.Dept. of Physiology and Pathophsiology, Institute of Basic Medical Sciences, CAMS amp; PUMC, Beijing 100005;2.Laboratory of Clinical Genetics, Peking Union Medical College Hospital, CAMS amp; PUMC, Beijing 100005, China)
ObjectiveTo develop a CD20 aptamer that may potentially serve as a tumor-homing ligand for targeted therapy against non-Hodgkin’s lymphoma (NHL).MethodsA single-stranded 59nt DNA library containing 21 nt random oligonucleotides was synthesized. A new CD20 aptamer termed CE4-1 was developed with SELEX technique, using a CD20 epitope as the target. Flow cytometry was performed to monitor the enrichment of the selected DNA pool, and the binding properties of CE4-1 towards CD20 structure and CD20-positive cells. The structure of CE4-1 was predicted by MFold software.ResultsThe DNA aptamer CE4-1 could selectively bind with CD20 structure and CD20-positive cells, with minimal cross reactivity to BSA and CD20-negative cells. Additionally, trypsin treatment greatly reduced the binding of CE4-1 to CD20-positive cells.ConclusionsA novel CD20 aptamer CE4-1 may recognize CD20 structure and CD20-positive cells selectively, which may have application potentials in targeted therapy against the CD20-positive tumors.
aptamer; SELEX; CD20
2013-12-26
2014-03-12
科技部重大科学计划(2011CB933504)
*通信作者(correspondingauthor):ayangmd@gmail.com
1001-6325(2014)05-0628-05
R 733.7
A

