猪轮状病毒L1株VP7基因克隆及序列分析
陈晓春,王继文,吴华伟* ,蔡青秀,邓 永,高金源,郎洪武
(1.中国兽医药品监察所,北京100081;2.北京出入境检验检疫局,北京100026)
猪轮状病毒(Porcine Rotavirus,PRV)属于呼肠孤病毒科(Reoviridae)轮状病毒属[1](Rotavirus),是引起仔猪严重腹泻的主要病原之一,能引起仔猪腹泻、厌食、呕吐、脱水等症状,仔猪机体免疫力急剧下降,常诱发多种疾病的继发感染,导致仔猪死亡或生长迟缓,给养猪业造成严重的经济损失[2]。
RV粒子无囊膜,具有双层衣壳结构,基因组由11个不连续双股正链RNA片段组成,分别编码6种结构蛋白和5种非结构蛋白。VP7是一种糖基化蛋白,由326个氨基酸组成,因毒株的不同,可由7、8或9基因编码,与VP4蛋白一起构成病毒粒子的最外层核衣壳,是病毒的主要中和抗原,在病毒检测、分型、产生中和抗体及免疫性保护过程中具有重要意义[2]。轮状病毒根据群特异性(由群抗原VP6决定)可分为7个群(A~G),其中可感染猪的有A、B、C和E4个群,以A群为主。根据VP7蛋白血清学特性,又可将A群轮状病毒分为不同的G血清型(glycoprotein-sensitive),而不同血清型之间的交叉保护作用甚微[3]。A群轮状病毒已被证实至少存在26个G型[5]。其中猪轮状病毒至少有12个 G 型(G1-G6,G8-G12,G26)。我国自 20世纪80年代初发现猪轮状病毒病以来,与猪流行性腹泻病和猪传染性胃肠炎病一起被视为造成仔猪病毒性腹泻的三大顽疾。目前,我国尚没有针对猪轮状病毒的商品化疫苗,对于该病的预防仍是空白。本研究将新近分离到的一株猪轮状病毒进行了VP7基因的克隆及序列分析,并根据2008年RCWG(Rotavirus Classification Working group)发布的轮状病毒基因型分类方法[4]进行了基因型的鉴定,为进一步了解我国猪轮状病毒的流行情况,研制安全有效的疫苗提供有益的参考。
1 材料与方法
1.1 毒株 猪轮状病毒L1株病毒,由中国兽医药品监察所病毒制品检测室分离鉴定[6]。猪轮状病毒阳性对照(AV59)[7],由中国兽医药品监察所菌种保藏中心提供。
1.2 主要试剂 DMEM培养基、胎牛血清、胰酶等购自Gibco公司;Ex Taq聚合酶、dNTP、琼脂糖、DNA marker DL2000等为 TaKaRa公司产品;Go-TaqⓇGreen Master Mix为Promega公司产品;反转录酶、RNA酶抑制剂、TRIzol试剂盒购自invitrogen公司;DNA纯化试剂盒购自Omega公司;其他化学试剂均为国产分析纯产品。
1.3 引物设计与合成 根据GenBank公布的猪轮状病毒VP7基因序列设计1对引物,序列分别为P1:5’-ATGTATGGTATTGAATATACCACA-3’;P2:5’-GGTCACATCATACAATTCTAATCTA-3’,用于扩增VP7基因。引物由北京六合华大基因科技股份有限公司合成。
1.4 VP7基因克隆及序列分析 取猪轮状病毒L1株病毒液按Trizol试剂盒说明书方法进行RNA抽提,经反转录程序后,进行PCR扩增。反应条件为:94℃预变性5 min,94℃变性45 s、55℃退火45 s、72℃延伸1 min、35个循环,72℃后延伸 10 min。扩增产物经1.5%琼脂糖凝胶电泳,紫外光下观察结果。经鉴定的产物送北京六合华大基因科技股份有限公司进行序列测定。利用DNAStar软件对测定的序列进行分析。参考序列信息见表1。
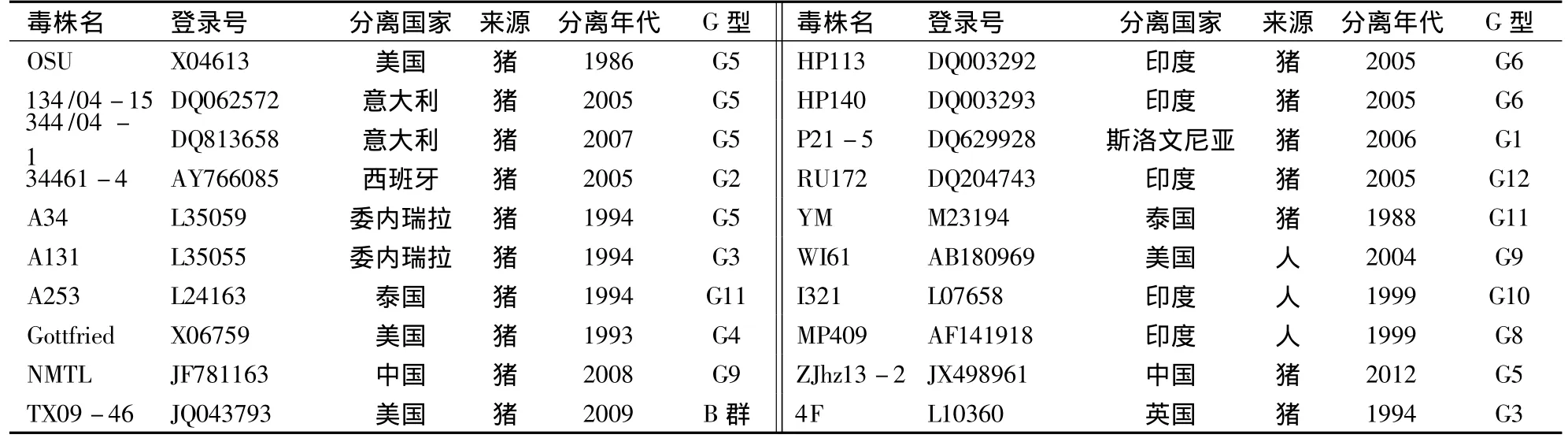
表1 比对参考序列信息
2 结果与分析
2.1 VP7基因的扩增 以L1株病毒液反转录cDNA为模板,进行VP7基因PCR扩增,产物经凝胶电泳后,在凝胶成像系统中观察,分别可见约1062 bp左右特异性目的条带,与预期结果相符(图1)。
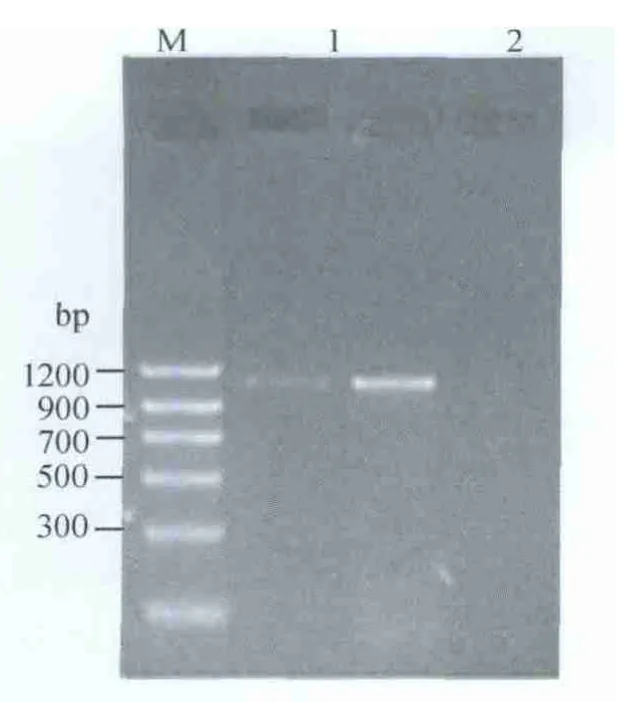
图1 猪轮状病毒L1株VP7基因扩增结果
2.2 序列分析及基因型的鉴定 经测序证实获得了猪轮状病毒L1株VP7基因全长序列,共1062 bp,包括5’端非编码区48 bp,3’端非编码区33 bp,中间为一个完整的ORF,共981 bp,编码326个氨基酸。按照RCWG公布的轮状病毒基因分型方法进行基因分型(图2右上),结果显示L1株与经典的G5型毒株OSU、A34、134-04-15和344-04-1同源性最高,在88.8% ~93.7%之间,由此推测L1株为G5型猪轮状病毒。与GenBank上中国分离的其他毒株序列的比较发现,L1株与ZJhz13-2株同源性最高,为97.8%,与近几年分离的G9型猪轮状病毒(NMTL株)同源性较低,为77.7%。核苷酸推导的氨基酸序列分析结果(图2左下)显示,L1株与G5型毒株间同源性都在93.3%以上,与同型的中国分离株ZJhz13-2株同源性为96%,与G9型NMTL株推导的氨基酸同源性为82%,各毒株间氨基酸同源性普遍高于核苷酸同源性,说明同型猪轮状病毒基因的有意突变仅发生在有限的区域。
通过抗原表位分析(图3)发现,L1株VP7蛋白抗原表位与 G9型毒株在 aa25~aa29、aa86~aa102、aa142 ~ aa152、aa211 ~ aa226、aa263 ~ aa286等区域存在明显不同,可能是两个血清型间存在抗原差异的原因。
核苷酸系统进化树分析结果(图4)表明,L1株、2012年中国分离株ZJhzI3-2同属一个分支,并与G5型代表株同属一个群,进一步证实L1毒株血清型为G5型。
3 讨论

图2 PRV VP7基因核苷酸序列与推导的氨基酸序列同源性比较
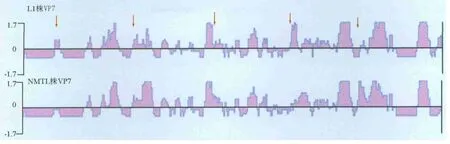
图3 PRV L1株VP7与G9型毒株间抗原表位分析与比较
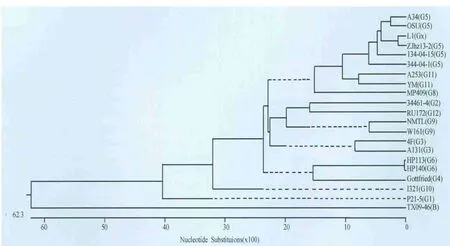
图4 PRV VP7核苷酸系统进化树分析
VP6基因是最先用于轮状病毒分型的基因片段[4]。采用VP6上不同抗原表位的单克隆抗体可将轮状病毒分为SGI、SGII、SGI+II、SGI-、SGII-[8],通过分子生物的方法对比发现[9],SGI单独属于基因 I型,而 SGII、SGI+II、SGI-、SGII-共同属于基因II型。直到20世纪90年代末,人们开始认识到单单通过一种因素很难界定轮状病毒的亚型。通过血清学试验发现,VP4和VP7均能独立诱导机体产生中和抗体,通过VP4和VP7双重标准可将轮状病毒分为P型(protease-sensitive)和G型(glycoprotein-sensitive)[10]。但由于通过血清学方法进行分型需要收集、制备和鉴定大量的参照毒株及特异性血清,给新毒株的分型带来极大的困难,因此,采用基因序列分析进行分型越来越受到人们关注。2008年,RCWG(Rotavirus Classification Working group)发布了轮状病毒基因型分类方法[5],分别以 Gx-P[x]-Ix-Rx-Cx-Mx-Ax-Nx-Tx-Ex-Hx代表VP7-VP4-VP6-VP1-VP2-VP3-NSP1-NSP2-NSP3-NSP4-NSP5/6基因型,并规定了各片段同源性分别在80%、80%、85%、83%、84%、81%、79%、85%、85%、85%、91%以上者可确定为同一基因型。其中G基因型与G血清型基本一致,P基因型和血清型有所不同,一般是在P血清型基础上增加[x]以表示其基因型[5]。
本研究参考RCWG分类法将PRVL1株鉴定为G5型猪轮状病毒。在2005年以前我国及日本、泰国等东南亚国家以G3、G5流行为主,之后陆续有G9、G10和G11型毒株流行的报道,但我国目前仍以G5和G9型为主[3]。据报道,VP7基因存在高变区[11],且涉及到中和抗原位点的编码,不同型的轮状病毒间交叉保护性较差,并且不同血清型毒株混合感染同一宿主时,可能发生基因交换、交叉或重排[12]。本文通过抗原表位分析发现,L1株与我国近年来分离到的G9型猪轮状病毒的VP7的抗原表位上存在一定的差异,是否对两个基因型交叉保护效果存在影响还需进一步研究。
VP7是轮状病毒主要的免疫保护性抗原,在刺激机体产生中和抗体,清除病毒感染方面具有重要的作用。因此,针对VP7进行分型具有重要的意义,能为该病的有效防治提供重要的依据和参考。
[1]陆承平.兽医微生物学(第四版)[M].北京:中国农业出版社,2010:399-400.
[2]任文华,崔志洪.猪轮状病毒概述[J].畜牧兽医杂志,2005,24(5):21-25.
[3]高秀春,时洪艳,佟有恩.A群猪轮状病毒JS株VP7基因序列分析[J].中国预防兽医学报,2007,29(5):359-362.
[4]JelleMatthijnssens,MaxCiarlet,MustafizurRahman,et al.Recommendations for the classification of group A rotaviruses using all 11 genomic RNA segments[J].Arch Virol,2008,153:1621-1629.
[5]Ayako Miyazaki,Kazufumi Kuga,TohruSuzaki,et al.Genetic diversityof group A rotaviruses associatied with repeated outbreaks of diarrhea in a farrow-to-finish farm:identification of a porcine rotavirus strain bearing a novel VP7 genotype,G26.[J].Veterinary Research,2011,(42):112-122.
[6]陈晓春,吴华伟,张广川,等.猪轮状病毒的分离与鉴定[J].中国兽药杂志,2013,47(9):4-7.
[7]中国兽医药品监察所和中国兽医微生物菌种保藏管理中心.中国兽医菌种目录(2008年版)[S].
[8]Ciarlet M,Estes M.Rotaviruses:basic biology,epidemiology and methodologies[J].Britton G(ed)Encyclopedia ofenvironmental microbiology,2002:2573–2773.
[9]Iturriza Go'mara M,Wong C,et al.Molecular characterization of VP6 genes of human rota-virus isolates:correlation of genogroups with subgroups andevidence of independent segregation[J].J Virol,2002,76:6596–6601.
[10]Estes M,Kapikian A.Rotaviruses[J].Fields virology,5thedn.Kluwer Health/Lippincott.2007,1917-1974.
[11]Coulson Bs,KirkwoodC.Relation of VP7 amino acid sequence to monoclonal antibody neutralization of rotavirus and rotavirus monotype[J].Journal of Virology,1991,65(11):5968-5974.
[12]Diwakarla C S,Palombo E A.Genetic and antigentic variation of capsid protein VP7 of serotype G1 human rotavirus isolates[J].J Gen Virul,1999,80:341-344.

