禽白血病病毒p27蛋白在大肠杆菌中的表达和多克隆抗体的制备
毛娅卿,王 嘉,吴 涛,王 哲,蒋桃珍
(中国兽医药品监察所,北京100081)
禽白血病是由禽白血病/肉瘤群病毒引起的禽的多种肿瘤性疾病的总称[1]。1997和1998年,J亚群禽白血病在世界范围内爆发,给养禽业造成了巨大的经济损失[2-3]。目前该病尚无彻底可行的防治措施,主要是通过病原检测淘汰阳性鸡以净化种群[4-5]。
禽白血病病毒的主要结构蛋白包括核心蛋白(gag)、酶蛋白(pol)和囊膜蛋白(env)。核心蛋白中的p27蛋白分子量为27 kD,为主要的群特异性抗原[6]。在禽白血病/肉瘤群病毒的检测试验中,均以p27作为抗原制备群特异性抗体,从而建立相应的病毒检测方法[7-8]。本实验室前期利用电泳方法提取p27蛋白,制备兔抗p27多克隆抗体,并成功研制了禽白血病病毒 ELISA抗原检测试剂盒[9]。但此方法分离提取的p27蛋白,产量少,成本较高,不利于该试剂盒的商品化生产与应用,目前该试剂盒为实验室生产。因此我们在前期实验室工作的基础上,拟利用大肠杆菌表达p27蛋白并制备兔抗p27多抗,从而建立成熟稳定适合于规模化生产的p27蛋白及兔抗p27多抗的生产和纯化工艺。
1 材料与方法
1.1 病毒和酶标抗体 禽白血病病毒(RAV-1株、RAV-2株)由中国兽医药品监察所供。辣根过氧化物酶标记的兔抗p27抗体由本实验室制备。
1.2 实验动物 SPF鸡胚和4月龄新西兰大耳白兔均购自北京梅里亚维通实验动物技术有限公司。
1.3 主要试剂及试剂盒 克隆质粒载体pMDl8-T、T4 DNA连接酶、IPTG、RT-PCR 试剂盒,购自大连宝生物工程有限公司;工程菌DH5a、BL21(DE3)、原核表达载体pET-28a(+)由本实验室保存;RNA提取试剂盒、DNA凝胶回收提取试剂盒购自TIANGEN公司;His TrapTMkit、HiTrap rProtein G HP 购自 GE healthcare公司;弗氏完全佐剂(CFA)、弗氏不完全佐剂(IFA)均为中国兽医药品监察所供。
1.4 p27基因的克隆
1.4.1 病毒的增殖 取10日龄SPF鸡胚按标准方法制备鸡胚成纤维细胞(约106个/mL),分装到25 cm2瓶中,8 mL/瓶,置37℃二氧化碳培养箱培养,24 h形成单层后接种RAV-1、RAV-2株毒液(10倍稀释)0.1 mL,置37℃二氧化碳培养箱21 d。在此期间每隔5~7 d传代一次,共传代2次,病毒液于-80℃冻存备用。
1.4.2 病毒总RNA的提取 取经ELISA检测呈阳性的细胞,吸取上清,用RNA提取试剂盒提取病毒总RNA。
1.4.3 引物设计及RT-PCR扩增 根据GenBank上发表的 p27序列,设计下列引物:上游引物:5’-GGATCCGCCATG CCTGTAGTGATT-3’,下游引物:5’-GTCGACCTAGGGCTGGATAGCAGAC-3’。用上述引物进行一步法RT-PCR反应,在保持阅读框架不变的前提下,上游引物引入BamH I酶切位点,下游引物引入SalI酶切位点,反应条件为50℃ 30 min,95℃预变性5 min,然后94℃ 1 min,56℃ 1 min,72℃ 1 min,共30个循环;最后72℃反应10 min。
1.4.4 重组克隆载体pMD-p27的构建与鉴定RT-PCR扩增产物进行琼脂糖凝胶电泳鉴定,并用凝胶回收试剂盒回收PCR产物。将纯化的RT-PCR产物与pMD-T载体连接,转化大肠杆菌DH5a,送英骏生物技术有限公司测序。测序结果的序列拼接、校正和分析使用DNA Club、PrimerPremier5及基于Internet上的BLAST分析软件。
1.5 重组表达质粒的构建 将测序正确的重组质粒用BamH I和Sal I双酶切获得p27基因片断,表达载体pET-28a(+)也用相同的酶消化,回收并纯化。p27基因与双酶切的表达载体连接,转化到DH5a中,然后用菌液进行PCR和酶切鉴定,得到重组的表达质粒pET28a-p27。
1.6 重组p27质粒的诱导表达和鉴定 将双酶切鉴定为阳性的重组质粒pET28a-p27转化大肠杆菌BL2l(DE3),挑选生长良好的阳性单菌落37℃活化过夜,转接种于LB培养基中37℃培养2~3 h(OD600nm至0.6~0.8),加入IPTG至终浓度为0.5 mmol/L,30℃诱导表达4 h,4℃ 5000 r/min离心15 min,弃去培养液,收集细菌沉淀。将收取的菌体用pH 7.4的PBS离心洗涤3次,悬于10 mmol/L Tris-HCl(pH 8.0)溶液,超声破菌,4℃12000 r/min离心10 min收集上清。离心沉淀再次用PBS重悬,上清和沉淀分别进行SDS-PAGE检测。
1.7 p27蛋白在大肠杆菌中的大量表达与纯化将上述阳性菌液转接5 mL于500 mL的LB培养基中低温诱导表达,收集菌体超声破碎后上清利用金属螯合柱进行纯化、洗脱、收集蛋白,进行SDSPAGE分析。
1.8 兔抗p27蛋白多克隆抗体的制备、ELISA和SDS-PAGE检测
1.8.1 兔抗p27血清的制备 将纯化的p27蛋白溶液与弗氏完全佐剂以1∶1混合乳化后,对试验兔进行背部多点皮内注射免疫。两周后再用纯化的p27蛋白溶液与弗氏不完全佐剂以1∶1混合乳化后,对试验兔进行背部多点皮下及肌肉注射免疫。二免后两周再以同样的方法进行第三次免疫。三次免疫不同时间后经耳缘静脉采血分离血清,然后用纯化后的p27蛋白检测血清抗体效价。血清效价满足试验要求即可采血分离血清。
1.8.2 多克隆抗体的纯化 采集的兔抗p27抗血清利用HiTrap rProtein G HP(GE)进行纯化、洗脱、收集蛋白,并进行SDS-PAGE分析。
2 结果
2.1 RT-PCR扩增结果 RT-PCR产物经1%的琼脂糖凝胶电泳,扩增的片段约为740 bp(图1),与预期大小相符。
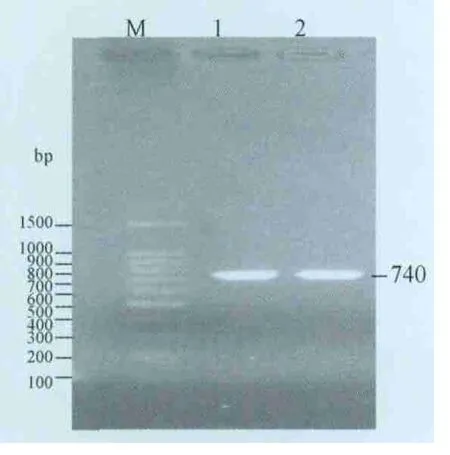
图1 p27基因的RT-PCR扩增
2.2 重组克隆载体pMD-p27的构建与鉴定 将扩增片段克隆到pMD-18T载体,经BamH I/Sal I双酶切,消化得2650 bp和740 bp的片段(图2),与预期结果相符,将重组质粒命名为pMD-p27。
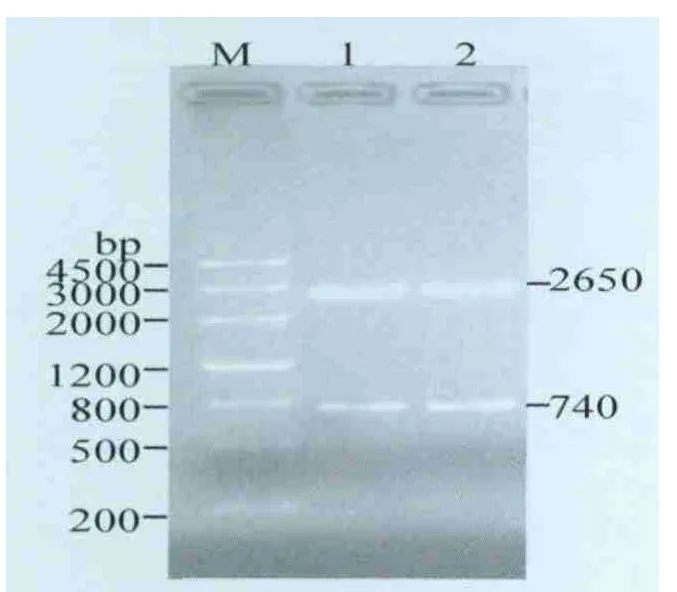
图2 重组克隆载体pMD-p27的酶切鉴定
2.3 重组表达质粒(pET28a-p27)的双酶切鉴定 重组质粒(pET28a-p27)经BamH I及Sal I双酶切后,电泳可见到两条大小分别为5369 bp和740 bp的条带(图3),与预期结果相符。
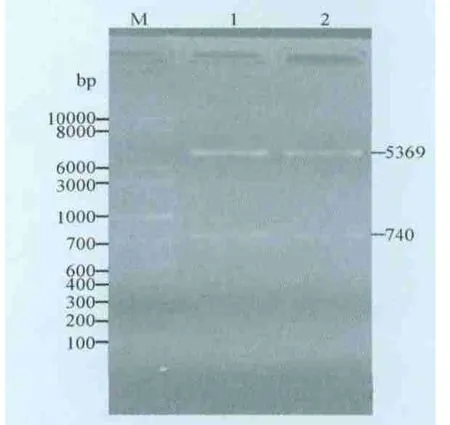
图3 重组表达载体pET28a-p27的酶切鉴定
2.4 p27蛋白在大肠杆菌中的诱导表达 将酶切鉴定为阳性的重组质粒转化入BL21(DE3),挑取阳性克隆接种LB培养基中,IPTG 30℃诱导表达4 h,菌体处理后进行SDS-PAGE分析,约在27 kD处有1条明显的诱导蛋白条带。结果说明目的蛋白主要以可溶性蛋白的形式在大肠杆菌细胞内表达(图4)。
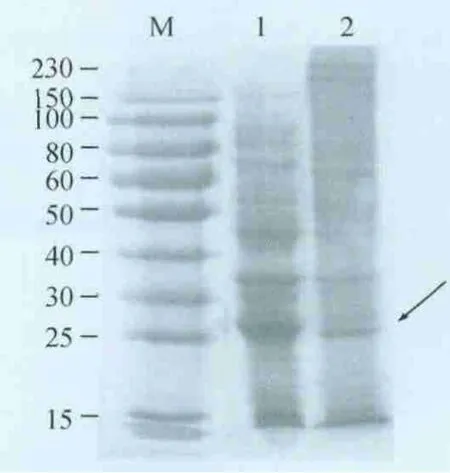
图4 融合蛋白在大肠杆菌中的诱导表达
2.5 表达蛋白的Western blot鉴定 Western印迹分析表明,在诱导上清中出现约27 kD的反应带(图5),与融合蛋白的分子量大小基本一致,表明已经成功表达p27蛋白。
2.6 表达蛋白的纯化 重组表达质粒pET28a-p27上含有6个组氨酸,利用镍离子金属螯和柱纯化大肠杆菌表达的6 His-p27融合蛋白,用不同浓度的咪唑进行洗脱,SDS-PAGE结果表明获得了理想的纯化产物(图6)。
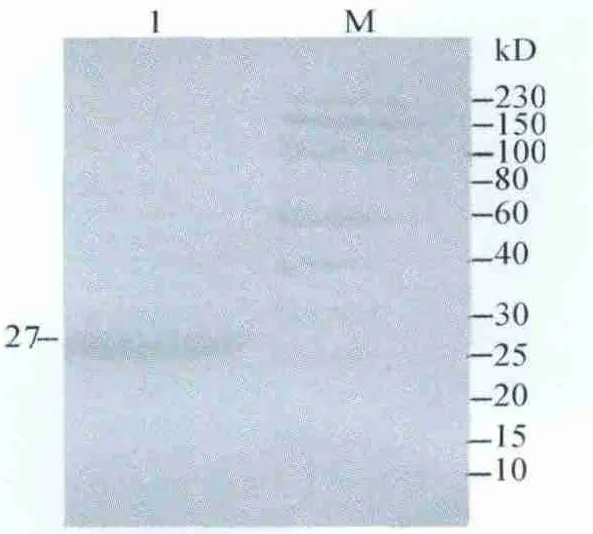
图5 表达产物的Western blot分析
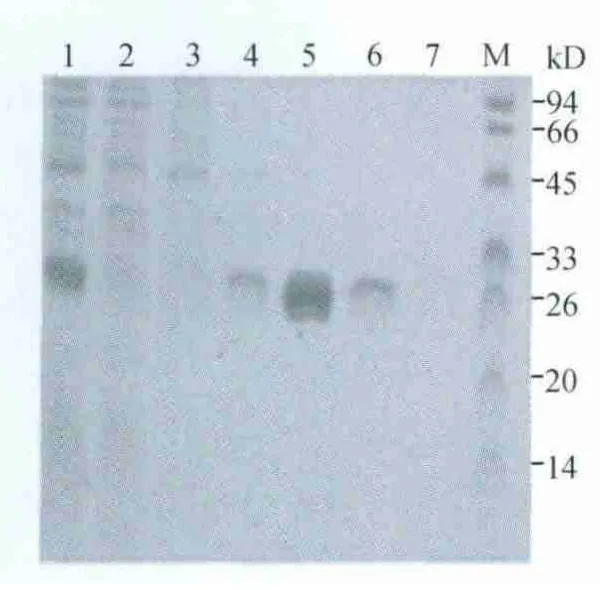
图6 表达蛋白的纯化
2.7 兔抗p27蛋白抗体的效价测定 以p27蛋白免疫前的兔血清做对照,用ELISA法测定抗体效价。抗体效价为大于最高OD值的50%所对应的血清稀释度。结果显示,二免后1周两只兔子的血清效价均达1∶12800(表1);三免后1周两只兔子的血清效价均达1∶25600(表2)。
2.8 兔抗p27蛋白抗体的纯化 采集的兔抗p27血清利用HiTrap rProtein G HP(GE)进行纯化、洗脱、收集蛋白,并进行SDS-PAGE分析,结果为单一条带(图7),表明所采用的柱层析方法适合于兔血清IgG的纯化。
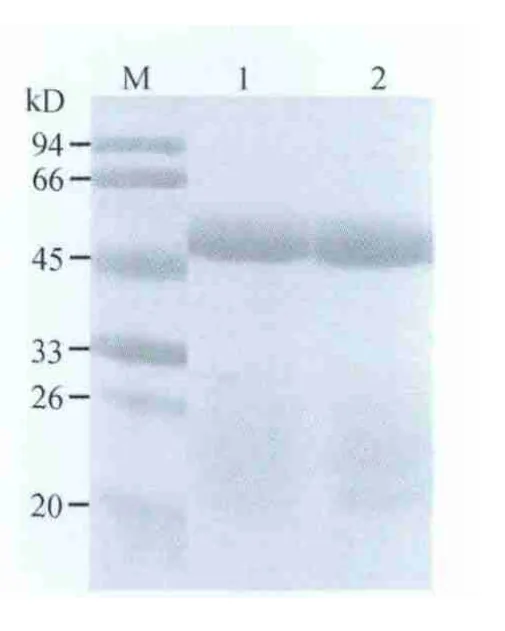
图7 兔抗P27抗体的SDS-PAGE分析
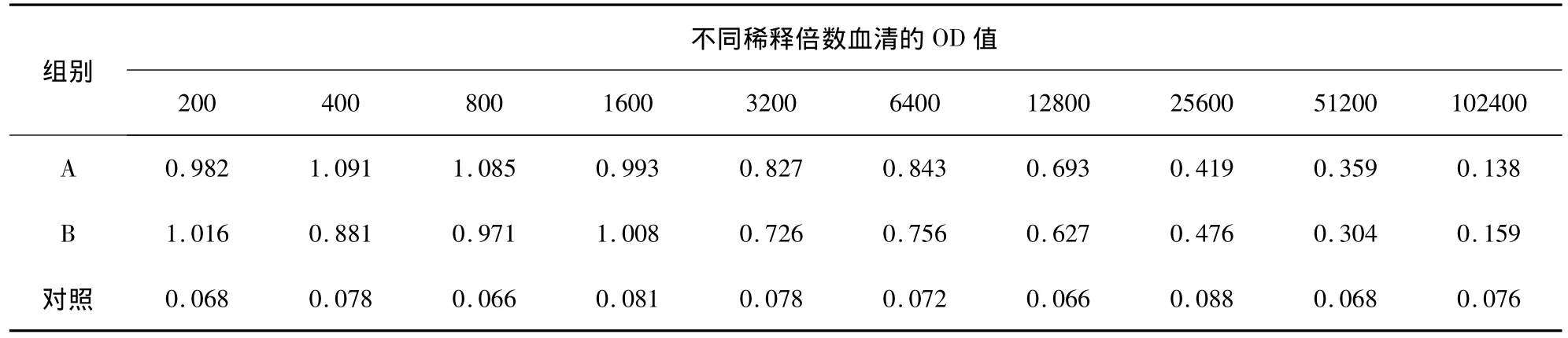
表1 二免后1周ELISA检测血清OD值
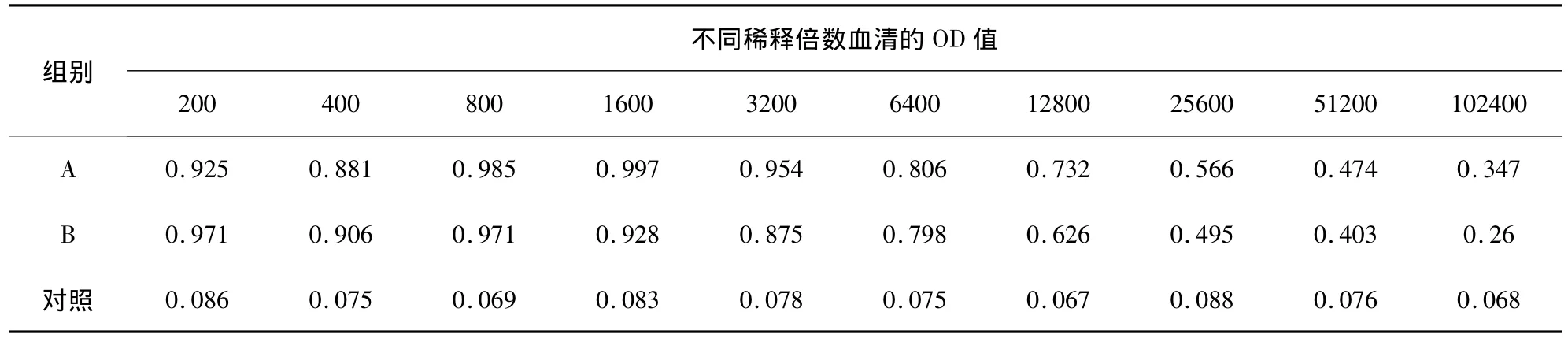
表2 三免后1周ELISA检测血清OD值
3 讨论
禽白血病病毒其核心蛋白中的p27蛋白是主要的群特异性抗原,对于禽白血病的诊断有重要的意义。本实验室前期将大量的ALV细胞培养液经超速离心浓缩和纯化后,首次在国内通过电泳分离法制备了高纯度、具有较好的抗原活性的p27蛋白,并成功制备兔抗p27抗体,但是由于禽白血病病毒在细胞上增殖滴度低,获取大量的病毒液比较的费时费力,不利于规模化生产p27蛋白。利用大肠杆菌表达目的蛋白具有成本低、周期短,操作简便,表达蛋白可大量生产、易于纯化等诸多优点,因而普遍为人们所采用。因此,我们克隆了禽白血病病毒p27基因,成功构建pET28a-p27重组质粒,该质粒在大肠杆菌BL21中经IPTG诱导后高效的表达目的蛋白。虽然其质粒上带有组氨酸标签,但由于其分子量小,生理条件下不带电荷,而且免疫原性较差,在体内不易产生抗体,试验结果表明该标签对目的蛋白的结构与功能影响很小。由于目的蛋白带有组氨酸标签,使蛋白的纯化工艺简单,容易满足目的蛋白的大规模纯化。
大肠杆菌表达ALV的p27重组蛋白具有良好的免疫原性,免疫家兔后可产生高效价的抗p27血清,ELISA效价达1∶25600,这与电泳纯化病毒p27蛋白免疫家兔所产生的抗体效价基本一致。因此采用大肠杆菌表达p27蛋白制备抗体,为后续研制禽白血病病毒ELISA检测试剂盒奠定了基础。
[1]B W 卡尔尼克.禽病学[M].第10版.高 福,等译.北京:中国农业大学出版杜,1999:529.
[2]Johnson E S.Poultry oncogenic retroviruses and humans[J].Gancer Detect Prev,1994,18:9-30.
[3]李新华.禽白血病流行病学特点及防制措施[J].养禽与禽病防治,1997,(4):11-12.
[4]陈 晨,曹 红,陈富勇,等.抗禽白血病p27抗原单克隆抗体的制备与鉴定[J].中国预防兽医学报,2005,27(4):287-289.
[5]崔治中.鸡白血病及其鉴别诊断和预防控制[J].中国家禽,2010,32(8):1-12.
[6]殷 震,李景华.动物病毒学[M].第2版.北京:科学出版社,1997837-884.
[7]Mizuno Y,Itohara S.Enzyme-linked immunosorbent assay to detect surgroup-specific antibodys to avian leucosis viruses[J].Acta Virol,1986,30(2):103-181.
[8]Smith E J,A Fadly,W Okazaki.An enzyme-linked immunosorbent assay for detecting avian leucosis-sarcoma viruses[J].Avian Dis,1979,23:698-707.
[9]蒋桃珍,谷 红,李 宁,等.禽白血病肉瘤病毒群特异性抗原p27的分离纯化及其抗体的制备[J].中国兽药杂志,2006,40(10):1-4.

