大口黑鲈不同组织中抗菌肽粗提及抑菌活性测定
董晓庆,张东鸣* ,曲桂娟,陈玉珂,王清滨,郭 玮,王秋举,杨翼羽
(1.吉林农业大学 动物科技学院,吉林长春130118;2.吉林省畜牧总站,吉林长春130062)
抗菌肽是植物、昆虫、鱼、虾、贝类等防御系统的主要成分之一,具有高效的抗菌活性,对部分病毒也有抑制作用[1-2],对真核细胞几乎没有作用[3],被认为是天然免疫的重要介质。大口黑鲈(Microptorus salmonoides)又名加州鲈,原产于美洲地区,为肉食性温水鱼类。其肉质鲜美、生长快、经济价值较高。近年来,大口黑鲈养殖驯化发展迅速,但对大口黑鲈的免疫机制了解甚少,直接制约了大口黑鲈养殖的免疫预防和病害防治。本文以新鲜大口黑鲈为材料,5%乙酸为提取液从大口黑鲈不同组织中提取抗菌肽粗提物,并对其粗提物进行了抑菌活性检测,为进一步研究大口黑鲈的非特异性免疫奠定了基础。
1 材料与方法
1.1 材料 菌种为嗜水气单胞菌(Aeromonas hydrophila)中国微生物保藏中心提供;大肠杆菌(Escherichia coli)吉林农业大学药理实验室提供;链球菌(Streptococcus)吉林农业大学药理实验室提供。考马斯亮蓝G250;标准牛血清白蛋白,SephadexG-25凝胶过滤柱。
1.2 试验动物及取材 选择体况健康的活体大口黑鲈(购于水产市场),将鱼置于冰板上,将其表面撒少许氯化钠,促进其粘液分泌迅速用刀片将体表的黏液刮下,放于10 mL离心管中,冰浴保存,备用。刮去皮肤表面的鱼鳞,再剥离皮肤,用蒸馏水洗去血水,去掉膜组织、脂肪组织后冰浴保存,剖开腹腔,迅速采集肝脏、脾、卵、鳃等组织称重,冰浴保存,备用。
1.3 方法
1.3.1 组织中抗菌物质的提取 采用5%乙酸提取法[4]。皮肤组织先用剪刀剪碎,其他组织可用研钵研碎后,分装到10 mL离心管中,进行组织捣碎3次,每次10 s,超声细胞破碎10次,每次2 s,漩涡匀浆2 min,获得匀浆液。加入二倍体积的5%乙酸,4℃搅拌2 h,浸提24 h,4℃条件下10000 r/min离心30 min,取上清液,残渣中再次加入二倍体积的5%乙酸,4℃搅拌过夜,4℃条件下10000 r/min离心30 min,取上清液,合并两次上清液,用 NaOH(0.5 mol/L)调整 pH 值为7.0,4 ℃条件下10000 r/min 离心30 min,收集上清液,过0.45 μm 滤膜除去杂质,即为抗菌肽的粗提液,将粗提液注入透析袋(截留分子量3500 Da),扎紧袋口,然后将其放入装有聚乙二醇的托盘中,4℃条件下浓缩到体积接近10~20 mL,将溶液到出,-80℃保存备用。
1.3.2 粗提物蛋白质含量测定 采用考马斯亮蓝G-250法测定蛋白含量。样品中蛋白质含量(μg/g)=CVt/WVs,其中C为通过准曲线计算的值μg;Vt为粗提液总体积mL;W为样品鲜重g;Vs为测定时加样体积mL。
1.3.3 粗提物抑菌试验 采用平板法测定抑菌直径并计算抑菌率。
无菌操作,将灭菌后的营养琼脂培养基15 mL注入平板凝固后,将灭菌的滤纸片(孔的直径为6 mm)平铺于培养基上。取20 μL粗提液滴加在培养基的滤纸片上,同时设生理盐水20 μL的空白对照。再按照嗜水气单胞杆菌30℃培养24 h,大肠杆菌37℃培养12 h,链球菌37℃培养24 h,观察抑菌圈形成,测量抑菌圈直径,直径越大抑菌越强。判断标准:菌活性强弱用抑菌圈直径表示,抑菌环直径等于抑菌圈外径减滤纸直径,抑菌环直径≤10 mm为弱,11~15 mm为中,≥16 mm为强。选取具有抑菌活性的组织进行抑菌率测定。将适量的浓缩抗菌肽样品取100 μL,加 LB培养基30 μL和菌液70 μL并混匀,于30℃、37℃摇床孕育培养1 h,取50 μL涂布于LB平板,进行培养,嗜水气单胞菌、大肠杆菌,分别于30℃培养24 h,37℃培养12 h。计算菌落数,以蒸馏水为对照组。计算抑菌率。

1.3.4 肝脏粗提物分离及抑菌活性测定 将浓缩后的肝脏粗提液过0.45 μm滤膜,用于SephadexG-25(1.5 cm×30 cm)凝胶过滤层析分离。凝胶柱预处理后进行装柱、平衡、上样、洗脱。将粗提液10 mL上样于SephadexG-25凝胶过滤柱,用蠕动泵控制流速为0.5 mL/min。用0.2 mol/L乙酸钠溶液以流速0.5 mL/min洗脱,收集各峰洗脱液,每10 min收集1管。用酶标仪测各管洗脱液在280和260 nm的吸光度。计算其蛋白质浓度并进行抑菌试验,其中A280为280 nm处测得的吸光度值,A260为260 nm处测得的吸光度值。

2 结果
2.1 大口黑鲈不同组织粗提物蛋白质浓度及产率
由表1试验结果可知大口黑鲈各个组织蛋白质浓度分别为:粘液0.276、皮肤 0.718、肝脏 0.567、鳃 0.426、卵2.515、脾 0.351 mg/mL。抗菌提取物产率分别为粘液0.0023%、皮肤 0.03%、肝脏 0.263%、鳃0.041%、卵0.215%、脾0.171%。其中只有肝脏和卵的产率达到了0.2%以上,脾的产率达到0.17%。

表1 大口黑鲈不同组织粗提物蛋白质浓度及产率
2.2 粗提物抑菌活性及抑菌率 由表2和表3可知粘液、皮肤、肝脏组织抗菌肽粗体物对嗜水气单胞菌的抑菌有中等强度的抑菌活性,抑菌圈直径分别为12.30、13.50 和12.10 cm。皮肤、肝脏抗菌肽粗提物对大肠杆菌具有较弱的抑菌活性,抑菌圈直径分别为10.08和9.20 cm。各组织对链球菌均未见到抑菌圈。皮肤组织对嗜水气单胞菌的抑菌率大于肝脏和粘液组织,皮肤组织对大肠杆菌的抑菌率大于肝脏组织。粘液、皮肤、肝脏组织抗菌肽粗体物对嗜水气单胞菌的抑菌率分别为51.13%、59.14%和54.40%。皮肤、肝脏组织抗菌肽粗体物对大肠杆菌的抑菌率分别为50.25%和50.71%。

表2 各组织不同菌种抑菌圈直径
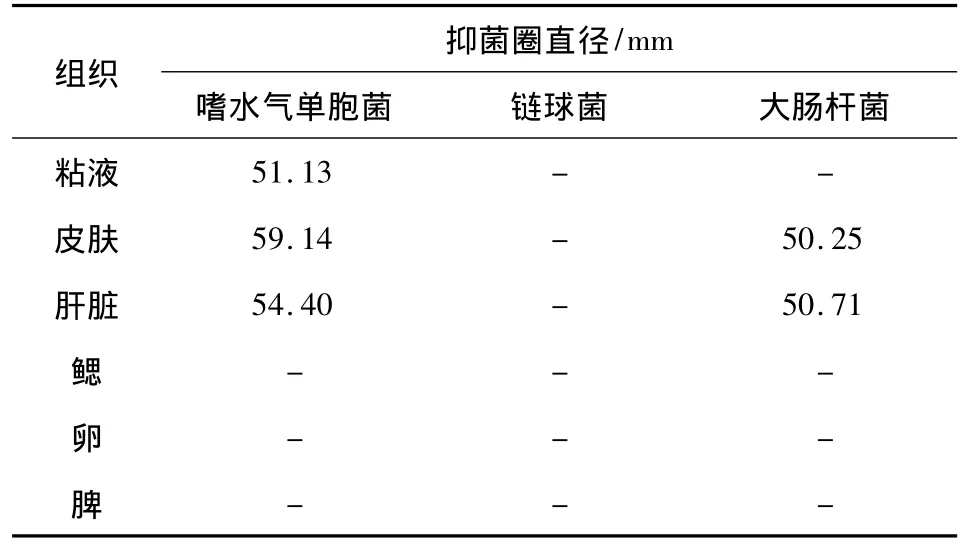
表3 各组织不同菌种抑菌率
2.3 肝脏组织粗提物初步分离及抑菌活性 肝脏组织粗提物经过凝胶过滤层析后,收集了36管洗脱液,进行抑菌试验及蛋白质浓度测定,试验结果表明嗜水气单胞菌具有抑菌活性的洗脱液出现在17、18、19、20 号管,其蛋白质浓度分别为 0.392、0.434、0.425 和 0.417 mg/mL,且只有第 18 管抑菌活性为中,其他三管均显示比较弱的抑菌活性(表4)。

表4 肝脏组织层析液蛋白浓度及抑菌活性
3 讨论与结论
抗菌肽属小分子碱性多肽,提取小分子多肽的方法主要有水浸提法、有机溶剂抽提法、有机酸抽提法等。考虑到抗菌肽具阳离子特性,采用5%乙酸浸提,既可避免强酸、强碱对其的破坏,又可以获得较高含量的抗菌肽粗提物。试验采用5%乙酸法提取大口黑鲈不同组织中抗菌肽,提取液加入量为原材料的2倍体积,采用2次加入,分别提取,并采取24 h浸提搅拌的方式,加快蛋白质溶出速度。试验结果表明大口黑鲈各个组织蛋白质浓度及产率均有不同,说明鱼体各个组织蛋白质含量存在着差异。
大量研究表明抗菌肽对水产常见病原菌具有抑菌作用[5-7]。Park 等[8]从泥鳅体上分离到一个21氨基酸的抗菌肽Misgurin,具有较强的体外广谱抗菌活性。这与本试验结果相似,试验提取的大口黑鲈皮肤、肝脏组织中的粗提物对嗜水气单胞菌和大肠杆菌均有抑菌作用。但是由于抗菌肽提取物的抑菌活性强弱受多种因素的影响,导致不同组织中抗菌活性肽的含量不同,抑菌作用也不同。皮肤、肝脏、粘液粗提物对嗜水气单胞菌有抑菌作用,且皮肤组提取物抑菌作用最强,皮肤、肝脏组织粗提物对大肠杆菌有抑菌作用,且皮肤组织抑菌活性强于肝脏组织。说明皮肤作为鱼类第二免疫防御组织在应对外来微生物入侵时起到重要的作用,不同组织所含的抗菌物质不仅量有差异,对同一细菌的抑制作用也存在差异。Fernandes等[9]从虹鳟皮肤中分离纯化得到的oncorhyncinⅡ,分析表明它对革兰阳性细菌(M.luteus和P.citreus)和革兰阴性细菌(E.coli和 L.anguillanum)均有抑制作用。Destoumieux等[10]从养殖的南美白对虾的血细胞和血浆中分离了几种抗菌活性因子,其中3种具有抗真菌和抗细菌尤其是抗革兰氏阳性菌的活力。王辉等[11]从健康牙鲆皮肤、鳃、肝脏、肾脏组织中提取得到了具有抗菌活性粗提物。各组织粗提物对大肠杆菌、鳗弧菌及鱼类鳗弧菌有较强的抑菌活性。刘倩等[12]从鲫鱼的肝、肾、鳃、皮肤粘液中提取出抗菌活性物质,对大肠杆菌和鳗弧菌具有抑菌活性。并且其抑菌效果有组织特异性。李联泰[13]从黄鳝皮肤黏液中分离纯化出具有抗菌和镇痛活性的多肽,对嗜水气单胞菌、金黄色葡萄球菌、枯草芽孢杆菌有较强的抑菌效果。陈诏等[14]从布氏石斑鱼头肾提取出抗菌肽粗提物,试验表明该粗提物不仅对金黄色葡萄球菌等革兰氏阳性菌有良好抑制作用,而且对大肠杆菌、哈氏弧菌和溶藻弧菌等革兰氏阴性菌也有良好抑制效果。苏建明等[4]从草鱼肠道组织提取出相对分子量约为6200的抗菌肽,抑菌试验表明该抗菌肽对大肠杆菌、金黄色葡萄球菌和嗜水气单胞菌均表现出较强的抗菌活性。陈成勋等[15]从革胡子鲶体表粘液中提取出抗菌肽粗提物,对迟缓爱德华氏菌、嗜水气单胞菌和对大肠杆菌均有不同程度的抑菌作用。单晓枫等[16]采用甲醇提取、SephadexG-50凝胶层析等从其体表粘液中提取抗菌肽对嗜水气单胞菌、荧光假单胞菌、鳗弧菌、溶藻弧菌、金黄色葡萄球菌、大肠杆菌等均有抑菌活性。以上研究结果表明抗菌肽存在于水产动物机体的多个组织,但同一组织中抗菌活性物质对不同细菌的抑制效果不同,不同组织中抗菌活性物质对细菌的抑菌作用也不相同,这也与本研究的结果相似。
肝脏组织粗提物通过Sephadex-G25凝胶柱过滤层析后,获得了4个保留时间的具有抑菌活性的收集液,但抑菌活性减弱。这可能是分离纯化的试验条件及操作过程导致了蛋白的生物活性部分丢失或失活,进而影响了抗菌物质的抑菌活性。因此,在以后的研究工作中应加强对分离纯化方法以及如何保存蛋白的生物活性方面的研究。
研究结果表明,大口黑鲈皮肤和肝脏组织提取物对嗜水气单胞菌、大肠杆菌具有抑菌作用。
[1]Steiner H,Hultmark D,Engstrom A,et al.Sequences and specificity of two antibacterial proteins involved in insect immunity[J].Nature,1981,292:246 -248.
[2]Hancock R E,Lehrer R.Cationic peptides:a new source of antibiotics[J].Trends- Biotechnol.1998 ,16(2):82 -88.
[3]Jaynes J M,Burton C A,Barr S B,et al.In vitro cytocidal effect of novel lytic peptides on pladmodium falciparum and trypanosome cruzi[J].FASEB J,1989,2(13):2 878 -2 883.
[4]苏建明,雷红宇,黄 平,等.草鱼肠道抗菌肽的提取及体外抑菌效果初步研究[J].湖南农业大学学报,2009,35(2):162-165.
[5]单 红,周国勤,朱银安,等.鱼类抗菌肽的研究进展[J].水产养殖,2012,33(1):20 -25.
[6]Kjuul A K,Bullesbach E E.Effects of cecropin peptides on bacteria pathogenic to fish[J].Journal of fish diseases,1999,22:387-394.
[7]姜 兰,白俊杰,邓国成,等.重组抗菌肽的制备及其对水产养殖中常见病原菌的抑菌效果[J].中国水产科学,2002,9(2):152-156.
[8]Park C B,Lee J H ,Park I Y,et al.A nowel antimicrobial peptide from the loach ,Misgurnus anguillicaudatus[J].Febs lett,1997 ,14(2-3):173-178.
[9]Fernandes J M O,Molle G,Kemp G D,et al.Isolation and characterisation of oncorhyncin II,a histone H1-derived antimicrobial peptide from skin secretions of rainbow trout,Oncorhynchusmykiss[J].Dev Comp Immunol,2004,28(2):127 -138.
[10]Detoumieuxd D.A new family of antimicrobial peptides isolated from the penaeus vannamei(Decapode)[J].J Biol Chem,1997,272:28398 -28406.
[11]王 辉,安利国,杨桂文.牙鲆不同组织抗菌肽的提取及部分性质检测[J].水产科学,2007,26(2):87 -90.
[12]刘 倩,张 帜,张海龙.鲫鱼不同组织抗菌肽抑菌活性的初步研究[J].齐鲁师范学院学报,2011,26(5):140 -143.
[13]李联泰,安贤惠,胡 江,等.黄鳝皮肤黏液抗菌肽的分离纯化及其部分特性研究[J].渔业科学进展,2011,32(2):27 -32.
[14]陈 诏,王世锋,谢珍玉,等.哈氏弧茵诱导布氏石斑鱼头肾提取物的抗菌活性研究[J].热带生物学报,2010,1(2):165-168
[15]陈成勋,王晓梅,樊振中,等.革胡子鲶体表粘液抗菌肽的分离与纯化及抑菌活性研究[J].安徽农业科学,2010,38(26):14437 -14439,14445.
[16]单晓枫,张洪波,郭伟生,等.乌鳢体表粘液抗菌肽CSM14的分离纯化及部分生物学活性研究[J].中国预防兽医学报,2010,3(32):210 -213.

