猪乙型脑炎病毒SA14-14-2疫苗株基础种子的鉴定
巢 伟,张桂红,徐 雷
(湖南中岸生物药业有限公司,长沙410100)
乙型脑炎(Japanese Encephalitis,JE)又称流行性乙型脑炎、日本乙型脑炎,简称乙脑,是由乙型脑炎病毒(Japanese Encephalitis Virus,JEV)引起的致人和动物中枢神经系统症状的人畜共患急性传染病。猪是主要宿主及传染源,人成为间接宿主,乙脑病毒形成猪—蚊—人的传播循环。因此,乙型脑炎的防治研究不但对于猪的规模化养殖有重要的意义,而且有重要的公共卫生学意义。1988年,我国开始生产原代地鼠肾细胞乙脑减毒活疫苗(SA14-14-2株),与乙脑灭活疫苗相比,抗体阳转率较高,接种针次少,副反应明显降低。目前,该疫苗是我国广泛使用的乙脑疫苗,累积接种人数超过1.5亿[1]。兽用乙脑活疫苗的应用,在国内从七十年代起,将人医选育乙型脑炎减毒株5-3株用于猪,2-8株用于马。由于两毒株各自的缺陷及其它原因,在九十年代以后停用。受SA14-14-2减毒株十多年来在我国大面积推广用于人群的成功经验,拟将SA14-14-2株作为猪用乙脑弱毒株,进行了一系列试验研究。
1 材料与方法
1.1 试剂和细胞 三价荧光抗体(牛病毒性腹泻/黏膜病病毒(BVDV/MD)、猪细小病毒(PPV)、猪瘟病毒(HCV))、绿猴肾(Vero)传代细胞、PK15传代细胞,由中国兽医药品监察所提供。流行性乙型脑炎特异性抗血清、乙脑强毒P3株(腹腔接种10~12 g小鼠半数致死量≥107.5LD50),由中国药品生物制品检定所提供。乙脑诊断试剂盒由北京生物制品研究所提供。原代地鼠肾细胞、牛睾丸细胞、0.2%红细胞悬液(豚鼠红细胞、人“O”型红细胞、鸡红细胞等量混合),本公司实验室自制。
1.2 实验动物 乙脑抗体阴性的后备母猪(体重60~70 kg)、妊娠30日健康易感初怀母猪及4~8日龄健康易感乳猪,本公司健康动物房提供。SPF级小鼠由湖南斯莱克景达实验动物有限公司提供。
1.3 基础种子批 猪乙型脑炎病毒SA14-14-2疫苗株F5代、F6代、F7代冻干毒种,病毒含量分别为 107.8TCID50/mL、107.6TCID50/mL、107.7TCID50/mL,本公司种毒室制备。
1.4 外源病毒检测
1.4.1 检验用原代细胞制备 用10~14日龄的SPF地鼠和1~4日龄健康小公牛,按常规方法制备地鼠肾原代细胞、牛睾丸细胞。分装于25 mL的方瓶,置37℃培养,长满单层后备用。
1.4.2 猪乙型脑炎冻干毒种与乙型脑炎特异性抗血清中和 将三批猪乙型脑炎基础种子冻干毒,每批取2瓶,分别用PBS液作1000倍稀释,加入乙型脑炎特异性抗血清等量混合。置37℃水浴中和90 min。
1.4.3 参照《中华人民共和国兽用生物制品规程》二○○○年版[2]“外源病毒检验法”进行荧光抗体法检查外源病毒、绿猴肾传代细胞检查外源病毒和红细胞吸附外源病毒试验。
1.4.4 用地鼠肾细胞检测伪狂犬病病毒 将中和后的猪乙型脑炎冻干毒种与血清的混合物接种地鼠肾原代细胞4瓶,培养4 d传2代,每代7 d,观察细胞病变。同时用伪狂犬病病毒Bartha-K61株接种地鼠肾原代细胞,每瓶加入含1000TCID50病毒的维持液3 mL,共接种4瓶作为阳性对照组。
1.4.5 用小鼠检测狂犬病病毒 取1.4.4项地鼠肾细胞传2代培养物(伪狂犬病病毒检验阴性),每批脑内注射5~7日龄乳鼠5只,每只0.03 mL。观察7~10 d,乳鼠不发病,并于第7 d剖杀其中2只,取鼠脑组织制成10%悬液脑内接种5~7日龄乳鼠5只,如此盲传3代,最后一代观察14 d,每代乳鼠健活为合格。
1.5 免疫原性检测
1.5.1 小鼠免疫原性试验 将三批猪乙型脑炎基础种子冻干毒,用PBS液作10倍系列稀释,选取10-3~10-5三个稀释度,分别皮下注射 10 ~12 g小鼠5只,0.1 mL/只,14 d后分别以乙脑强毒P3株腹腔攻击,每只0.3 mL(含≥500个LD50),同时每只小鼠脑内接种稀释液0.03 mL,观察14日判定结果。对照小鼠死亡率应≥80%,按Reed-Muench法计算半数保护剂量。
1.5.2 后备母猪的免疫原性试验 将猪乙型脑炎基础种子F7代冻干毒稀释至104~107TCID50免疫剂量,分别肌肉注射4头健康敏感后备母猪。免疫4周后采血分离血清,分别采用反向血凝抑制试验和蚀斑减少中和试验测定抗体效价。后备母猪免疫4周后配种,配种40 d后,各肌肉注射乙脑强毒P3株105.8LD50(小鼠腹腔攻击测定 LD50)。攻毒后72 h采血,接种原代地鼠肾细胞培养检查病毒血症。攻毒14 d后,每组剖杀两头,观察胎儿成活情况,并取胎儿脑及脾制成10%悬液接种原代地鼠肾细胞分离病毒[3]。
1.6 毒力稳定性检测 将猪乙型脑炎原始种子(F4代)冻干毒在原代地鼠肾单层细胞培养传代,连续传代至 F12代。分别选取F5代、F8代、F10代、F12代病毒培养液进行小鼠脑内致病力试验,小鼠皮下感染入脑试验,乳鼠传代返祖试验,测定该毒株在原代地鼠肾细胞培养传代过程的毒力变化[4]。并选取上述相同代次病毒培养液经仔猪皮下回传1代、分离病毒测定其猪体传代毒力变化。同时选取F5代、F8代、F10代、F12代病毒液进行小鼠免疫原性试验,测定该毒株在原代地鼠肾细胞培养传代过程的免疫原性变化[5]。
1.7 安全性检测
1.7.1 参照《中华人民共和国兽药典》二○一○年版三部[6]“猪乙型脑炎活疫苗”进行小鼠脑内致病力试验、皮下感染入脑试验、毒性试验和乳猪安全性检验。
1.7.2 大剂量接种初怀母猪的安全性试验 将三批猪乙型脑炎基础种子冻干毒种,每批接种怀孕30日健康易感初孕母猪4头,每头肌肉注射2 mL(含10头份),观察一个月。每日观察体温、精神、饮食情况,特别注意怀孕状况。统计分娩情况,并对死亡仔猪取脑组织悬液,分别接种原代地鼠肾细胞,36~37℃培养7 d,观察病变。
2 结果
2.1 外源病毒检测结果
2.1.1 用牛睾丸细胞检查外源病毒BVDV/MD,PK15细胞检查外源病毒HCV和PPV,三价荧光抗体染色后,被检细胞片无特异性荧光,表明三批基础种子无BVDV/MD、HCV和PPV污染。将三批基础种子分别与乙型脑炎特异性抗血清中和后,每批接种3瓶Vero细胞,连传2代,每代7 d,用显微镜观察细胞,均未出现细胞病变。同时作红细胞吸附试验,经4℃和20~25℃两种温度吸附,镜检结果为阴性,表明三批基础种子无能吸附红细胞的外源病毒污染。
2.1.2 用地鼠肾细胞检测伪狂犬病病毒,中和组细胞未出现病变,对照组细胞在接种后48 h出现明显的细胞病变,表明三批基础种子无伪狂犬病病毒污染。
2.1.3 用小鼠检测狂犬病病毒,乳鼠取脑盲传三代后,小鼠未出现肌肉震颤、步样失调和麻痹死亡等狂犬病症状,剩余小鼠全部健活,表明三批基础种子无狂犬病病毒污染。
2.2 免疫原性检测结果
2.2.1 小鼠免疫原性试验 三批基础种子用小鼠测定半数保护剂量分别为103.23、103.27、103.20TCID50,表明三批基础种子对小鼠免疫原性稳定。
2.2.2 后备母猪的免疫原性试验 猪乙型脑炎基础种子F7代冻干毒以105.0TCID50的免疫剂量即可使后备母猪全部抗体阳转(表1)。
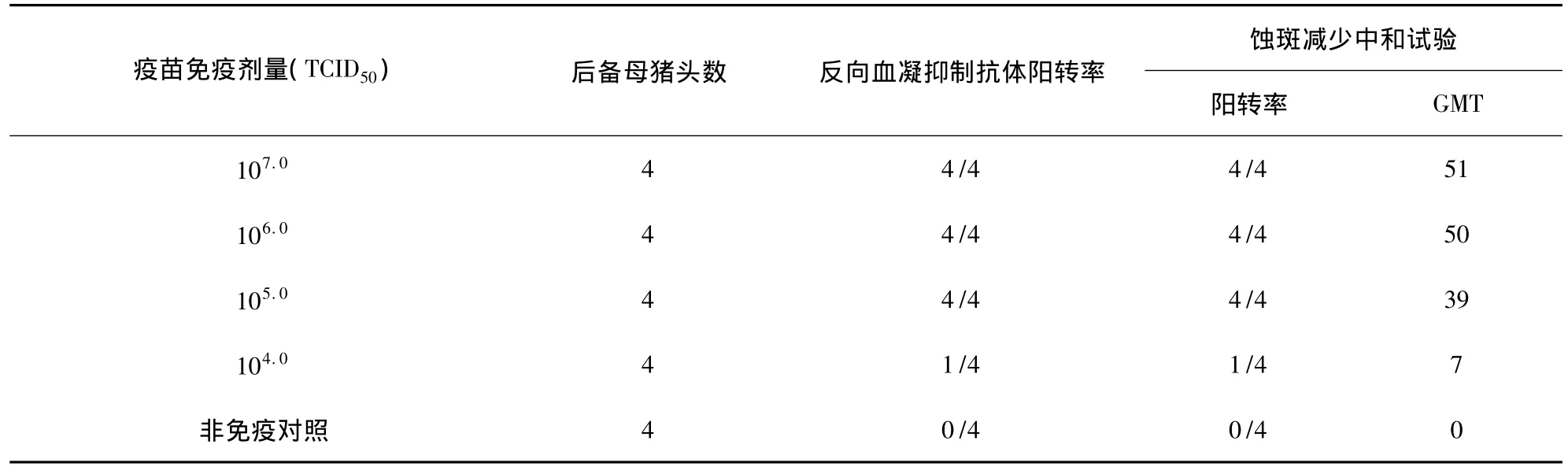
表1 不同剂量疫苗免疫猪抗体检测试验
以105.0TCID50病毒剂量免疫后备母猪,4周后中和抗体达到1∶37,可使母猪获得坚强的免疫力,攻毒后72 h病毒血症检验阴性,并保护胎儿不受病毒感染(表2)。
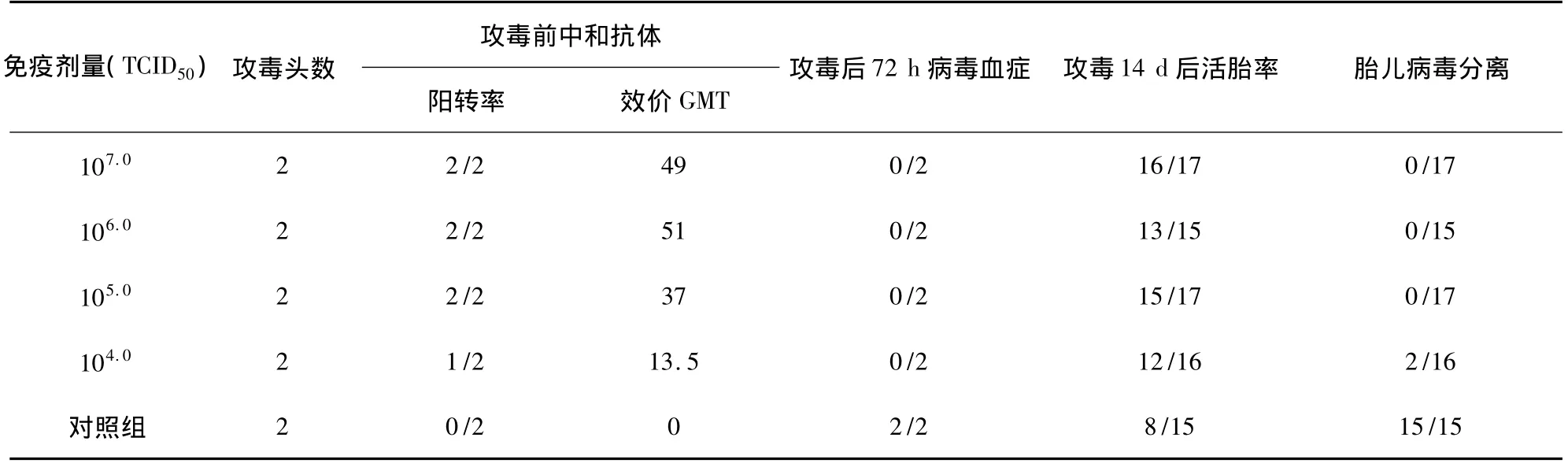
表2 后备母猪的免疫原性试验
2.3 毒力稳定性检测结果
2.3.1 选取F5代、F8代、F10代、F12代病毒培养液分别进行小鼠脑内致病力试验、皮下感染入脑试验和乳鼠传代返祖试验,小白鼠全部健活。表明各代次病毒培养液小鼠脑内致病力为零,皮下感染入脑致病力为零,毒力保持稳定不变,无返祖现象[7]。
2.3.2 选取F5代、F8代、F10代、F12代病毒液分别接种4~8日龄健康易感仔猪,每头皮下注射2.5 mL。接种72 h后剖杀,取血液和脾脏制成悬液接种原代地鼠肾细胞培养。将分离的病毒进行小鼠脑内致病力和皮下感染入脑试验测其致病力,结果各代次病毒液经仔猪皮下传1代,分离的病毒均与原毒株对小鼠致病力一致,毒力保持稳定不变。
2.3.3 选取 SA14-14-2疫苗株 F5代、F8代、F10代、F12代病毒培养液,测定小鼠半数保护剂量,依次为 103.43、103.35、103.05、103.28TCID50,结果表明不同代次病毒免疫原性保持稳定。
2.4 安全性检测结果
2.4.1 三批猪乙型脑炎基础种子分别进行小鼠脑内致病力试验、小鼠皮下感染入脑试验、小鼠毒性试验和乳猪安全性检验,结果均合格。
2.4.2 将三批猪乙型脑炎基础种子分别接种乙脑抗体阴性怀孕30 d初孕母猪,均未见疫苗接种引起的异常反应,怀孕期间无一例流产,死亡仔猪病毒分离为阴性,结果表明猪乙型脑炎基础种子大剂量接种初怀母猪安全(表3)。
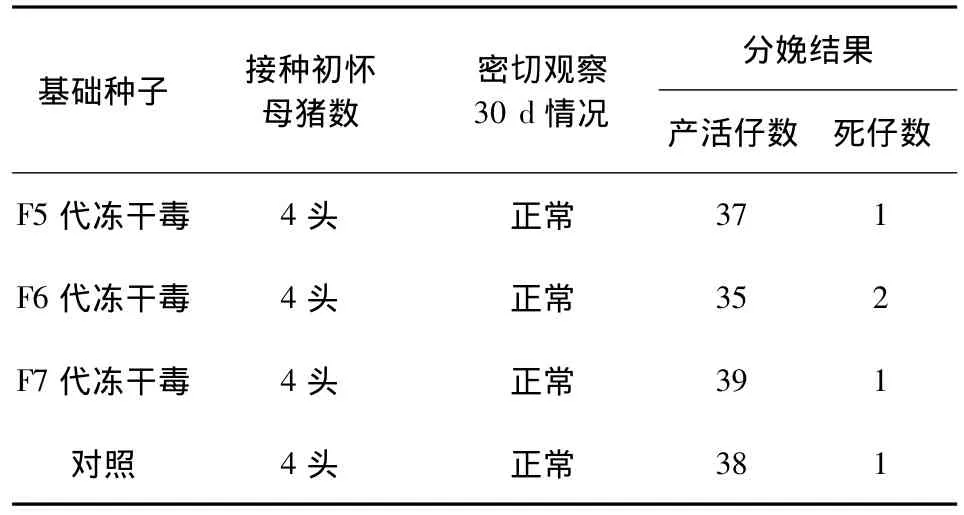
表3 大剂量接种初怀母猪的安全性试验结果
3 讨论与小结
猪乙型脑炎是由嗜神经性很强的乙脑病毒引起的临床上神经症状严重的一种传染病,因此研制活疫苗时首先要充分考虑疫苗株的安全性问题[3,8]。本文充分应用 SPF 级小鼠、初孕母猪、乳猪这三种敏感动物,通过小鼠脑内致病力、皮下感染入脑、大剂量接种初孕母猪和乳猪等试验对三批基础种子进行安全性验证,结果表明三批基础种子均对实验动物无致病力,安全可靠。对SA14-14-2疫苗株F5代、F8代、F10代、F12代病毒培养液进行乳鼠传代返祖和仔猪皮下传代返祖等毒力稳定性试验,结果表明疫苗毒株在传代过程中毒力保持稳定,无返强现象,神经毒力回复的可能性相当低。
基础种子以105.0TCID50剂量免疫后备母猪可使母猪获得坚强的免疫力,耐受强毒攻击,对胎儿进行乙脑病毒分离为阴性,充分证实母猪免疫后所产生的高水平特异性抗体阻止了胎盘感染。猪乙型脑炎病毒SA14-14-2疫苗株在原代地鼠肾细胞传代至F12代,各代次病毒毒力和免疫原性保持稳定,但通过原代地鼠肾细胞传代次数过多会影响疫苗免疫原性[9-10],因此,在保证将来疫苗生产需要的前提下,生产用种子的传代应控制在一定的范围之内,本研究将其限定在F10代以内。总而言之,猪乙型脑炎SA14-14-2疫苗株基础种子无外源病毒污染,具有可靠安全性和良好、稳定的免疫原性,可用于疫苗生产。
[1]俞永新.流行性乙型脑炎减毒活疫苗的发展和应用[J].上海预防医学杂志,2006,18(03):110-112.
[2]中华人民共和国农业部.中华人民共和国兽用生物制品规程二○○○年版[S].
[3]徐涤平,刘泽文,杨宜生,等.猪乙型脑炎减毒活疫苗的安全性和免疫原性试验[J].中国兽药杂志.2002,8:104-107.
[4]吴永林,刘杰,杨会强,等.乙型脑炎病毒减毒株SA14-14-2在乳鼠脑内连续传代后病毒基因的变化[J].中国生物制品学杂志.2007,1:19-21.
[5]李茂光,俞永新,刘欣玉,等.SA14-14-2株流行性乙型脑炎减毒活疫苗细胞免疫持久性研究[J].中国疫苗和免疫.2010(04):214-218.
[6]中国兽药典委员会.中华人民共和国兽药典二○一○年版三部[S].
[7]贾丽丽,俞永新,黄莺,等.流行性乙型脑炎减毒活疫苗生产毒种(SA14-14-2株)及其疫苗的表型和E基因稳定性研究[J].中国生物制品学杂志.2004,1:13-16.
[8]贾丽丽,俞永新,Theodere F.Tsai,等.流行性乙型脑炎减毒活疫苗对国内外不同野毒株的免疫性[J].中国生物制品学杂志.2000,13:208-210.
[9]贾丽丽,郑铮,郭玉鹏,等.流行性乙型脑炎减毒活疫苗生产毒株(SA14-14-2)的稳定性研究[J].中国生物制品学杂志.1992,4:174-176.
[10]许乐燕,徐闻青,徐帆洪,等.乙型脑炎病毒SA14-14-2减毒疫苗株的生物学和基因稳定性[J].中国生物制品学杂志.2008,21(10):833-837.

