RP-HPLC测定注射液中甲硫酸新斯的明含量
苏 亮,廖晓兵,何义刚,胡宇莉*
(1.重庆市兽药饲料检测所,重庆400120;2.waters科技(上海)有限公司,上海201206)
甲硫酸新斯的明是抗胆碱酯酶药之一,通过抑制胆碱酯酶活性而发挥完全拟胆碱作用,还直接激动骨骼肌终板上烟碱样受体[1]。甲硫酸新斯的明注射液在兽医临床上的应用较为广泛。首先,它抑制胆碱酯酶的活性而出现拟胆碱样作用,兴奋胃肠平滑肌,可增强胃肠蠕动,促进食欲和反当;其次,它对生殖系统的选择性兴奋作用较强,能兴奋子宫平滑肌,促进其中内容物的排出,故常用于母畜的子宫内膜炎、孕畜分娩困难、胎衣不下和和产后尿潴留等[2];另外,甲硫酸新斯的明安全、副作用小,且来源广,价格较便宜。因此,它在兽医临床上有较好的实用价值。《中华人民共和国兽药典》二○一○年版一部采用氮测定法测定甲硫酸新斯的明注射液的含量,该方法过程繁琐,在实际检测中较为耗时,且容易产生误差。本试验建立了准确、简洁的RP-HPLC法对注射液中甲硫酸新斯的明含量进行测定。
1 仪器与试药
e2695-2489高效液相色谱仪(美国waters公司);empower2.0色谱工作站(美国waters公司);甲硫酸新斯的明对照品(中国食品药品检定所,批号:100550-200401,含量:100.0%);甲硫酸新斯的明注射液样品(批号:20130701,哈尔滨三马兽药业有限公司;批号:130801,重庆泰通动物药业有限公司;批号:20131001,四川恒通动物制药有限公司);甲醇为色谱纯,磷酸和三乙胺为分析纯,试验用水为milli-Q纯水机自制超纯水。
2 方法与结果
2.1 对照品储备液和对照品溶液的制备 取甲硫酸新斯的明对照品约20 mg,精密称定,置10 mL容量瓶中,加水溶解并稀释至刻度,摇匀,得到浓度为2 mg/mL的对照品储备液,置4℃保存。精密量取对照品储备液1 mL,置50 mL容量瓶中,加水溶解并稀释至刻度,摇匀,得到浓度为40 μg/mL的对照品溶液。
2.2 波长选择 取甲硫酸新斯的明对照品溶液在200~400 nm波长范围内进行光谱扫描,得出260 nm为甲硫酸新斯的明的最大吸收波长。所以,选择260 nm作为该方法的测定波长。结果见图1。

图1 甲硫酸新斯的明的紫外光谱图

图2 空白(含辅料)溶液(A)、甲硫酸新斯的明对照品溶液(B)、甲硫酸新斯的明注射液样品(C)HPLC图
2.3 色谱条件 色谱柱:Thermo hypersil Gold-C18柱(美国 Thermo Fisher公司,4.6×150 mm,5 μm);流动相:0.1%磷酸水溶液(用三乙胺调pH至3.0)-甲醇(90∶10);流速1 mL/min;检测波长260 nm;柱温25 ℃;进样量 10 μL。
2.4 系统适用性和专属性试验 取空白辅料溶液、甲硫酸新斯的明对照品和样品溶液按2.3项条件测定,甲硫酸新斯的明对照品和样品溶液色谱峰的保留时间为7.48 min,理论塔板数不低于3000,拖尾因子小于1.02,空白辅料对测定无干扰,且相邻位置无其他干扰峰。结果表明,方法的系统适应性和专属性满足检测要求。结果见图2。
2.5 线性关系考察 分别精密量取对照品储备液0.1、0.5、2、5 mL 置100 mL 容量瓶中,1、2.5 mL 置10 mL容量瓶中,加水溶解并稀释至刻度,摇匀,得到浓度分别为 2、10、40、100、200、500 μg/mL 的系列对照品溶液。按2.3项下条件测定,以甲硫酸新斯的明的浓度(μg/mL)为横坐标,峰面积为纵坐标进行回归分析,得回归方程和回归系数分别为:y=11041x+12912,R2=0.9999。结果表明,甲硫酸新斯的明在2~500 μg/mL范围内线性关系良好。
2.6 定量限和检出限考察 分别精密量取甲硫酸新斯的明注射液(规格1 mg/mL)样品适量,加水逐级稀释,摇匀,得到浓度分别为 1、2、3、4、5 ng/mL的样品溶液,按2.3项条件测定。以S/N=3、S/N=10分别作为甲硫酸新斯的明的检出限和定量限判定标准,结果表明,本方法的检出限和定量限为分别为1 ng/mL和2 ng/mL。
2.7 样品含量测定方法 精密量取甲硫酸新斯的明注射液2 mL(规格1 mg/mL),置50 mL容量瓶中,用水稀释至刻度,摇匀,得供试品溶液。取该溶液10 μL,注入液相色谱仪,记录色谱图;另取40 μg/mL的甲硫酸新斯的明对照品溶液,同法测定。按外标法以峰面积计算,即得。理论塔板数按甲硫酸新斯的明峰记应不低于3000。
2.8 精密度试验 取供试品溶液6份,按2.3项条件平行测定6次,得RSD=0.5%。结果见表1。表明本方法精密度符合要求。
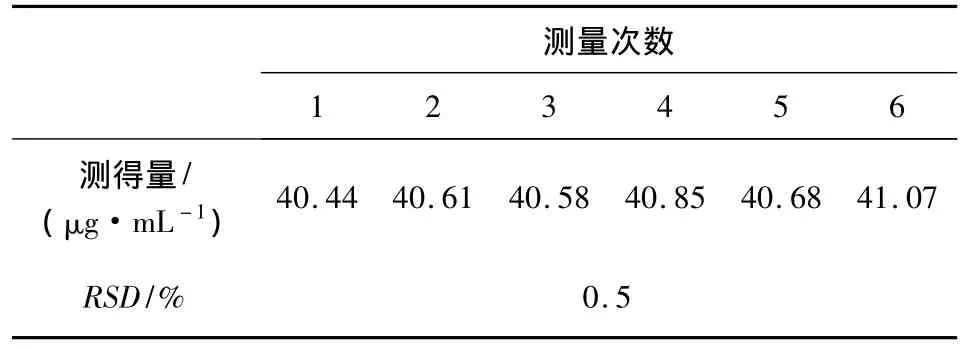
表1 甲硫酸新斯的明的精密度试验结果 n=6
2.9 准确度试验 取适量的甲硫酸新斯的明对照品9份,精密称定(称样量分别为8.01 mg、8.01 mg、8.02 mg、10.01 mg、10.01 mg、10.01 mg、12.01 mg、12.01 mg、12.03 mg),置 10 mL 容量瓶中。每3份一组,分别加入空白辅料溶液,稀释至刻度并摇匀,得到相当于注射液标示量的80%、100%、120%的样品溶液。按2.3项条件测定,计算回收率,结果见表2。结果显示,高中低浓度供试品溶液的平均回收率范围为100.2% ~100.8%,RSD范围为0.7% ~1.2%,表明本方法准确度符合要求。
2.10 稳定性试验 取同一供试品溶液,分别在0、3、6、10、12、24 h 迸样,按 2.3 项下条件测定其峰面积,计算峰面积的RSD值,RSD=2.46%,结果表明供试品溶液在24 h内稳定。
2.11 样品测定 分别精密量取甲硫酸新斯的明注射液2 mL,按2.7项方法操作,并按2.3项条件测定其含量。结果见表3。

表2 甲硫酸新斯的明的回收率结果

表3 样品含量测定结果n=2
3 讨论与小结
3.1 《中华人民共和国兽药典》二○一○年版一部采用氮测定法测定注射液中甲硫酸新斯的明的含量[3]。该方法有以下缺陷:到达滴定终点时,消耗滴定液的量仅为2~3 mL,滴定液消耗体积过小是结果误差产生的重要来源;要求配备专用仪器半微量氮测定仪;检测过程长,仅消化一项就需要耗时2~3 h,若没有可调温消解仪,则消化过程更长更繁琐;注射液的药物含量低,终点时指示剂变色不明显[4];另外,检测中使用到的检测试剂种类也比较多。高效液相色谱法用于兽药含量检测,具有较高的灵敏度和分离度,前处理过程也比较简单,检测周期较短。本试验所建立的方法中,样品仅用水稀释定容即可上机检测,且流动相易于配制。方法精密度RSD=0.5%,平均回收率范围为100.2% ~100.8%,检测定量限达到2 ng/mL,样品主峰无杂质干扰。
3.2 在以往报道的液相方法中,检测甲硫酸新斯的明的流动相中多含有磷酸二氢盐及庚烷磺酸钠[5-6]。前者容易在液相流路中析出,造成堵塞和仪器部件磨损;后者会对C18柱造成不可逆的损伤。本试验中采用磷酸和三乙胺配制流动相,得到了满意的色谱峰形和重现性,克服了前述不足。同时,由于甲硫酸新斯的明分子易与C18柱的硅醇基相互作用形成拖尾,所以,调节流动相pH至3,可以抑制硅醇基的影响,减轻拖尾现象产生。另外,本试验使用了长度为150 mm的色谱柱,将主成分的出峰时间控制在10 min之内。与传统的250 mm色谱柱相比,短柱更加节约人工、时间和试剂。使用短柱或者从其他角度(比如使用小粒径的柱子)来提高兽药检测的分析效率,这一点在工作量日益增大的兽药检测实验室中,显得异常重要。
本试验所建立的RP-HPLC,准确、稳定、易于操作,可用于甲硫酸新斯的明注射液的质量控制。
[1]佟 玲,谭晓杰,陈晓辉,等.RP-HPLC测定明锌素滴眼剂中甲硫酸新斯的明的含量[J].中国药学杂志,2005,40(15):1182-1183.
[2]郑四清.新斯的明在猪病临床中的应用[J].兽医导刊,2009,(148):43-50.
[3]中国兽药药典委员会.中华人民共和国兽药典二○一○年版一部[S].
[4]王 伟,孙为德.间接原子吸收光谱法测定甲基硫酸新斯的明[J].分析试验,2003,22(4):62-63.
[5]岳昌林,毛黎静,郭 忠.RP-HPLC测定注射用甲硫酸新斯的明含量的方法学研究[J].药物分析杂志,2005,25(10):1264-1265.
[6]唐琦文,江 峰,蒋国胜.高效液相色谱法测定复方新斯的明滴眼液中甲硫酸新斯的明的含量[J].中国药师,2006,9(10):942-943.

