老年患者感染黏液型铜绿假单胞菌的药敏结果分析
徐水清(湖北省咸宁市第一人民医院检验科 437000)
铜绿假单胞菌是呼吸道感染的重要病原菌之一,属于条件致病菌,普遍存在于空气、水、土壤等介质中,在正常人皮肤、呼吸道、肠道中有少量存在,对慢性、弥漫性和扩张性支气管炎的发病有重要影响[1]。老年患者感染黏液型铜绿假单胞菌有生物膜,能在黏膜表面形成大量多糖藻酸盐类黏液,这是持续定植、生物膜稳固的分子学结构特征[2]。黏膜表面使得黏液型铜绿假单胞菌对抗菌药物的抵抗能力和耐受性增强,增加了菌群检测的复杂性,加大了抗菌治疗的难度。因此对黏液型铜绿假单胞菌耐药性的检测,分析老年患者各种支气管疾病、肺病等疾病的病因,具有重要的诊断和治疗意义[3]。本研究通过分离老年支气管炎、慢性阻塞性肺病等患者的黏液型铜绿假单胞菌菌株,进行耐药检测和细菌灵敏性分析,对不同抗菌药物的抗黏液型和非黏液型铜绿假单胞菌的耐药灵敏度进行对比研究,分析黏液型铜绿假单胞菌的耐药能力和生物学机制。现将结果报道如下。
1 资料与方法
1.1 一般资料选择本院呼吸内科2011~2013年因支气管炎、慢性阻塞性肺病等住院的老年患者200例,其中男82例,女118例;年龄55~85岁,平均年龄(67.0±8.2)岁;患者经过临床检查确诊为黏液型铜绿假单胞菌感染。通过对尿、痰、脓、分泌物等检测和分离,对同一患者反复检测出的同一种菌株只记录一次结果。共获得66株黏液型铜绿假单胞菌。
1.2 方法
1.2.1 抗菌药物环丙沙星注射液购自浙江亚太药业股份有限公司。注射用头孢哌酮舒巴坦钠,粉针剂提取物等购自浙江亚太药业股份有限公司。注射用亚胺培南西司他丁钠,粉针剂提取物等购自美国梅里埃生物公司。头孢他啶、头孢哌酮都购自张家口圣大药业有限公司。阿米卡星、哌拉西林等均购自法国梅里埃生物制品有限公司。
1.2.2 仪器与试剂 HX-21细菌鉴定分析仪及相应试剂、药敏纸片等均购自合肥恒星科技开发有限公司;哥伦比亚血琼脂平板、麦康凯平板及Mueller-Hinton(MH)琼脂平板均购自郑州安图绿科生物工程有限公司。
1.3 菌株鉴定和检测
1.3.1 菌株鉴定按照《全国临床检验操作规程》[4]对标本菌株进行培养、分离、检测。在初代菌株培养中,环境温度为35℃,时间为18~24h,介质为血平板或麦康凯培养基,无色透明、水滴样、边缘光滑、无血凝菌落和结块。在48h长成菌株中,大而融合、触感黏稠成胶冻样菌落,溶血效果不显著,接种环不易分离,氧化酶检测部分显阴性,显微镜观察为革兰染色阴性杆菌,出现类荚膜样物质。黏液型和非黏液型铜绿假单胞菌的区别在于非黏液型铜绿假单胞菌具有金属光泽,带有特殊香味,在实验室反复传代后,能恢复显著的菌株特征,具备原始菌株生理学特征和生物学生命过程。而黏液型铜绿假单胞菌实验室培养结果与此相反。
1.3.2 菌株检测通过以下药敏实验流程图对所提取菌株进行实验和检测。见图1。

图1 药敏实验流程图
1.4 统计学处理采用SPSS17.0软件进行数据处理及统计学分析,计量资料采用表示,组间比较采用t检验;计数资料采用百分率表示,组间比较采用χ2检验。P<0.05为比较差异有统计学意义。
2 结果
2.1 黏液型铜绿假单胞菌传种前后对不同抗菌药物的抑菌环比较黏液型铜绿假单胞菌在传种前48、72h 不同抗菌药物中的抑菌环结果与传种后24、48、72h的检测结果比较,差异无统计学意义(P>0.05)。传种前24h的检测结果与48、72h以及传种后24、48、72h 结果比较,差异有统计学意义(P<0.05)。见表1。
2.2 黏液型铜绿假单胞菌传种前后对抗菌药物的耐药性比较传种前24h对6种抗菌药物的耐药性与48、72h时的耐药性比较,差异有统计学意义(P<0.05);其他时候不同抗菌药物对传种前后黏液型铜绿假单胞菌的耐菌检测效果比较,差异无统计学意义(P>0.05)。见表2。
表1 黏液型铜绿假单胞菌传种前后对不同抗菌药物抑菌环比较(,mm)
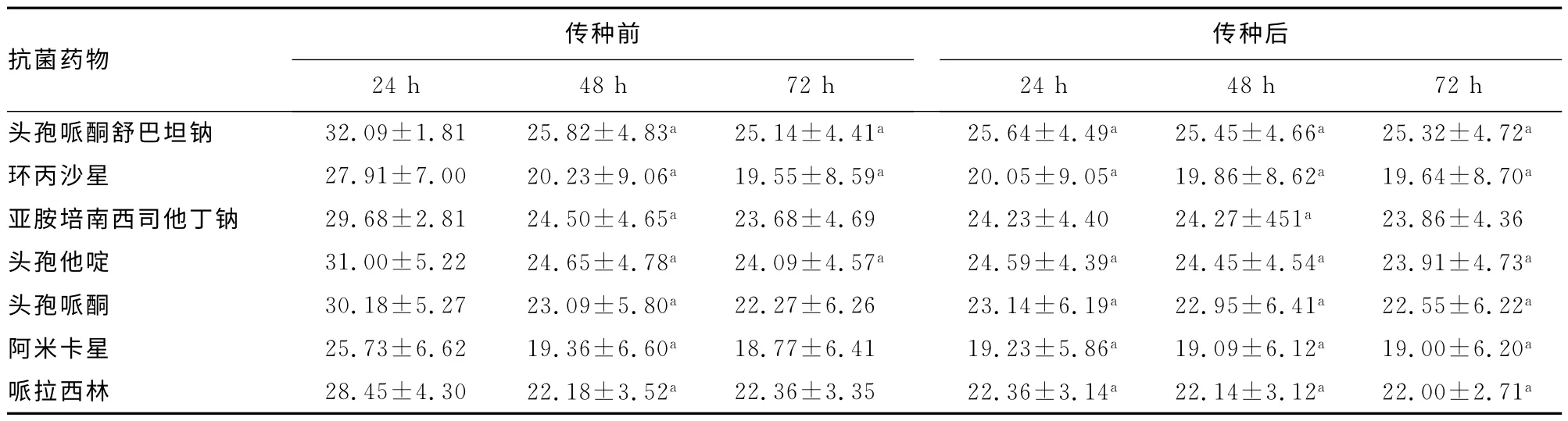
表1 黏液型铜绿假单胞菌传种前后对不同抗菌药物抑菌环比较(,mm)
注:与传种前24h时测量结果比较,aP<0.05。

表2 黏液型铜绿假单胞菌传种前后对抗菌药物的耐药性比较(%)
2.3 黏液型铜绿假单胞菌对抗菌药物敏感性分析黏液型铜绿假单胞菌对β-内酰胺类抗菌药物、头孢类抗菌药物、头孢哌酮舒巴坦钠和哌拉西林敏感性较高,均在90%以上。见表3。

表3 黏液型铜绿假单胞菌对抗菌药物敏感性分析(%)
3 讨论
老年黏液型铜绿假单胞菌是慢性呼吸道感染主要病原菌,由于存在黏液阻滞细菌生长,使此菌株生长速度小于常规水平,因此在培养24h 后才能发现抑菌环直径大小有显著改变[5]。本研究结果显示,24h抑菌环直径大小和48h的检测结果比较,差异有统计学意义(P<0.05)。可见,48h时检测对菌群鉴别的准确性有重要意义。因此,在老年感染黏液型铜绿假单胞菌的药敏检测中,应将检测报告控制在48h,以保证菌群检出阳性率,为临床诊断和疾病治疗提供准确依据[6]。
本研究结果显示,传种前菌株对不同抗菌药物在24h的抑菌环直径结果比较,差异无统计学意义(P>0.05),而24h与48、72h的检测结果比较,差异却有统计学意义(P<0.05)。说明24h内药敏检测结果存在漏洞,对24~48h内的菌群变化容易产生错误判断[7]。细菌在抗菌药物抑制环境中为求生存,产生黏附于组织或其他物质表面的分泌多糖(藻酸盐、纤维蛋白、多糖等),使细菌相互粘连形成菌膜,因此出现耐药灵敏度不同的现象。为此,通过进一步对传种n代后不同时间点的MIC进行检测,结果与传种前的48、72h检测结果相似,这可能从一定程度上解释了敏感抗菌药物的耐药性检测报告失准性和抗菌药物抗菌效果不佳的问题。因此,将药敏检测报告控制在48h,对患者机体菌群水平耐药性判断和抗菌药物临床用药依据具有衡量评价意义。
通过研究可知,黏液型铜绿假单胞菌在48h后达到与消除黏液型铜绿假单胞菌24、48、72h检测效果相同的程度,说明黏液的存在对菌株的耐抗菌药物效应影响极大。这个结论可以在一定程度上指导抗菌药物的临床应用[8-9]。黏液型铜绿假单胞菌感染患者在老年感染患者中占有一半的比例,随着老年感染黏液型铜绿假单胞菌程度的加深,抗菌药物的选择性更加重要,对不同抗菌药物的使用应该持续在48h 内治疗,而48~72h及之后抗菌药物对细菌敏感性无明显增加,耐药性反而出现加重。因此,抗菌药物在48h内的治疗对黏液型铜绿假单胞菌具有重要意义。临床医生应该加强对黏液型铜绿假单胞菌的特点和不同抗菌药物灵敏性的认识,在用药和治疗时遵循抗菌药物合理应用的治疗标准。同时,对于实验室观察发现的黏液型铜绿假单胞菌要注意其时效性,不能耽误出具报告,给临床医生节省合理的治疗和用药时间,使细菌在最佳抗菌药物的峰浓度下用药,达到最佳抑菌效果。
本研究结果显示,铜绿假单胞菌的体外显效抗菌药物较多,总体抗菌药物灵敏性较强,细菌耐药性较弱。这是由于对菌株药敏实验的检测局限于浮游细菌层面,把细菌黏膜因素排除在外,忽略了黏膜因素(生物膜)对抗菌药物的抵抗作用,不能准确反应抗菌药物的耐药性。由此可见,普通铜绿假单胞菌感染采用头孢类、青霉素类、喹诺酮类等抗菌药物均能产生较好的杀菌效果。但是,对于老年黏液型铜绿假单胞菌的抗感染治疗,必须排除生物膜的影响才能产生较好的抗感染作用。临床经验证实,大环内酯类抗菌药物罗红霉素、阿奇霉素等以及第三代喹诺酮类抗菌药氟罗沙星对细菌生物膜的生长抑制作用比较明显,主要通过抵抗细菌多糖蛋白附合物的合成和抑制细菌生物膜DNA 旋转酶的活性产生抑菌效果。
综上所述,老年黏液型铜绿假单胞菌的细菌耐药性和抗菌药物灵敏性受菌株表面生物膜的影响,检测报告应该控制在48h之后,这对细菌菌群检测和抗菌药物耐药性的判定比较合理。
[1]马列停,杨多,王亚文,等.酶联免疫反转录检测生产ESBL大肠埃希菌感染及抗菌药物灵敏性和耐药性研究[J].中华临床检验医学杂志,2010,25(11):110-111.
[2]缪竞智,张秀珍,李焕娄,等.肺心病患者绿脓杆菌分型耐药质粒DNA 分子杂交的临床意义[J].中华结核和呼吸杂志,1995,12(6):357-359.
[3]王辉,陈敏俊,刘玲慧.1994~2010年中国重症监护病房非发酵糖型细菌耐药性和抗菌药物灵敏性变迁问题的研究分析[J].中华医学杂志,2011,182(15):1384-1390.
[4]湖北,王静,严群,等.噬菌体治疗实验性小鼠耐亚胺培南铜绿假单胞菌抗感染方面的耐药性和耐酶灵敏性研究分析[J].中华微生物学和医学免疫学杂志,2011,26(5):1438-1441.
[5]马聪,周厚祥,李海玲,等.黏液型和非黏液型铜绿假单胞菌耐药性及泛耐药性临床分析和诊断研究[J].中国感染控制学预防医学杂志,2010,18(24):274-276.
[6]潘博文,付文卓,王晓楠,等.用于大容量人员天然噬菌体抗体库的表达载体的都建和鉴定研究分析[J].首都医科大学学报面医学杂志,2010,33(15):1647-1652.
[7]孙静,余理智,邓林强,等.黏液型铜绿假单胞菌药敏试验不同阶段结果分析与研究[J].江西医学院医学检验学学报,2011,21(6):1440-1441.
[8]Miyashita N,Kubota Y,Nakajima M,et al.Chlamydia pneumoniae angexacerbations of asthma in adults[J].Ann Allergy Asthma Immunol,2010,80(12):1405-1409.
[9]Schmidt SM,Muller C.Bronchial chlamdia pneumoniae infection markers of allergic inflammation and lung function in children[J].Pediatr Allergy Immunol,2010,12(5):1257-1265.

