蝇蕈醇激动GABAC受体对青霉素致大鼠癫痫的影响
范彦英,廖玉芳,肖 奕,张艳欣,王明正
(山西医科大学基础医学院药理教研室,太原 030001;*通讯作者,E-mail:wang5695695@163.com)
癫痫是一组以大脑神经元同步异常兴奋放电引起发作性、短暂性与刻板性脑功能异常的综合征,为中枢神经系统(CNS)最常见的慢性脑部疾病之一。目前我国癫痫患者人数已经超过1 000万,且每年新发癫痫病人在40万左右。由于癫痫的发病机制仍未完全阐明,给癫痫的防治工作进展带来一定困难。
根据癫痫发作具有突发性,且能够自行缓解或自行终止发作这一规律可以认为,人类脑内存在“内源性抗癫痫系统”[1]。大量的研究表明,γ-氨基丁酸(γ-aminobutyric acid,GABA)是具有抗癫痫作用的内源性调节因子,其可作用于氯离子通道型的GABAA和 GABAC受体及代谢型的 GABAB受体[2,3]。已有的研究证实,在癫痫发作和自行终止过程中,GABAA和GABAB受体发挥了重要调节作用。如DeLorey等[4]发现GABAA受体β3亚基缺失的小鼠可出现异常脑电和癫痫发作,而人类家族性癫痫的发作也与GABAA受体亚基的变异有关[5]。另有研究表明,GABAB受体缺失的小鼠,可自发形成类似失神性癫痫患者的棘波,棘慢波[6],GABAB受体的表达或功能的异常可能促进大鼠原发性癫痫的形成[7]。GABAC受体虽与GABAA受体同属配体门控型氯离子通道,但与GABAA受体相比,GABAC受体对GABA具有更高的敏感性,也拥有更持久的开放时间,介导的内向氯离子电流缓慢而持久[8]。此外,其对GABAA受体的调节剂如巴比妥类,苯二氮类,GABAA受体的典型阻断剂荷包牡丹碱(bicuculline)以及GBABB受体激动剂巴氯芬等不敏感[9]。课题组前期的研究发现,在电刺激大鼠坐骨神经和青霉素(penicillin)协同诱发痫性放电模型中,GABAC受体的 ρ2亚基 mRNA 表达减少[10],但GABAC受体对于癫痫发作和终止的影响尚不明确。
为此,本实验采用青霉素诱发大鼠癫痫发作模型,以GABAA受体阻断剂荷包牡丹碱、GABAB受体阻断剂高牛磺酸(homotaurine)和GABAC受体激动剂蝇蕈醇(muscimol)为工具药,探讨GABAC受体在内源性抗癫痫机制中的作用。
1 材料与方法
1.1 实验动物和主要试剂
健康清洁级SD大鼠共144只,体重180-220 g,均由山西医科大学实验动物中心提供。所有实验动物均遵照国家实验动物饲养和使用指南,动物饲养在温度控制的环境(22-25℃)下,12 h明暗循环,自由饮食和饮水。荷包牡丹碱、高牛磺酸和蝇蕈醇均购于Sigma公司;青霉素购于华北制药股份有限公司;乌拉坦购于成都化学试剂厂;氯化钠注射液购于石家庄四药有限公司。
1.2 皮层定位注射青霉素诱发癫痫模型的建立
将大鼠以乌拉坦(1.25 g/kg)腹腔注射麻醉,固定于脑立体定位仪上,以前囟为零点,用牙科钻在前囟向后2 mm,右旁开2 mm处行颅骨钻孔,暴露出直径为0.2-0.3 cm的硬脑膜,放置银球悬浮记录电极。采用RM6240C型多道生物信号采集处理系统记录脑皮层电图(EcoG)。待动物清醒后(术后约4-5 h),在前囟向后1 mm,左旁开1 mm,颅骨下1 mm处注射青霉素200 U,出现痫性发作并记录到典型的棘波、尖波、棘慢波等痫性波,则模型建立成功。
1.3 动物分组及给药
将144只大鼠随机分为4组,每组36只。正常对照组:皮层注射生理盐水2μl,30 min后腹腔注射生理盐水2 ml,10 min后腹腔注射生理盐水1 ml;癫痫模型组:皮层注射青霉素200 U,30 min后腹腔注射生理盐水2 ml,10 min后腹腔注射生理盐水1 ml;荷包牡丹碱+高牛磺酸处理组:皮层注射青霉素200 U,30 min后腹腔注射GABAA受体阻断剂荷包牡丹碱7.5 mg/kg和GABAB受体阻断剂高牛磺酸25 mg/kg,10 min后腹腔注射生理盐水1 ml;荷包牡丹碱+高牛磺酸+蝇蕈醇处理组:皮层注射青霉素200 U,30 min后腹腔注射荷包牡丹碱7.5 mg/kg和高牛磺酸25 mg/kg,10 min 后腹腔注射蝇蕈醇 1.0 mg/kg。
1.4 观察指标
行为指标:参照Racine痫性行为分级标准[11],0级:无反应或抽搐停止;Ⅰ级:节律性嘴或面部抽动;Ⅱ级:点头或甩尾;Ⅲ级:单肢抽动;Ⅳ级:多肢抽动或强直;Ⅴ级:全面性强直-阵挛发作。以出现Ⅰ-Ⅲ级为部分性发作,Ⅳ-Ⅴ级为全面性发作。癫痫发作持续时间:以注射青霉素后出现痫样放电到痫样放电消失所需的时间为癫痫发作持续时间,各组随机抽取6只大鼠记录癫痫发作持续时间。
脑电指标:EcoG记录参数如下:采集频率1 000 Hz;扫描速度800 ms/div;灵敏度,1 mV;时间常数,0.4 s;滤波频率10 Hz;低通滤波15 Hz。记录各组大鼠ECoG痫样放电,以各组大鼠发作高峰时段的脑电计算痫样波频率、振幅的平均值作为该大鼠痫样放电指标,以注射青霉素后出现痫样放电到痫样放电消失所需的时间为癫痫样放电持续时间,各组随机抽取6只大鼠脑电作统计学分析。
1.5 统计学分析
2 结果
2.1 激动GABAC受体对痫性行为和发作持续时间的影响
表1显示,癫痫模型组36只大鼠在注入青霉素后均出现Ⅰ-Ⅲ级发作。给予GABAA受体阻断剂荷包牡丹碱和GABAB受体阻断剂高牛磺酸后能明显延长大鼠癫痫发作的持续时间,36只动物中有约88.9%的动物发作级别增加,出现Ⅳ-Ⅴ级发作,与癫痫模型组比较,有统计学差异(P<0.05);与荷包牡丹碱+高牛磺酸处理组比较,给予蝇蕈醇激动GABAC受体能显著缩短大鼠癫痫发作的持续时间,降低发作级别,仅有19%的动物出现Ⅳ-Ⅴ级发作(P<0.05)。
表1 蝇蕈醇、荷包牡丹碱和高牛磺酸对青霉素诱发大鼠癫痫发作持续时间及行为的影响(±s)Table 1 Effects of muscimol,bicuculline and homotaurine on the duration and behavior of penicillin-induced seizures in rats(±s)
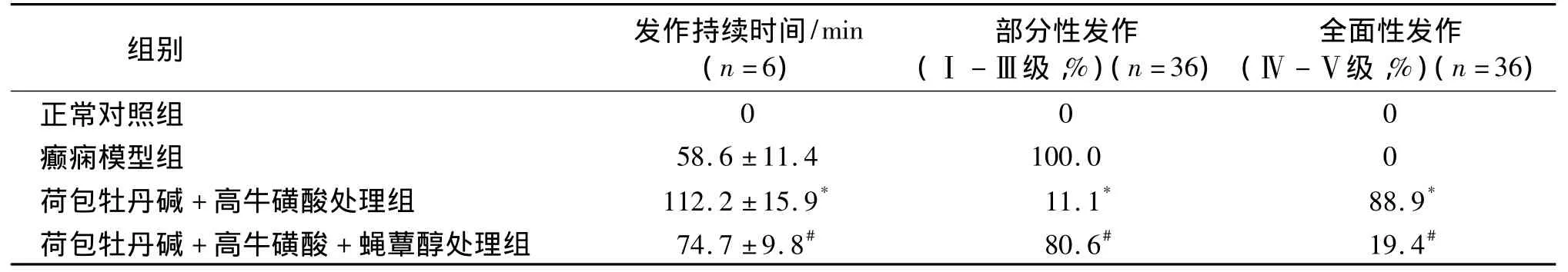
表1 蝇蕈醇、荷包牡丹碱和高牛磺酸对青霉素诱发大鼠癫痫发作持续时间及行为的影响(±s)Table 1 Effects of muscimol,bicuculline and homotaurine on the duration and behavior of penicillin-induced seizures in rats(±s)
与癫痫模型组比较,*P<0.05;与荷包牡丹碱+高牛磺酸处理组比较,#P<0.05;n1=6,n2=36
?
2.2 激动GABAC受体对EcoG痫样放电持续时间、痫波频率及最高振幅的影响
图1和表2结果显示,癫痫模型组在给予青霉素后,2-5 min内开始记录到棘波、尖波、棘慢波等痫样波,放电持续时间为(72.8±6.3)min,发作高峰期痫样波频率为(43.4±5.5)/min,振幅为(3.0±0.6)mV。给予 GABAA受体阻断剂荷包牡丹碱和GABAB受体阻断剂高牛磺酸后放电持续时间、痫样波频率及振幅均显著增高(P<0.05)。给予蝇蕈醇激动GABAC受体可显著抑制GABAA和GABAB受体阻断剂引起的放电持续时间延长(P<0.05),并降低相同时间内的痫样波频率和振幅,分别与癫痫模型组及荷包牡丹碱+高牛磺酸处理组相比,均有显著性差异(P<0.05)。
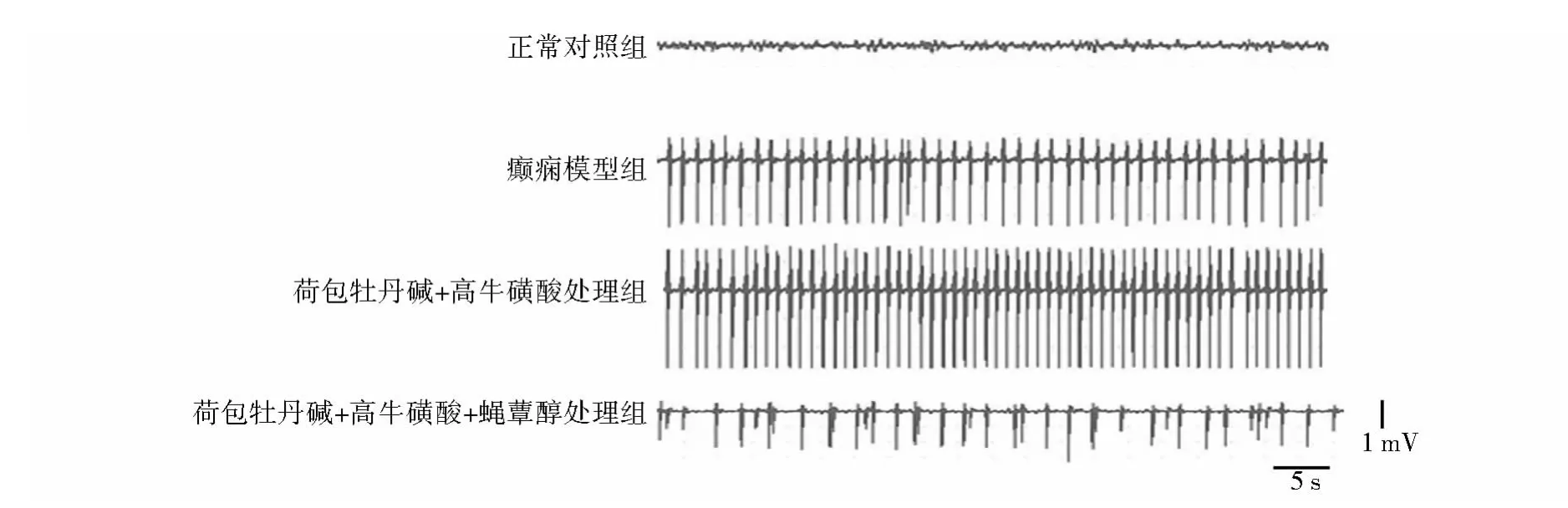
图1 蝇蕈醇、荷包牡丹碱和高牛磺酸对青霉素诱发的大鼠痫样放电的代表性EcoGFigure 1 Representative EcoGrecordings for the effects of muscimol,bicuculline and homotaurine on penicillin-induced epileptic discharges in rats
表2 蝇蕈醇、荷包牡丹碱和高牛磺酸对青霉素诱发的大鼠痫样放电的持续时间、痫波频率及振幅的影响(±s,n=6)Table 2 Effect of muscimol,bicuculline and homotaurine on duration,frequency and amplitude of penicillin-induced epileptic discharges in rats(±s,n=6)

表2 蝇蕈醇、荷包牡丹碱和高牛磺酸对青霉素诱发的大鼠痫样放电的持续时间、痫波频率及振幅的影响(±s,n=6)Table 2 Effect of muscimol,bicuculline and homotaurine on duration,frequency and amplitude of penicillin-induced epileptic discharges in rats(±s,n=6)
与癫痫模型组比较,*P<0.05;与荷包牡丹碱+高牛磺酸处理组比较,#P<0.05
?
3 讨论
青霉素是经典的致痫剂,其通过拮抗GABAA受体,引起抑制性突触活动减弱或兴奋性突触活动增强,从而导致神经元兴奋性增高[10,12]。本实验中,通过在大鼠大脑皮层一侧运动区注射青霉素,成功制备了简单部分性发作模型,表现为点头、甩尾、单肢抽动(Ⅰ-Ⅲ级),EcoG出现明显的痫性放电,特征为频发的棘波和棘慢综合波。
研究表明,GABAA受体位于中枢突触后膜,GABA结合该受体打开氯离子通道产生抑制性突触后电位进而抑制神经元放电,其介导了CNS大多数的快速抑制效应,而GABAB受体则通过与G蛋白偶联介导了慢的抑制效应,二者均参与了内源性的抗癫痫机制[13]。本实验在大鼠运动皮层定位注射青霉素诱发癫痫发作模型中发现,利用荷包牡丹碱和高牛磺酸阻断GABAA和GABAB受体可使青霉素诱发痫性活动进一步增强,大部分大鼠出现阵挛发作,发作程度加重至Ⅳ-Ⅴ级,同时棘波频率增快、振幅增大、发作持续时间延长了近1倍。这一结果表明,阻断GABAA和GABAB受体使得 CNS失去了由GABAA和GABAB受体介导的大多数抑制效应。由于GABAC受体对前面两种阻断剂不敏感[9],由它所介导的抑制作用并不受影响。
研究发现,GABAC受体介导的抑制作用可发生在突触间隙低浓度的GABA作用下,而GABAA受体的激活需要高浓度的 GABA刺激,同时,与GABAA受体快激活快失活的特性不同,GABAC受体介导的抑制作用持续时程较长,且不表现明显的脱敏作用[8]。因此,当突触间隙GABA的浓度降低到一定值时,GABAA受体已无法承担所应维持的抑制强度,此时,GABAC受体介导的抑制作用便显得必不可少。这些特殊的生理特性也意味着它所介导的抑制作用在CNS功能的调节中起着重要的作用[14],但它具体是否参与调节癫痫的发作和终止尚不明确。在内源性抗癫痫机制研究中蝇蕈醇已被广泛的作为工具用药使用。传统上认为蝇蕈醇为GABAA受体的选择性激动剂,但在GABA受体蛋白的研究中发现,蝇蕈碱同样具有激活GABAC受体的活性[15]。GABAC受体广泛分布于中枢神经系统,因此,蝇蕈醇激动GABAC受体可改变大脑皮质,海马和小脑等多个脑区的神经活动。本实验在阻滞GABAA和GABAB受体的实验条件下,以蝇蕈醇作为工具药激动GABAC受体后,不但能对抗青霉素和GABAA及GABAB受体阻断剂协同诱发的癫痫发作行为活动,同时可明显抑制异常脑电活动,表现在显著缩短发作持续时间、减少痫波发放频率、降低癫痫波波幅,这一结果提示,GABAC受体激活能有效抑制癫痫样放电,终止癫痫发作,是内源性的抗癫痫机制之一,而该受体的抗癫痫作用可能与其生理特性密不可分。我们推测,癫痫发作时,当GABAA和GABAB受体无法响应其速效抑制作用或无法承担所应维持的抑制强度时,GABAC受体即启动缓慢而持久的抑制效应,从而自行终止癫痫发作,机体的内源性抗癫痫系统中可能存在“双重保险”机制。
综上所述,本研究首次证实了GABAC受体的激活是内源性的抗癫痫机制之一,这将为癫痫的治疗学和抗癫痫药物的药理学研究提供新的思路,但该受体所介导的具体抗癫痫机制还有待深入研究。
[1]Potschka H,Krupp E,Ebert U,etal.Kindling-induced overexpression of Homer 1A and its functional implications for epileptogenesis[J].Eur JNeurosci,2002,16(11):2157-2165.
[2]Johnston GA.GABACreceptors:relatively simple transmitter-gated ion channels[J].Trends Pharmacol Sci,1996,17(9):319-323.
[3]Sperk G,Furtinger S,Schwarzer C,etal.GABA and its receptors in epilepsy[J].Adv Exp Med Biol,2004,548:92-103.
[4]DeLorey TM,Handforth A,Anagnostaras SG,etal.Mice lacking the beta3 subunit of the GABAAreceptor have the epilepsy phenotype and many of the behavioral characteristics of Angelman syndrome[J].J Neurosci,1998,18(20):8505-8514.
[5]Macdonald RL.GABAAreceptor defects can cause epilepsy[J].Epilepsy Curr,2001,1(2):74.
[6]Gassmann M,Shaban H,Vigot R,etal.Redistribution of GABAB(1)protein and atypical GABABresponses in GABAB(2)-deficient mice[J].J Neurosci,2004,24(27):6086-6097.
[7]Merlo D,Mollinari C,Inaba Y,etal.Reduced GABABreceptor subunit expression and paired-pulse depression in a genetic model of absence seizures[J].Neurobiol Dis,2007,25(3):631-641.
[8]Chen Y,Zhou D,Zhou K,etal.Study on olfactory function in GABACreceptor/channel rho1 subunit knockout mice[J].Neurosci Lett,2007,427(1):10-15.
[9]Liu B,Hattori N,Jiang B,etal.Single cell RT-PCR demonstrates differential expression of GABACreceptor rho subunits in rat hippocampal pyramidal and granule cells[J].Brain Res Mol Brain Res,2004,123(1-2):1-6.
[10]肖奕,古艳婷,王明正,等.胺甲氧斑蝥素对惊厥大鼠脑电和GABAC受体ρ2mRNA表达的影响[J].中国药学杂志,2011,4(46):270-274.
[11]Racine RJ,Steingart M,McIntyre DC.Development of kindling-prone and kindling-resistant rats:selective breeding and electrophysiological studies[J].Epilepsy Res,1999,35(3):183-195.
[12]Gutnick MJ,Prince DA.Thalamocortical relay neurons:antidromic invasion of spikes from a cortical epileptogenic focus[J].Science,1972,176(4033):424-426.
[13]Olsen RW,AvoliM.GABAand epileptogenesis[J].Epilepsia,1997,38(4):399-407.
[14]Johnston GA,Chebib M,Hanrahan JR,etal.Neurochemicals for the investigation of GABA(C)receptors[J].Neurochem Res,2010,35(12):1970-1977.
[15]Johnston GA,Chebib M,Hanrahan JR,etal.GABA(C)receptors as drug targets[J].Curr Drug Targets CNSNeurol Disord,2003,2(4):260-268.

