蓖麻粕中蓖麻碱的微波辅助提取工艺优化及其抑菌性*
许伟,柯增光,,颜秀花,邵 荣,云志
1(盐城工学院 化学与生物工程学院,江苏盐城,224051)2(南京工业大学化学化工学院,江苏南京,210009)
蓖麻为大戟科蓖麻属植物,是世界十大油料作物之一,在世界范围内广泛种植[1]。我国是世界第二大蓖麻生产国[2]。蓖麻籽经过压榨出油后得到的残渣即为蓖麻粕。蓖麻粕中含有丰富的蛋白和天然活性物质,其中的蓖麻碱[3]具有杀虫[4]、保肝[5]、镇痛[6,7]等作用;此外,蓖麻碱还具有中枢神经系统兴奋作用,低剂量时对记忆具有一定的改善效果,较大剂量时致惊厥,可作为工具药制备癫痫动物模型筛选抗惊厥药[8]。长期以来,蓖麻粕还只是作为肥料用于农田,效益低下[9]。蓖麻粕的有效开发利用对推动蓖麻产业发展、创造经济效益具有积极作用。本研究采用微波辅助法从蓖麻粕中提取蓖麻碱,通过响应面优化蓖麻碱提取工艺,并初步研究了蓖麻碱的抑菌性,以期为蓖麻碱的高效开发、拓宽利用途径提供一些基础科学数据。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichia coli)、淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)、金黄色葡萄球菌(Staphyloccus aureus),都由盐城工学院生物实验中心提供;蓖麻籽,购自河北省安国市华仁药材有限公司。
甲醇(分析纯)、无水乙醇(分析纯)、石油醚(分析纯),购自江苏彤晟化学试剂有限公司;无水乙醚(分析纯)、三氯甲烷(分析纯),购自南京化学试剂有限公司;乙腈(色谱纯),购自美国天地公司;蒸馏水,实验室自制。
1.2 仪器与设备
DK-80电热恒温水槽,上海精宏实验设备有限公司;RE-2000B旋转蒸发器,上海雅荣生化设备仪器有限公司;752紫外可见分光光度计,上海佑科仪器有限公司;XO-SM50超声波微波组合反应系统,南京先欧生物科技有限公司;P230Ⅱ高效液相色谱,大连依利特有限公司;AUY220电子天平,日本岛津公司。
1.3 实验方法
1.3.1 蓖麻粕制备
将蓖麻籽粉碎,加入V(乙醚)∶V(石油醚)=3∶1的混合溶剂,固液比为1∶3(g∶mL),机械搅拌1h,将固-液混合物进行分离,干燥后得到脱脂蓖麻粕。
1.3.2 蓖麻碱标准曲线的绘制
准确称取25 mg蓖麻碱纯品,甲醇溶解定容在25 mL 容量瓶中,准确吸取上述溶液 1、2、3、4、5、6 mL,分别定容在10 mL的容量瓶中,高效液相色谱法测峰面积。以蓖麻碱的质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.3.3 蓖麻粕中蓖麻碱含量测定
准确称取蓖麻粕20 g,按1∶10(g∶mL)的料液比加入蒸馏水,在微波功率400 W下提取5 min,过滤,滤液浓缩至膏状,转移至索氏抽提器中,加入三氯甲烷150 mL,在90℃下回流提取3 h,蒸出溶剂,甲醇充分溶解并定容至50 mL,经0.45 μm微孔滤膜过滤,用高效液相色谱分析,记录峰面积。将分离得到的蓖麻粕重复上述操作,直至峰面积小于500 mV·sec,将所有峰面积相加,带入标准曲线计算得到蓖麻碱的质量浓度c,然后根据下式计算蓖麻碱含量。

式中:y为蓖麻碱含量,%;c为依据标准曲线计算出的待测蓖麻碱质量浓度,mg/mL;V为提取液体积,mL;m为样品的质量,g。
1.3.4 蓖麻碱提取率计算

式中:η为蓖麻碱提取率,%;c为依据标准曲线计算出的待测蓖麻碱质量浓度,mg/mL;V为提取液体积,mL;m为样品的质量,g;y为蓖麻碱含量,%。
1.3.5 单因素实验
以蓖麻碱提取率作为考察指标,通过单因素实验分别研究微波功率(100,200,300,400,500,600 W)、液固比(2,4,6,8,10,12 mL/g)和提取时间(1,2,3,4,5,6 min)对蓖麻碱提取率的影响,初步确定适宜提取蓖麻碱的相应水平范围。每个处理3次平行实验,取平均值。
1.3.6 响应面实验
在单因素实验的基础上,根据Box-Behnken的中心组合实验设计原理,选取微波功率、液固比和提取时间3个因素,采用三因素三水平响应面分析的方法优化蓖麻碱提取工艺,实验因素和水平表设计见表1。每个处理平行实验3次,取平均值。所得实验数据采用Design Expert8.0软件进行分析。

表1 响应面实验因素水平表Table 1 Factors and levels of response surface experiment
1.3.5 蓖麻碱的抑菌性研究
1.3.5.1 菌种的活化及菌悬液的制备[10]
将3种供试菌分别接入到已灭菌的斜面上,于37℃恒温培养箱中培养24 h。分别挑取一环已活化好的菌种接种到装有50 mL LB液体培养基中,置于恒温培养摇床(160 r/min、37℃)中培养12 h,然后用无菌生理盐水将3种菌稀释至浓度约5×106~5×107CFU/mL的菌悬液。
1.3.5.2 抑菌性实验
蓖麻碱的抑菌性实验采用参考文献[11-12]中的方法并略作修改。取直径为6 mm的滤纸片于121℃、0.1 MPa下湿热灭菌20 min备用。将已灭菌的滤纸片分别放入浓度为10、5和2.5 mg/mL的蓖麻碱溶液中浸泡30 min。将每个培养皿内倒入15 mL已灭菌的固体培养基,待培养基凝固后,各取供试菌液0.2 mL分别涂布在固体培养基上,制成含菌平板,每种菌的平板贴3片浸过不同浓度的蓖麻碱溶液的滤纸片和1片浸过生理盐水的滤纸片,对称放置。置于37℃恒温培养箱中培养24 h,以十字交叉法测量抑菌圈直径,取平均值,比较蓖麻碱对各种菌的抑菌性。每种菌做3组平行实验。
2 结果与分析
2.1 蓖麻碱标准曲线的绘制
以蓖麻碱的质量浓度为横坐标、峰面积为纵坐标绘制标准曲线,其标准曲线回归方程为y=21 654.48x+666.08,相关系数R2为0.998,呈现良好的线性关系。
2.2 蓖麻碱含量测定
重复测定3次,蓖麻碱含量平均值为0.164 1%,相对标准偏差(RSD)为0.38%,实验结果重复性较好。
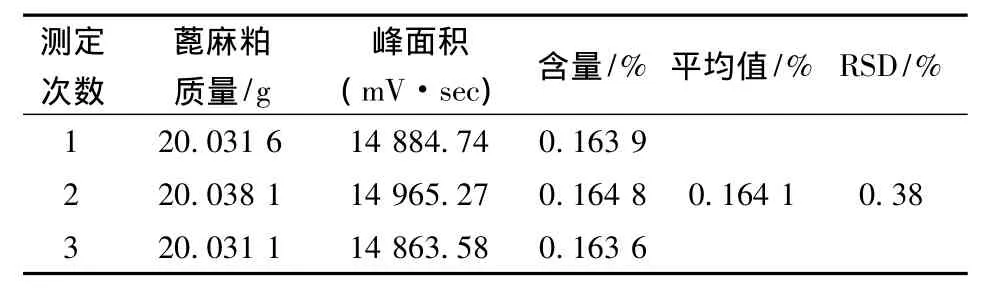
表2 蓖麻碱含量测定Table 2 Ricinine content determination
2.3 微波辅助提取蓖麻碱的单因素实验
2.3.1 微波功率对蓖麻碱提取率影响
微波功率对蓖麻碱提取率的影响见图1。

图1 微波功率对蓖麻碱提取率影响Fig.1 Effect of microwave power on the extraction rate of ricinine
由图1可以看出,当微波功率较小时,随着微波功率的增加,蓖麻碱的提取率上升,当微波功率达到400 W后,蓖麻碱的提取率开始下降。可能是随着微波功率增加,微波的热效应增强,提取液的温度升高,增加了固液扩散速度,提高了提取率;但是当功率过大,使升温速度过快,可能导致提取液爆沸,造成了提取液的损失,而且功率增加也会增加能耗[13]。因此最适的微波功率为400 W。
2.3.2 液固比对蓖麻碱提取率影响
液固比对蓖麻碱提取率的影响见图2。由图2可以看出,随着液固比的增加,蓖麻碱提取率逐渐上升,液固比超过10后,蓖麻碱提取率几乎不发生变化。可能是因为溶剂量增大后,浓度梯度变大,有利于蓖麻碱的溶出;液固比超过10后,再增加液固比,蓖麻碱的提取率也不再增加,表明提取已达到平衡[14]。因此最适的液固比为10。
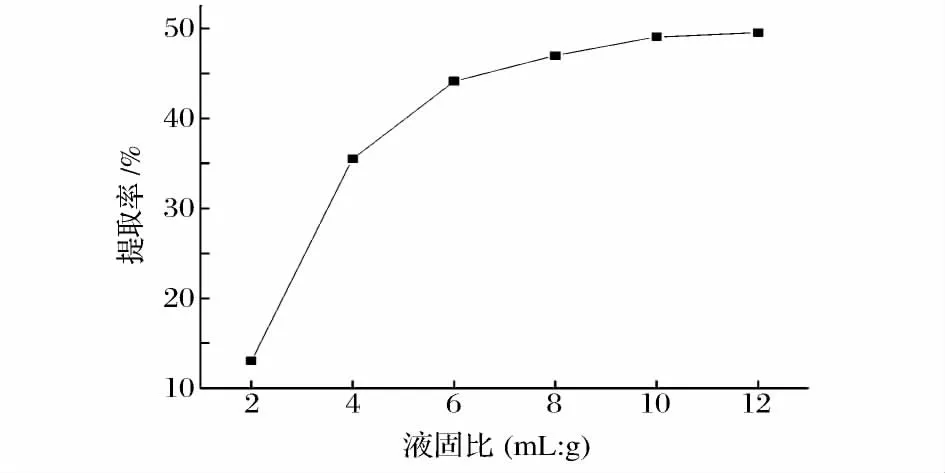
图2 液固比对蓖麻碱提取率影响Fig.2 Effect of material to solvent on the extraction rate of ricinine
2.3.3 提取时间对蓖麻碱提取率影响
提取时间对蓖麻碱提取率的影响见图3。由图3可以看出,随着微波提取时间的延长,蓖麻碱提取率逐渐提高,当提取时间达到5 min时,蓖麻碱的提取率达到最大值,再延长提取时间,蓖麻碱提取率开始下降。可能是随着提取时间的不断延长,环境温度不断上升,促进了溶质的浸出,当提取时间超过5 min时,环境温度过高,使溶剂沸腾,溶剂量减少,温度过高也可能导致蓖麻碱分解[15]。因此最适的提取时间为5 min。与传统提取方法[16](热水提取时间一般为3~4 h)相比,微波提取法显著缩短了蓖麻碱的提取时间。
2.4 响应面实验结果与分析
2.4.1 回归方程的建立与方差分析
响应面实验设计及结果见表3。运用 Design Expert8.0软件对表3中的17个实验数据进行回归分析,拟合后得到关于微波功率(W)、液固比(mL/g)和提取时间(min)的二次多项式回归模型为:
蓖麻碱提取率Y%=49.10+0.14 X1+2.53 X2-0.44 X3+0.66 X1X2-2.83 X1X3+1.29 X2X3-

图3 提取时间对蓖麻碱提取率影响Fig.3 Effect of extraction time on the extraction rate of ricinine

表3 响应面实验结果Table 3 Results of response surface experiment
该回归模型及模型系数显著性验证结果见表4。

表4 回归模型的方差分析Table 4 Variance analysis of regression model
由表4可知,该模型极其显著(P值<0.000 1),决定系数R2值为0.998 3,表明该模型蓖麻碱提取率的实验值和拟合值之间具有很好的拟合度。该模型的失拟项P值>0.10,表明二次模型是合适的。对模型系数显著性分析可知,因素X1对蓖麻碱提取率的影响不显著,X2、X3、X1X2、X1X3、X2X3、X12、X2和X2对蓖麻碱提取率的影响显著。因素的P值越小,对蓖麻碱提取率的影响越显著。一次项中各因素对蓖麻碱提取率的影响显著性大小顺序是液固比(X2)>提取时间(X3)>微波功率(X1)。
2.4.2 响应面实验中各因素交互作用影响
响应面优化蓖麻碱提取实验中液固比和微波功率对蓖麻碱提取率的交互作用影响见图4。从图4可以看出,提取时间处于最佳值时,蓖麻碱提取率随着微波功率的增大先升高后降低,随着液固比的增加先快速上升后缓慢上升达到稳定。

图4 微波功率和液固比对蓖麻碱提取率的响应曲面图Fig.4 Response surface of microwave power,solvent-to-material on the extraction rate of ricinine
响应面优化蓖麻碱提取实验中微波功率和提取时间对蓖麻碱提取率的交互作用影响见图5。
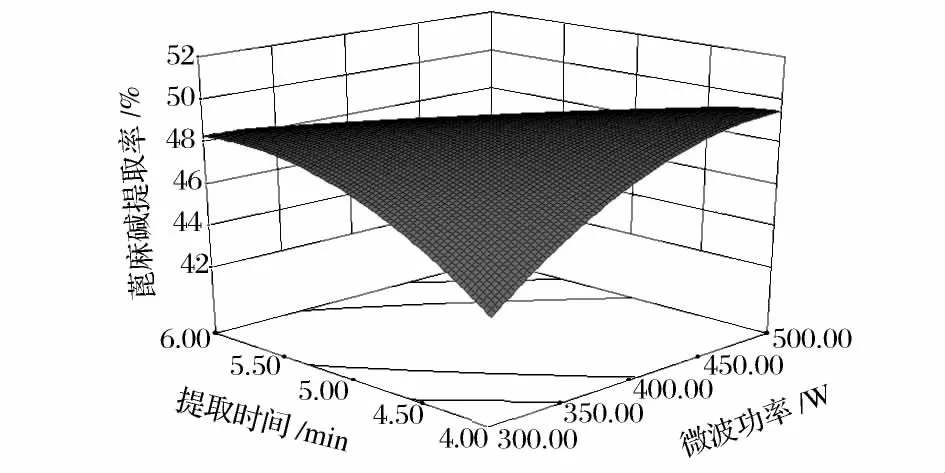
图5 微波功率和提取时间对蓖麻碱提取率的响应曲面图Fig.5 Response surface of microwave power,solvent-to-material extraction time on the extraction rate of ricinine
从图5可以看出,液固比处于最佳值时,蓖麻碱提取率随着微波功率的增大先升高后降低,随着提取时间的延长先升高后降低。
响应面优化蓖麻碱提取实验中液固比和提取时间对蓖麻碱提取率的交互作用影响见图6。从图6可以看出,微波功率处于最佳值时,蓖麻碱提取率随着提取时间的延长先升高后降低,随着液固比的增加先快速上升后缓慢上升达到稳定。

图6 提取时间和液固比对蓖麻碱提取率的响应曲面图Fig.6 Response surface of extraction time,solvent-to-material on the extraction rate of ricinine
2.4.3 回归模型验证
经过Box-Behnken设计得到微波提取蓖麻碱最优工艺条件为:微波功率408.01 W,提取时间5.21 min,液固比12(mL∶g)。在此工艺条件下蓖麻碱的提取率为50.74%。
考虑到实际操作的便利,将蓖麻碱的最优工艺条件修正为:微波功率408 W,提取时间5.2 min,液固比12(mL∶g)。在此条件下进行验证实验,得到蓖麻碱的提取率为50.81%,相对偏差为0.14%,证明该模型是适合有效的。
2.5 蓖麻碱抑菌性结果
蓖麻碱对各种菌的抑菌作用见图7。由图7可知,蓖麻碱对大肠杆菌、淀粉液化芽孢杆菌和金黄色葡萄球菌都具有抑制作用,且随着蓖麻碱的浓度增加而增强。蓖麻碱对各菌种的抑菌效果为:大肠杆菌>淀粉液化芽孢杆菌>金黄色葡萄球菌。

图7 蓖麻碱对各种菌种的抑菌作用Fig.7 Antibacterial activity of ricinine on different strains
3 结论
本实验以蓖麻粕为原料,以水为提取溶剂,采用微波辅助提取蓖麻碱,在单因素实验的基础上,通过响应面优化了蓖麻碱提取工艺,得到微波提取蓖麻碱的最佳工艺条件为:微波功率408.01 W,提取时间5.21 min,液固比12(mL∶g)。在此工艺条件下获得蓖麻碱提取率的理论值为50.74%,通过验证实验得到实际提取率为50.81%,相对偏差为0.14%,证明该模型是适合有效的。通过方差性分析可知各因素对蓖麻碱提取率的影响显著性大小顺序是液固比(X2)>提取时间(X3)>微波功率(X1)。采用微波辅助提取法具有比传统提取方法时间短的特点。采用滤纸片法测定蓖麻碱的抑菌性,结果表明蓖麻碱对大肠杆菌、淀粉液化芽孢杆菌和金黄色葡萄球菌都具有抑制作用,蓖麻碱对各菌种的抑菌效果为大肠杆菌>淀粉液化芽孢杆菌>金黄色葡萄球菌。
[1]Severino L S,Auld D L,Baldanzi M,et al.A review on the challenges for increased production of castor[J].Agronomy journal,2012,104(4):853 -880.
[2]Mutlu H,Meier M A R.Castor oil as a renewable resource for the chemical industry[J].European Journal of Lipid Science and Technology,2010(112):10 -30.
[3]Cristiane D M C,Jaqueline R B,Vanessa D C D.Highspeed counter-current chromatographic isolation of ricinine,an insecticide from Ricinus communis[J].Journal of Chromatography A,2009,1 216(19):4 290 -4 294.
[4]张智勇,陈永生,倪娜,等.蓖麻产品在农药中的应用及研究进展[J].内蒙古农业科技,2011(6):74-76.
[5]尚宇光,李淑芬,肖鸯布,等.植物中生物碱的提取工艺[J]. 现代化工,2002,22(S1):51 -54.
[6]Ferraz A C,Angelucci M E M,Da Costa M L,et al.Pharmacological evaluation of ricinine,a central nervous system stimulant isolated from Ricinus communis[J].Pharmacology Biochemistry & Behavior,1999,63(3):367 -375.
[7]赵光,李珺,张美,等.蓖麻壳水提物的镇痛作用及成分分析[J]. 药物分析杂志,2007,27(12):1 928-1 931
[8]张智勇,倪娜,李国瑞,等.蓖麻及其衍生制品在食品工业中应用的研究进展[J].食品工业科技,2012,33(22):428-431.
[9]邵建新,邓树娥,高景华,等.蓖麻粕的脱毒及营养分析[J]. 中国卫生检验杂志,2002,12(2):157 -158.
[10]邢美莲,贾鹏燕,冯冬燕,等.吴茱萸不同溶剂提取物抗氧化和抑菌性研究[J].作物杂志,2013(6):76-78.
[11]李作美,许晖,曾晓雄.鼎湖鳞伞多糖的抑菌作用及抗氧化活性[J].食品与发酵工业,2013,39(11):167-170.
[12]彭登峰,柴春祥,马玲,等.Mozzarella干酪提取液的抗菌活性[J]. 食品与发酵工业,2013,39(1):92-95.
[13]孔维宝,李阳,白万明,等.微博辅助提取油橄榄果渣多酚[J]. 食品与发酵工业,2011,37(4):233-237.
[14]娄在祥,王洪新,吕文平,等.微博辅助提取牛蒡叶多酚及其抗氧化、抗菌活性研究[J].食品与发酵工业,2010,36(1):161 -165.
[15]陈姿含,管骁,李景军.水溶性大豆多糖的微波浸提工艺优化[J].食品与发酵工业2012,38(10):194-198.
[16]穆莎茉莉,冀照君,张树军,等.响应面法优化蓖麻碱提取工艺[J].食品工业科技2012,33(21):206-209.

