两类外源刺激对啤酒废酵母发酵产谷胱甘肽的影响
万红贵,邓春亚,谭海涛,龚寅聪
1(南京工业大学生物与制药工程学院,江苏 南京,210009)
2(南京工业大学国家生化中心,江苏南京,211816)
三肽物γ-谷氨酰半胱氨酰甘氨酸或称谷胱甘肽(GSH),是细胞内合成的最重要的低分子量抗氧化剂。谷胱甘肽在许多生命活动中起着直接或间接的作用,这些作用包括自然抗氧化剂、对细胞的保护、氨基酸转运、免疫功能调节、促进糖类、脂肪及蛋白质代谢等作用[1],也能影响细胞的代谢过程,大量应用于医药保健、护肤美容、食品添加等行业[2-3],近年来谷胱甘肽广泛应用于恶性肿瘤、HIV、急性中毒、化疗、肝损伤、肾病综合征等多种疾病辅助治疗[4-6]。
目前,谷胱甘肽的生产方法主要以酶法和发酵法为主,与发酵条件和工艺流程的优化相关的研究尤为突出。前体氨基酸的添加[7]、表面活性剂的使用[8]、乙醇浓度的控制[9]、葡萄糖的流加等方案的设计大大提高了发酵法产谷胱甘肽的效率。但是绝大部分的发酵法产谷胱甘肽采用的都是常规菌种进行正常发酵,耗时耗力,不宜进行工业化。本文选取废酵母为研究对象,由于缩短了发酵耗时并降低了生产成本,谷胱甘肽的生产效率得到显著地提升。此外,对发酵过程中的菌体实施外援刺激以加速谷胱甘肽的合成的相关报道也并不多见。本文就氧化刺激和高渗刺激2个方面探讨了这2类刺激物对啤酒废酵母发酵产谷胱甘肽的影响。
1 材料和方法
1.1 菌种
啤酒废酵母:南京金陵啤酒厂提供。
1.2 培养基(g/L)
葡萄糖 25,蛋白胨 10,KH2PO41,K2HPO41,Mg-SO42.5,CaCl20.3,FeSO40.05,pH 5.5。
1.3 培养方法
按10 g/100 mL的接种量将抽滤得到的湿酵母接入用无菌水配制的上述培养基中,装液量40 mL/500 mL,30℃、200 r/min恒温培养24 h。在培养4 h后,加入少量前体氨基酸。
1.4 样品的处理
取一定体积的发酵液,5 500 r/mmin离心8 min,上清液用于残糖的测定,菌体用蒸馏水洗涤2次,加入40%的乙醇溶液30℃萃取2 h。5 500 r/min离心,萃取液适当稀释后作为谷胱甘肽的测定样品,离心获得的酵母菌体105℃烘干至恒重测生物量。
1.5 分析方法
残糖的测定:DNS法测定残糖浓度[10]。
谷胱甘肽含量的测定:DTNB 法[11]、ALLOXAN法[12]。
生物量:将离心获得的酵母菌体105℃烘干至恒重,称得干菌体的质量,作为菌体生长情况的量化指标。
谷胱甘肽合成酶系酶活[13]:将离心收集后的湿菌体1 g用磷酸缓冲液5 mL悬浮,超声波90 kHz破碎8 min,加入10 mL酶转化反应液(谷氨酸、甘氨酸、半胱氨酸各20 mmol/L,MgSO425 mmol/L,ATP 5 mmol/L),37℃反应30 min,酶活单位定义为每分钟催化合成1 μg GSH所需的酶量。
1.6 实验方案的确定
氧化刺激:选取H2O2和KMnO4两种氧化剂对发酵过程中的酵母细胞进行氧化刺激,测定酵母细胞的生长情况、谷胱甘肽的产量。比较各项参数,确定这两种物质的最适添加浓度和最适添加时间。
高渗刺激:以NaCl和KCl两种试剂给发酵中的酵母细胞以高渗环境,测定酵母细胞的生长情况、谷胱甘肽的产量及谷胱甘肽合成酶系酶活,确定最适浓度和最佳添加时间。
2 结果与讨论
2.1 氧化刺激物对谷胱甘肽产量的影响
2.1.1 氧化刺激物对酵母细胞生长及谷胱甘肽产量的影响
由于培养基中的葡萄糖在前9 h内基本耗光,细胞的生长趋于缓慢,谷胱甘肽的大量合成发生在细胞生长的中后期。因此,初步选择发酵后9 h为氧化刺激物的添加点,确定选择的刺激物对谷胱甘肽的生产是否有增产效果。由图1和图2可以看出虽然2种氧化剂对细胞的生长有一定的抑制作用,但却都能明显地提高谷胱甘肽的含量。这是因为在氧化应激条件下,细胞启动防御保护机制,产生较多的抗氧化剂。而对于酵母细胞来说,体内的谷胱甘肽系统是保护细胞免受氧化剂损伤的主要机制[14]。
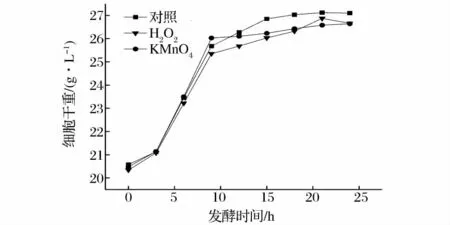
图1 氧化刺激物对酵母细胞生长的影响Fig.1 The effects of oxidation stimulus on the yeast’s growth
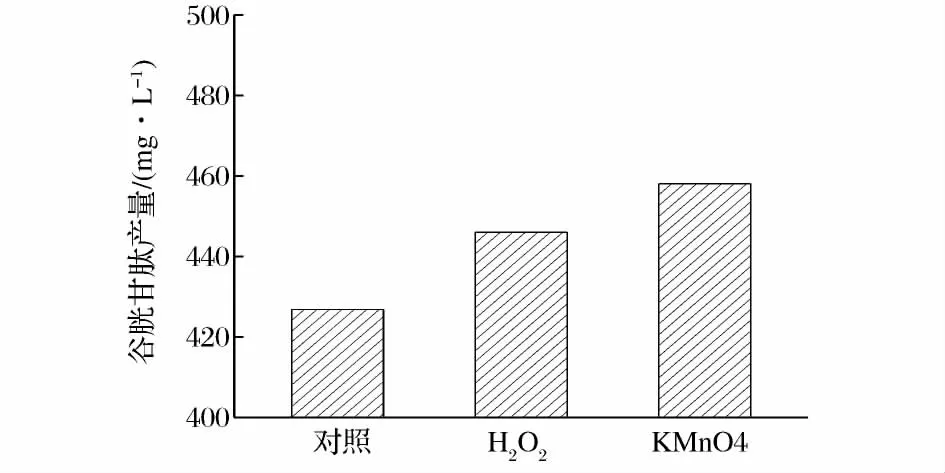
图2 氧化刺激物对谷胱甘肽产量的影响Fig.2 The effects of oxidation stimulus on the product of GSH
2.1.2 氧化刺激物的最佳添加量和添加时间
由图3和图4可以看出,无论是 KMnO4还是H2O2都只能在一定浓度范围内提升谷胱甘肽产量。氧化刺激物浓度过高,不仅菌体的生长会受到抑制,而且生产的谷胱甘肽会大量消耗用于保护细胞,使得谷胱甘肽的产量迅速下降。由图可以看出当KMnO4浓度在0.012 g/L左右、过氧化氢浓度在30 mmol/L左右时,废酵母产谷胱甘肽的产量达到最大。

图3 KMnO4浓度对谷胱甘肽产量的影响Fig.3 The effect of KMnO4concentration on the product of GSH

图4 H2O2浓度对谷胱甘肽产量的影响Fig.4 The effect of H2O2concentration on the product of GSH
在确定了2种氧化刺激物的最佳添加浓度后,在此基础上继续探讨了这两种物质发酵过程中的最佳添加时间。由于前9 h是酵母细胞的快速生长期,为了避免刺激物的添加阻滞细胞的生长引起后期谷胱甘肽合成受阻,因此将添加时间设计在9 h后。由图5和图6可以看出,对于KMnO4而言,添加时间越靠后越好,当添加时间为21 h时谷胱甘肽产量和比酶活均达到最大,产量高达512 mg/L,增产20%。而就H2O2来说,酶活和谷胱甘肽产量在发酵后12 h最大,此刻才是最佳的添加时间,产量达482.3 mg/L,增产13%。

图5 KMnO4添加时间对谷胱甘肽产量的影响Fig.5 The effects of KMnO4’s adding time on the product of GSH

图6 H2O2添加时间对谷胱甘肽产量的影响Fig.6 The effects of H2O2’s adding time on the product of GSH
2.2 高渗刺激对谷胱甘肽产量的影响
除了氧化剂会刺激酵母细胞,使得细胞产生应激反应,生成相应的保护性物质。给予细胞高渗环境,也有产生类似的效果。本实验选取KCl和NaCl两种盐溶液为细胞营造高渗环境,探索其对酵母细胞产谷胱甘肽的影响。
2.2.1 KCl和NaCl溶液对细胞生长及谷胱甘肽产量的影响
一定浓度的渗透处理对谷胱甘肽的产量会有所提高,但浓度过高会引起细胞脱水、质壁分离甚至死亡,阻碍细胞的正常生理功能,进而影响谷胱甘肽的产量。由图7可以看出当KCl和NaCl两种溶液在发酵液中的浓度为15 g/L时,谷胱甘肽的产量达到最大,高达458.3 mg/L,相比未添加盐溶液时的428.5 mg/L,产量有所提升。其中,KCl的增产效果要明显好于NaCl,可能因为KCl中含有K+,该离子是许多酶的激活剂,有利于刺激谷胱甘肽合成中的相关酶类。鉴于KCl的效果要好于NaCl,后期选择前者做进一步研究。
2.2.2 KCl溶液的最佳添加时间

图7 盐溶液浓度对细胞生长及谷胱甘肽产量的影响Fig.7 The effects of KCl and NaCl’s concentration on the product of GSH
由图8可以看出,在发酵15 h后添加15 g/L的KCl,谷胱甘肽产量、酶活均达到最大。分析可能是该时间段是谷胱甘肽酶系大量合成的关键时期,KCl的加入进一步刺激了酶的合成,谷胱甘肽产量明显增高。此时,谷胱甘肽产量达到475.2 mg/L,相比对照增产11.5%。
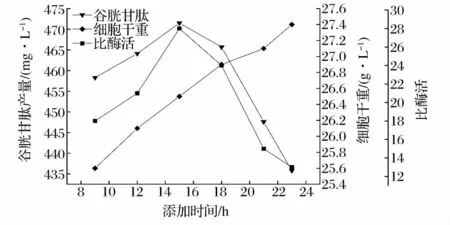
图8 KCl添加时间对谷胱甘肽产量的影响Fig.8 The effect of KCl’s adding time on the product of GSH
2.3 两种刺激物的联合使用
为了确定这两类刺激物是否具有叠加效应,现将两类物质联合使用,分别考察了高锰酸钾和过氧化氢与KCl联用时的增产效果。如图9所示。

图9 联用与单用的增产效果的对比Fig.9 The contrast of joint and single using stimulus
由图9可以看出,两类刺激物联用并没有产生叠加效应,相反比起单用还略有下降。经分析,可能是因为虽然刺激物可以促使细胞启动防御机制产生谷胱甘肽,但同时过强的刺激也会加速产生的谷胱甘肽的消耗,从而使得增产效果大打折扣。
3 结论
综合上述实验结果,我们发现氧化和高渗刺激都能一定程度地增加谷胱甘肽的产量。前者是因为氧化剂会促使细胞发生保护性反应,产生抗氧化物质;后者是因为高渗环境改变了细胞的生理功能,刺激了谷胱甘肽相关酶系的活性。本实验中,发酵21 h后添加0.012 g/L的KMnO4,谷胱甘肽的产量高达512 mg/L,增产20%;H2O2的最佳添加时间为发酵后12 h,最佳添加浓度为30 mmol/L左右,谷胱甘肽产量可达482.3 mg/L,增产13%;发酵15 h后用15 g/L的KCl溶液进行高渗刺激,谷胱甘肽产量提升至475.2 mg/L。两种类型的刺激物单独使用的效果要强于联合使用,单独使用KMnO4,谷胱甘肽的产量最高。
[1]Mary E A.Glutathione:an overview of biosynthesis and Modulation [J].Chem Biol Interact,1998,11(2):1.
[2]Yanping T,Wen J,Na G,et al.Inhibitory effects of glutathione on dengue virus production [J].Biochem Bioph Res Co,2010,397(3):420.
[3]LI Y,WEI GY,CHEN J.Glutathione:a review on biotechnological production [J].Appl Microbiol Biotechnol,2004,66(3):233.
[4]Dringen R G J,Hirlinger J.Glutathione metabolism in the brain[J].Biochem,2000,267(16):4912 - 4916.
[5]Micke P B K,Schlaak JF,Buhl R.Oral supplementation with whey proteins increases plasma glutathione levels of HIV-infected patients[J].Clin Invest,2001,31(2):171-178.
[6]Roum J H,Buhl R,McElvaney N G,et al.Systemic deficiency of glutathione in cystic fibrosis[J].Appl Physiol,1993,75(6):2419 -2424.
[7]WANG Z,TAN T W,SONG J.Effect of amino acids addition and feedback control strategies on the high-cell-density cultivation of Saccharomyces cerevisiae for glutathione production[J].Process Biochem,2007,42(1):108.
[8]WEI G,LI Y,DU G,et al.Effect of surfactants on extracellular accumulation of glutathione by Saccharomyces cerevisiae[J].Process Biochem,2003,38(8):1 133.
[9]WEN S H,ZHANG T,TAN T W.Maximizing production of glutathione by amino acid modulation and high-cell-density fed-batch culture of Saccharomyces cerevisiae[J].Process Biochem,2006,41(12):2 424.
[10]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994:10.
[11]T IETZE F.Enzymic method for quantitative determination of nano gram amounts of total and oxidized glutathione[J].Anal Biochem,1969,27(3):502-522.
[12]赵少欣,贺小贤.还原型谷胱甘肽简便测定法[J].食品科技,2007,191(9):219-220.
[13]沈立新、魏东芝.谷胱甘肽合成酶系的克隆、测序及表达[J].生物工程学报,2001,17(1):98-100.
[14]LIANG G B,LIAO X Y,DU G C,et al.A new strategy to enhance glutathione production by multiple H2O2-induced oxidative stresses in Candida utilis[J].Bioresource Technol,2009,100(1):350.

