Pd/C催化氧化木糖制备木糖酸
刘 敏,汤婷婷,赵国明,张继文,刘兴勇
(1.西北农林科技大学,陕西 杨凌 712100;2.中国科学院生物基材料重点实验室,中国科学院青岛生物能源与过程研究所,山东 青岛 266101;3.四川理工学院,四川 自贡 643000)
随着石油等不可再生资源的日益枯竭,以可再生的生物质为原料生产化工产品已经成为实现化工产业可持续发展的趋势[1-3],例如利用农业废弃物(玉米的穗轴、秸秆和棉桃等)中半纤维素水解产生的木糖氧化生产木糖酸。木糖酸在高效水泥黏合剂以及1,2,4-丁三醇的合成方面,具有广阔的应用前景[4,5]。利用醛糖制备糖酸主要有生物氧化法、均相催化氧化法、电解氧化法和多相催化氧化法。生物氧化法生产条件温和,对环境友好,但对实验条件要求严格,周期长,副产物难以分离,影响产品纯度[5,6]。均相催化氧化过程中间步骤复杂,副产物多,产物难以分离,催化剂难以回收利用,废弃物对环境产生较大危害[7-10]。电解氧化法[9,11]解决了生物发酵法和均相化学氧化法副产物多、步骤繁琐等缺点,但工业生产中能耗大,条件不易控制。多相催化氧化[9]采用负载型贵金属材料作为催化剂,氧气(或空气)作为氧化剂,在碱性条件下催化氧化糖类制备糖酸及相应衍生物。相对其他几种方法,多相催化氧化制备糖酸具有条件温和、产物选择性高、环境友好、产物易分离和催化剂可循环使用等优点[11-13]。目前,对于糖酸的生产研究主要集中在葡萄糖酸上,对多相催化氧化生产木糖酸的研究知之甚少[5]。本工作以木糖为原料制备木糖酸,选用Pd/C作催化剂,以空气为氧化剂氧化木糖制备木糖酸,考察了各种实验变量对反应的影响,确定实验的最佳工艺条件,为工业生产应用提供基础。
1 实验部分
1.1 实验方法
在四口烧瓶中加入200 mL 浓度为0.4 mol/L 的木糖溶液,用集热式恒温加热磁力搅拌器控制反应温度为50 ℃,然后将1 g 质量分数为5%的Pd/C 催化剂加入上述木糖溶液中,反应中不断滴加1 mol/L的KOH 溶液,用pH 计精确控制pH 值为9.00±0.1,反应4 h 后,采用Allegra X-22 型台式冷冻离心机离心,得上清液,利用紫外可见分光光度计和高效液相色谱仪(HPLC)分析,色谱柱采用HPX-87H,柱温55 ℃,最大柱压为40 MPa,流动相为5 mmol/L H2SO4水溶液,流速为0.5 mL/min。将紫外检测(UV 波数为210 nm)和示差检测器串联进行检测,分析时间为20 min。最后根据分析结果计算转化率和选择性。在催化反应过程连续通入一定流速的空气。
1.2 木糖与木糖酸标准曲线的制备
配制一系列浓度的木糖(质量分数大于或等于99.0%,Hasheng Biothech)溶液,采用DNS 法加热处理,并用紫外可见分光光度计对木糖标准品进行检测,制作木糖的标准曲线(图1),木糖标准曲线的线性良好,r为0.999 1。配制一系列木糖酸(Toronto Research Chemicals Inc)溶液进行HPLC检测,绘制木糖酸的标准曲线(图2),木糖酸标准曲线的线性良好,r为0.999 1。
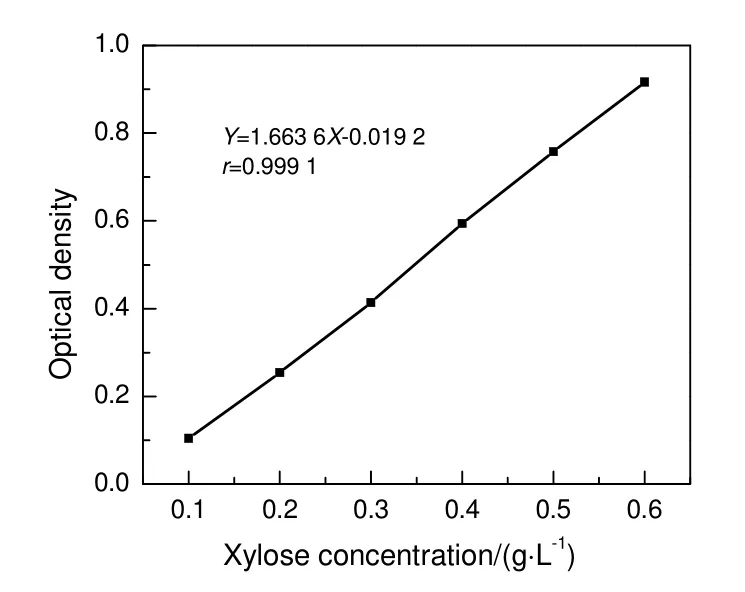
图1 木糖标准曲线Fig.1 Xylose standard curve

图2 木糖酸标准曲线Fig.2 Xylose acid standard curve
1.3 Pd/C 催化剂回收利用
反应结束后,将得到的溶液进行抽滤,使催化剂与滤液分离,催化剂用去离子水搅拌洗涤5 次后,自然晾干,重复使用。
2 结果与讨论
2.1 pH 值对反应性能的影响
反应温度为50 ℃,取200 mL 浓度为0.4 mol/L 木糖溶液,空气流速(V空气)为0.4 L/min,催化剂采用1.0 g 质量分数为5%的Pd/C,反应时间为4 h,用KOH 调节pH 值,pH 值对木糖氧化反应的影响见图3。由图可见,在pH 值为8~12 时,木糖转化率很高,均在99%以上,最高时可达99.2%。在pH 值为9 时,木糖酸选择性最高,达到99.1%;pH 值在8~9 时,随着pH 值增大,选择性增加;当pH 值高于9 时,随着pH 值增加,选择性降低;当pH 值高于10 时,随pH 值继续增大,木糖酸选择性明显下降。这可能是由于pH 值为8 时,中和产物木糖酸的碱浓度不够高,反应生成的木糖酸不易从催化剂表面移出,导致进一步发生副反应;当pH 值为9 时,底物木糖反应基团醛基被活化,且产物木糖酸容易与催化剂分离[14],选择性高;当溶液pH 值过高时,底物木糖发生分解,副产物增多,降低选择性[15]。综上所述,Pd/C 催化木糖合成木糖酸反应的pH 值为9 较合适。

图3 pH 值对木糖转化率及木糖酸选择性的影响Fig.3 Effect of pH value on xylose conversion and xylose acid selectivity

图4 温度对木糖转化率及木糖酸选择性的影响Fig.4 Effect of temperature on xylose conversion and xylose acid selectivity
2.2 反应温度对反应性能的影响
取200 mL 浓度为0.4 mol/L 木糖溶液和1.0 g Pd/C 催化剂,pH 值为9,V空气为0.4 L/min,反应时间为4 h,反应温度对木糖氧化反应性能影响见图4。由图可以看出,反应温度从20 ℃提高到50 ℃时,木糖转化率随反应温度的升高而增加,木糖酸的选择性随反应温度的升高先增加后减小,当反应温度为50 ℃时,达到最大值。这是由于反应温度过高,发生了副产物。故Pd/C 催化木糖转化为木糖酸反应合适的温度为50 ℃。
2.3 催化剂用量对反应性能的影响
取200 mL 浓度为0.4 mol/L 木糖溶液,在V空气为0.4 L/min,pH 值为9,反应温度为50 ℃的条件下,考察催化剂用量对木糖氧化反应性能的影响,结果见图5。由图可知:催化剂用量从0.1 g 增加到1.0 g 时,木糖转化率随催化剂用量的增加而升高,当催化剂量继续增加时,木糖转化率变化不明显;木糖酸选择性随催化剂用量增加变化不明显。这可能是由于在底物量一定的情况下,催化剂量低于1.0 g 时,催化剂所提供活性位点不足以使木糖完全转化,随着催化剂用量的增加,所提供活性位点增加,转化率升高。因此,Pd/C 催化剂用量为1.0 g 较合适。

图5 催化剂用量对木糖转化率及木糖酸选择性的影响Fig.5 Effect of catalyst dosage on xylose conversion and xylose acid selectivity
2.4 底物浓度对反应性能的影响
取200 mL 一定浓度的木糖溶液和1.0 g Pd/C 催化剂,在V空气为0.4 L/min,pH 值为9,反应温度为50 ℃,反应时间为4 h,考察木糖浓度对木糖氧化反应的影响,结果见图6。由图可知,在木糖的初始浓度为0.4~4.0 mol/L 时,木糖的初始浓度越低,最终的转化率越高。这是由于在催化剂量一定的情况下,底物浓度过高时,氧化还原循环过程中,电子传递这一限速步骤受到限制,使底物中醛基氧化速度降低,进而降低转化率[16]。增加木糖初始浓度,木糖酸选择性变化不大,基本维持在95.0%~99.1%。

图6 木糖初始浓度对转化率及木糖酸选择性影响Fig.6 Effect of initial concentration on xylose conversion and xylose acid selectivity
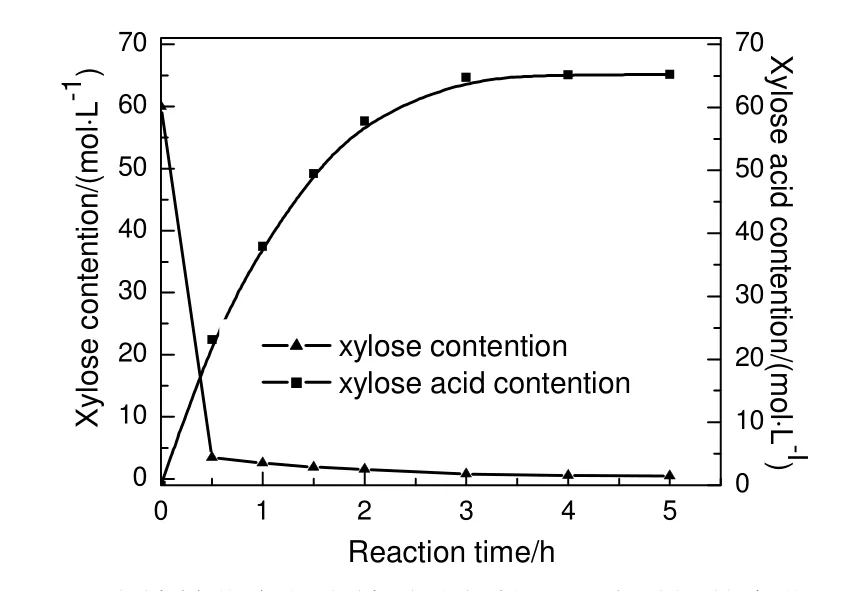
图7 木糖转化率与木糖酸选择性随反应时间的变化Fig.7 Changes of xylose conversion and xylose acid selectivity with reaction time
2.5 木糖与木糖酸浓度随反应时间的变化情况
取200 mL 浓度为0.4 mol/L 木糖溶液和1.0 g Pd/C 催化剂,反应温度为50 ℃,V空气为0.4 L/min,pH 值为9 的条件下,考察木糖氧化反应随时间的变化,结果见图7。由图可知:在最初0.5 h,木糖浓度急剧降低;在0.5 h 后木糖浓度降低速率减缓。与此同时,在最初0.5 h 木糖酸浓度迅速增加至23.1 g/L;反应时间从3 h 延长至4 h 后,木糖酸浓度增加0.34 g/L,之后增加较为缓慢,故反应时间选择4 h。
2.6 催化剂重复使用性能
取200 mL 浓度为0.4 mol/L 木糖溶液和1.0 g Pd/C 催化剂,在V空气为0.4 L/min,pH 值为9,反应温度为50 ℃的条件下,反应4 h,考察催化剂重复使用性能,结果见图8。由图可知,在前3 次,底物转化率均在90%以上,随着使用次数的增加,底物转化率持续下降,而产物的选择性随着催化剂使用次数的增加基本不变。
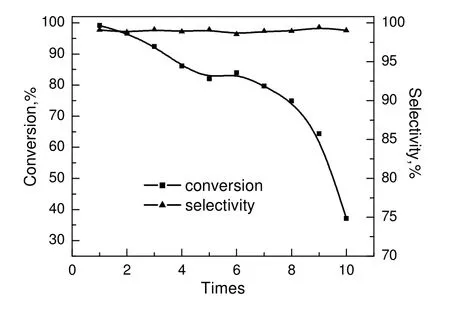
图8 催化剂使用寿命对底物转化率和产物选择性的影响Fig.8 Effect of cycle times on xylose conversion and xylose acid selectivity
3 结 论
采用Pd/C催化剂催化氧化木糖合成木糖酸,在合适的反应条件下,底物木糖转化率高达99%以上,产物木糖酸选择性超过99%。在该条件下,催化剂具有较好的重复使用性能。与传统的氧化方法相比,该方法对环境产生的污染要小得多。
[1]Chheda J N, Huber G W, Dumesic J A.Liquid-phase catalytic processing of biomass-derived oxygenated hydrocarbons to fuels and chemicals[J].Angewandte Chemie International Edition, 2007, 46(38):7164-7183.
[2]Corma A, Iborra S, Velty A.Chemical routes for the transformation of biomass into chemicals[J].Chemical Reviews-Columbus, 2007,107(6):2411-2502.
[3]Maki-Arvela P, Holmbom B, Salmi T, et al.Recent progress in synthesis of fine and specialty chemicals from wood and other biomass by heterogeneous catalytic processes[J].Catalysis Reviews Science and Engineering, 2007, 49(3):197-340.
[4]Niu W, Molefe M N, Frost J.Microbial synthesis of the energetic material precursor 1,2,4-butanetriol[J].Journal of the American Chemical Society, 2003, 125(43):12998-12999.
[5]Chun B W, Dair B, Macuch P J, et al.The development of cement and concrete additive[J].Applied Biochemistry and Biotechnology,2006, 129(132):645.
[6]Buchert J, Viikari L, Linko M, et al.Production of xylonic acid by pseudomonas fragi[J].Biotechnology Letters,1986, 8(8):541-546.
[7]Doneva T, Vassilieff C, Donev R.Catalytic and biocatalytic oxidation of glucose to gluconic acid in a modified three-phase reactor[J].Biotechnology Letters, 1999, 21(12):1107-1111.
[8]Larm O, Scholander E, Theander O.Bromine oxidation of methylα-andβ-pyranosides ofD-galactose,D-glucose, andD-mannose[J].Carbohydrate Research, 1976, 49:69-77.
[9]Abbadi A, Van Bekkum H.Highly selective oxidation of aldonic acids to 2-keto-aldonic acids over Pt-Bi and Pt-Pb catalysts[J].Applied Catalysis A:Genera, 1995, 124(2):409-417.
[10]Auer E, Freund A, Pietsch J, et al.Carbons as supports for industrial precious metal catalysts[J].Applied Catalysis A:General, 1998,173(2):259-271.
[11]Delidovich I V, Taran O P, Matvienko L G, et al.Selective oxidation of glucose over carbon-supported Pd and Pt catalysts[J].Catalysis Letters, 2010, 140(1/2):14-21.
[12]Krishnankutty N, Li J, Albert V M.The effect of Pd precursor and pretreatment on the adsorption and absorption behavior of supported Pd catalysts[J].Applied Catalysis A:General, 1998,173(2):137-144.
[13]陈翠莲, 魏小兰, 沈培康.葡萄糖在纳米 Pt/C 电极上的电催化氧化[J].电化学, 2006, 12(1):20-24.Chen Cuilian, Wei Xiaolan, Shen Peikang.Electrocatalytic oxidation of glucose on nano Pt/C electrode[J].Electrochemistry, 2006, 12(1):20-24.
[14]Rfgis G, MichNe B, Pierre G.Chemoselective catalytic oxidation of glycerol with air on platinum metal[J].Applied Catalysis A:General, 1995, 127(1/2):165-176.
[15]Serena B, Laura P, Michele R.Selective oxidation of d-glucose on gold catalyst[J].Journal of Catalysis, 2002, 206(2):242-247.
[16]Larry A.L, Dennis C J.Concentration dependence of the mechanism of glucose oxidation at gold electrodes in alkaline media[J].Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 1989, 262(1/2):167-182.

