乳腺癌中17号染色体倍体性分析
陈顺平 余英豪 吴文乔 周宗楷 谢飞来 沈洪武 王 烈
乳腺癌是女性最常见的恶性肿瘤之一,随着分子生物学技术普遍应用,近年来对乳腺癌深入的研究提示了人类表皮生长因子受体2(Her-2)与乳腺癌的关系尤其密切[1],与肿瘤发生发展与预后相关,有25%~30%的浸润性乳腺癌和80%的乳腺导管内癌患者有Her-2基因扩增或蛋白过表达[2],但对乳腺癌相关染色体倍体性与肿瘤恶性程度相关的研究较少,结论也不一致。有学者认为乳腺癌二体性肿瘤比多体性肿瘤预后为好[3],但也有研究者得出完全相反的结论[4]。荧光原位杂交(FISH)技术是现今常用的分子技术,可检测基因的扩增及染色体倍体性。因此,本研究应用了FISH及免疫组化(IHC)技术,检测浸润性乳腺癌中Her-2表达情况和17号染色体倍体性情况及其与临床病理参数的关系,并分析其临床病理意义。
1 材料与方法
1.1 材料
收集2010年5月-2012年12月我院收治的临床资料完整的300例浸润性乳腺癌,年龄25~89岁,中位44.5岁;其中年龄 <50岁158例,≥50岁142例。所有标本经10%中性缓冲福尔马林液固定,常规石蜡包埋。同时进行IHC及FISH检测。
1.2 主要试剂与仪器
酸性亚硫酸钠(美国Simga产品),蛋白酶K(美国罗氏产品),探针:[GLP Her-2/CSP17探针](购于北京金菩嘉公司),Olympus BX51型荧光显微镜,Dake原位杂交仪,电热恒温水槽,隔水式恒温培养箱。免疫组化试剂购于福州迈新生物公司,标记均设阳性对照,并用PBS缓冲液代替一抗作为阴性对照。
1.3 方法
1.3.1 FISH检测及其结果判断 方法:①将3 μm组织涂胶切片浸于二甲苯中脱蜡至水。②50℃30%酸性亚硫酸钠处理组织切片30~40 min。③室温下2×SSC×3 min×2次漂洗。④在组织中滴加自配即用型蛋白酶K,37℃预热孵育盒中消化20~25 min。⑤室温下2×SSC×3 min×2次漂洗,乙醇梯度脱水固定,自然干燥。⑥避光环境中,配制探针混合液(7 μl杂交缓冲液、1 μl去离子水和2 μl探针)并滴于杂交区域,83℃自动杂交仪中变性6 min后置37℃过夜杂交。⑦洗涤:次日移去盖玻片,46℃下,玻片置于2×SSC×10 min×2次,2×SSC/0.1%NP-40溶液中 5 min。玻片干燥后加DAPI复染液,置于暗盒中复染数分钟后,在OLYMPUS BX51荧光显微镜DAPI/FIFC/RHOD三色滤光镜激发下观察间期细胞荧光杂交信号。结果判定:①Her-2基因:计数细胞核内红色的Her-2基因荧光信号和17号染色体的绿色荧光信号的数目比值,即Ratio值(Ratio=30个细胞核中红色信号总数/绿色信号总数)。Ratio值<1.8为阴性,提示无基因扩增;Ratio>2.2为阳性,提示基因扩增;Ratio在1.8~2.2时,增加计数细胞,重新对比。②17号染色体多体性标准:每个细胞中17号染色体数目在1.76~2.25 为二体性,≥2.26 为多体性[5]。
1.3.2 IHC检测 方法及主要步骤:采用EnVision两步法,严格按照说明书进行操作。结果判定:①Her-2蛋白判断标准(2009年最新修订意见):癌细胞胞膜着色为阳性染色,≥30%的肿瘤细胞呈现强及完整的细胞膜着色为阳性(+++),轻及中度完整的细胞膜着色为可疑(++),不完整染色或无染色为阴性(+或-)。②ER和PR蛋白判定标准:显微镜下计数100个肿瘤细胞中阳性细胞数,以任意5个高倍镜视野中阳性细胞占细胞总数的百分数以及核染色程度作为评定依据,阳性细胞数≤5%为0分;6% ~25%为1分;26% ~50%为2分;>50%为3分。染色强度:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。上述两项得分的乘积,为其最后得分。同一视野如有染色强度不一,取其平均值作为最后得分。0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),6分以上为强阳性(+++)。
1.4 统计学方法
应用SPSS 17.0统计软件,结果比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 17号染色体多体与Her-2基因扩增及蛋白表达的关系
300例浸润性乳腺癌标本中,17号染色体多体106例,占 35.33%;Her-2基因扩增 101例,占33.67%。Her-2基因扩增病例中17号染色体多体占55.44%(56/101),无扩增病例中其占 25.13%(50/199);本组 Her-2蛋白(- /+)163例(54.33%),Her-2蛋白(++/+++)137例(45.67%),Her-2蛋白(-/+)中17号染色体多体占15.34%(25/163),Her-2蛋白(++/+++)中其占59.12%(81/137),差异均有显著统计学意义(P均<0.01)(表1)。
2.2 17号染色体多体与浸润性乳腺癌临床病理参数的关系
17号染色体多体与患者年龄、淋巴结转移及TNM分期均无相关性(P均>0.05,表1)。
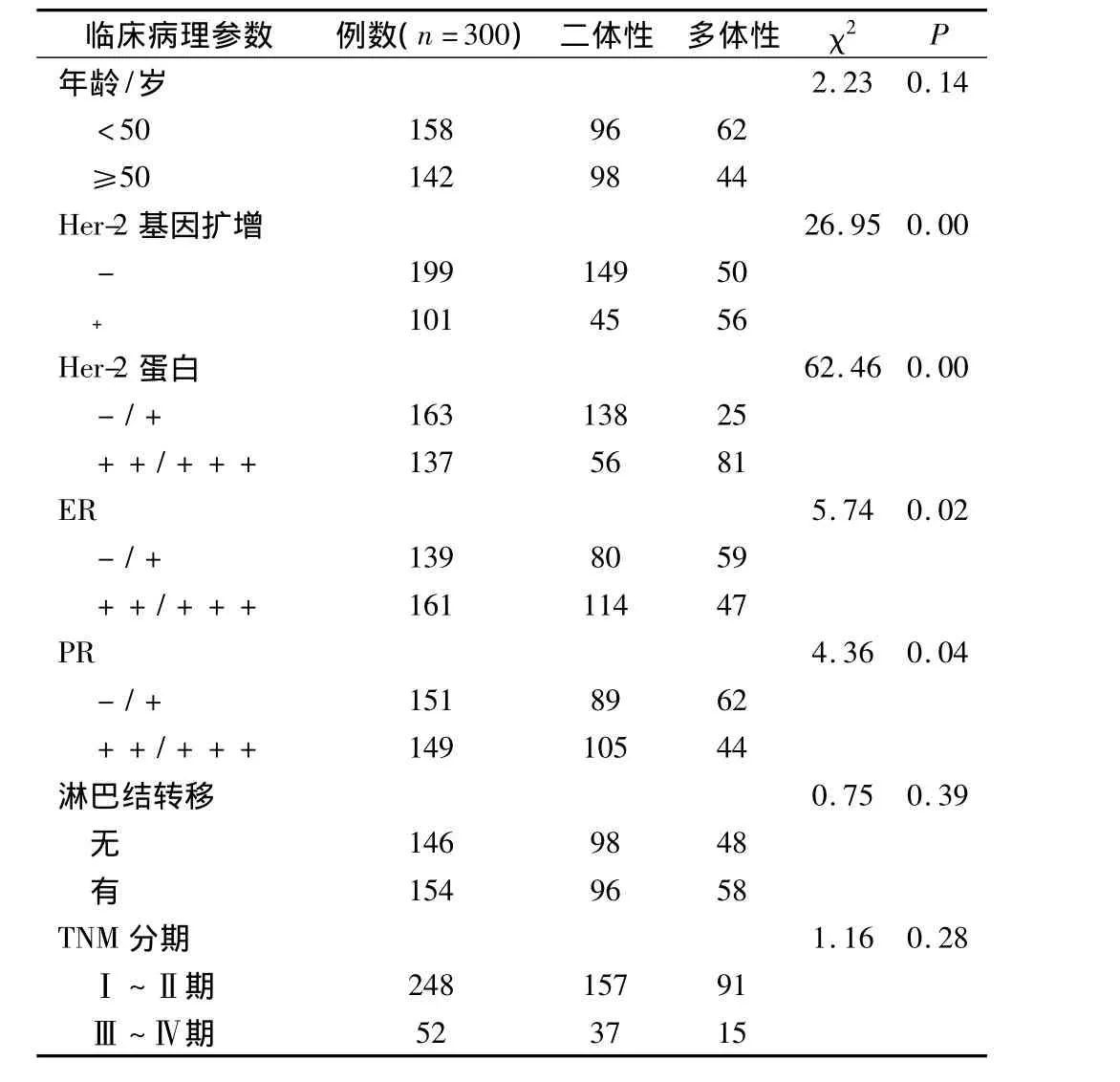
表1 17号染色体倍体性与浸润性乳腺癌临床病理参数的关系/例
3 讨论
Her-2是1种原癌基因,定位于17号染色体,主要参与肿瘤细胞生长、增殖及分化,其过度表达常提示肿瘤恶性程度高、预后差,但该基因扩增的患者使用赫赛汀效果好,这已在诸多有关乳腺癌报道中得到证实。而有关17号染色体的研究较少,且结果也不尽相同,有13%~46%的浸润性乳腺癌患者癌细胞为17号染色体多体,多体可能与乳腺癌的预后有关[5-6],但也有一些学者提出相反的结论[7]。FISH和IHC技术是现今较常用基因扩增与蛋白表达检测的方法,不仅准确率高,操作也简便,已在临床普及应用,而且FISH能定量出l7号染色体的倍体性,这2种方法相互补充可为有效判断乳腺癌预后提供更多的理论依据。
本文应用FISH和IHC技术,对300例乳腺癌患者的Her-2及17号染色体进行检测,结果显示300例浸润性乳腺癌标本中,17号染色体多体占35.33%,与国内外文献报道相一致。17号染色体多体在Her-2基因扩增中占55.44%;无扩增中占25.13%,而在Her-2蛋白(- /+)占15.34%;(++/+++)占 59.12%,差异均有统计学意义,提示浸润性乳腺癌中17号染色体多体性更多的表现在Her-2方面,随着Her-2基因扩增或者蛋白表达加强,多体情况不断增加,同时结果也表明了17号染色体多体与Her-2的表达密切相关,可能是在Her-2表达异常时,癌组织细胞染色体更加不稳定造成的。且这种现象可能影响了Her-2基因或蛋白结果判断的不确定性,由于染色体增加引起了Her-2基因位点的增加,可能造成了Her-2蛋白表达相应增强,而根据判断标准Her-2基因并未扩增,这种现象可能是2种方法在检测Her-2蛋白(++/+)结果不一样的主要原因。所以FISH检测Her-2基因扩增判断标准中以17号染色体为内参照,一方面可以代表实验的内质控情况,判断实验是否成功。如果组织细胞酶消化不合适情况下,无17号染色体绿色信号,单靠HER-2红色信号判断,很容易造成假阴性或假阳性。另一方面可以排除17号染色体多体引起了假扩增。但是IHC方面没有内参照,而根据表1染色体多体可能是IHC假阳性原因,说明FISH在检测基因扩增的同时还应检测17号染色体倍体性,其结果比IHC更稳定,更准确。近来Varga等[8]认为乳腺癌中Her-2基因和17号染色体着丝粒可能存在共同扩增。国内学者杨飞等[9]也对此进行相关讨论。也有学者把着丝粒附近的基因如p53、SMS或RARA作为代替17号染色体着丝粒作为内参照,发现部分乳腺癌患者Her-2状态由无扩增变为扩增的现象[10-11],所以他们认为Her-2基因扩增判断标准中以17号染色体着丝粒为内参照不准确,我们认为上述学者的结论应得进一步探讨,如果存在共扩增的话,有Her-2基因扩增的组织细胞内簇状红色信号应该也存在同样成簇状的17号染色体着丝粒绿信号,然而,我们在实际FISH检测中并未发现。且Her-2扩增或无扩增情况下绿色信号数大部分都在6个信号点以下,所以我们认为应该不存在会造成Her-2扩增引起17号染色体着丝粒共扩增的现象。且着丝粒DNA序列比p53、SMS或RARA等基因更加稳定,而着丝粒DNA序列中发生基因扩增,片段插入、缺失等突变较少,是相对保守的DNA序列,而一般探针的设计也是选择着丝粒最为保守的一段碱基对作为染色体探针代表。但是p53、SMS或RARA等基因发生基因突变几率较大,特别是p53发生缺失是肿瘤发生发展的常见的表现形式,一旦发生基因突变,根据判断标准说明Her2基因有无扩增并不准确。所以我们认为以17号染色体着丝粒为内参照较为准确。
在本组病例所得结果中,17号染色体多体显示了与Her-2不同的遗传学特征,在发病年龄,TNM分期以及淋巴结转移等与多倍体组无明显差异,说明其不是影响肿瘤发展相关因素,与肿瘤发展无明显联系,可能只是乳腺癌引起了1种染色体不稳定的表现。同时,表1结果中17号染色体在ER、PR(-/+)与(++/+++)有差异,而ER、PR表达与内分泌治疗之间密切相关,17号染色体多体的乳腺癌患者是否说明内分泌治疗效果差,至今尚未清楚,将有待于进一步研究。
综上所述,我们认为17号染色体多体并未在浸润性乳腺癌中显示出不良的病理临床意义,可能是FISH和IHC方法检测结果不同的因素,17号染色体多体是乳腺癌常见遗传学改变,是乳腺癌引起的1种染色体不稳定表现形式。其多体性与乳腺癌病情发展无关。
[1]Arteaga CL.Epidermal growth factor receptor dependence in human tumors:more than just expression?〔J〕.Oncologist,2002,7(4):31-39.
[2]Ross JS,Gray GS.Targeted therapy for cancer:the Her-2/neu and Herceptin story〔J〕.Clin Leadersh Manag Rev,2003,17(6):333-340.
[3]Takehisa M,Sasa M,Bando Y,et al.Chromosomal aneusomy(chr 1,11,17)detected by f1uorescence in situ hybridization may be a prognostic factor in breast cancer〔J〕.Anticancer Res,2007,27(2):1073-1078.
[4]Mottolese M,0rlandi G,Sperduti I,et al.Biopathologic characteristics re1ated to chromosome 11 aneusomy and cyclin D1 gene status in surgical1y resected stage I andⅡbreast cancer:Identification of an adverse prognostic profile〔J〕.Am J Surg Pathol,2007,31(2):247-254.
[5]Torrisi R,Rotmensz N,Baqnardi V,et al.HER2 status in early breast cancer:relevance of cell staining patterns,gene amplification and polysomy 17〔J〕.Eur J Cancer,2007,43(16):2339-2344.
[6]Vanden B I,Van L P,Drijkoningen M,et al.Polysomy 17 in breast cancer:clinicopathologic significance and impact on Her-2 testing〔J〕.J Clin Oncol,2008,26(30):4869-4874.
[7]Risio M,Casorzo L,Redana S,et al.HER2 gene-amplified breast cancers with monosomy of chromosome 17 are poorly responsive to trastuzumab-based treatment〔J〕.Oncol Rep,2005,13(2):305-309.
[8]Varga z,Tubbs RR,Wang Z,et al.Co-amplification of the HER2 gene and chromosome 17 centromere:a potential diagnostic pitfall in HER-2 testing in breast cancer〔J〕.Breast Cancer Res Treat,2012,132(3):925-960.
[9]杨 飞,杨文涛,步 宏.乳腺癌HER2检测中的新问题〔J〕.中华病理学杂志,2012,41(5):289-292.
[10]Ross JS.Human epidermal growth fator receptor 2 testing in 2010:does chromosome 17 centromere copy humber make any difference?〔J〕.J Clin OntoI,2010,28(28):4293-4295.
[11]Tse CH,Hwang HC,Goldstein Lc,et al.Determining true-HER2 gene status in breast with polysomy by using alternative chromosome 17 refereuce genes:implications for anti-HER targeted therapy〔J〕.J Clin Oncol,2011,29(31):4168-4174.

